针刺对脑缺血再灌注模型大鼠ROCK表达影响的动态观察
王颖
(安徽中医药大学第二附属医院,合肥 230061)
缺血性脑血管病是一类严重危害人类健康的疾病,致死率和致残率较高,发病率逐年上升,且有年轻化的趋势。急性脑梗死的主要治疗目标是抢救可逆性缺血损害。研究表明,在众多因素中,治疗时机的选择也是影响缺血损害有效保护的关键因素之一。超过一定的时间界限,缺血损害则变为不可逆,此时无论采取任何治疗手段都收效甚微。因此,在治疗上出现时间窗概念。Pulsinelli WA等[1]首先提出了治疗时间窗,其认为在脑缺血发作后,于一定时间内给予积极治疗,可减轻脑损伤的程度,促进机能恢复,并改善长期的预后。这个允许的时间称为治疗时间窗。Rho/ROCK信号通路参与了多种脑梗死危险因素的产生,在脑梗死急性期和亚急性期以及恢复期过程中均起着重要作用,抑制脑缺血后 ROCK活性已经成为治疗缺血性脑血管病的新靶点。针刺治疗缺血性脑卒中临床取得比较满意的疗效[2-6],但其对于Rho/ROCK信号的影响及其对下游效应因子的调控作用尚不明确,故笔者通过实验研究,观察不同时间针刺治疗对 Rho/ROCK信号的影响,明确针刺抑制局灶性缺血性再灌注大鼠 ROCK表达的最佳时间段,以最大程度保护和改善缺血后的脑组织损伤,为临床选择最佳时间应用针刺治疗缺血性脑血管病提供新的实验证据和理论依据。
1 材料与方法
1.1 实验动物与分组
选取180只成年Wista雄性大鼠(安徽医科大学实验动物中心提供),体重(250±30)g,鼠龄为12 w,随机分为空白组、假手术组、模型组和针刺组,模型组和针刺组又分为6 h、24 h、48 h、72 h和2 w5个亚组,共12组,每组15只。
1.2 实验试剂及仪器
RIPA细胞裂解液及BCA蛋白质定量试剂盒(碧云天生物技术研究所提供);SDS(德国Serva公司);甘氨酸(美国AMRESCO公司);TEMED与Tris碱(美国Sigma公司);PVDF膜(美国Millipore公司);超薄切片机(瑞典LKB-V型);过硫酸氨、丙烯酰胺(美国Sigma公司);电化学发光(ECL)试剂盒(美国 Pierce公司);甲醇购于上海中试化工总公司;丙烯酰胺(Fluka公司);甲叉双丙烯酰胺(美国 AMRESCO公司抗体);Rock1(美国Proteintech公司,编号 21850-1-AP);Actin(北京中杉金桥生物技术有限公司,编号 TA-09);二抗分别为山羊抗小鼠 IgG(编号 ZB2305)和山羊抗兔 IgG(编号ZB2301)。
AF-10型自动制冰机(意大利 SCOTSMAN);EPS300型电泳仪、VE-180型电泳槽和 VE-186型转膜仪(Tanon);LX300型微量离心机(海门市其林贝尔仪器制造有限公司);JW-3021HR高速台式冷冻离心机(安徽嘉文仪器装备有限公司);微量移液器(德国Eppendorf);针灸针(苏州天协针灸器械有限公司);鱼线(安徽太平洋渔具有限公司)。
1.3 造模方法
使用线栓法阻塞大鼠右侧大脑中动脉复制局灶性脑缺血模型,术后大鼠出现左侧偏瘫,提尾悬拉时出现左上肢蜷缩屈曲或被动性过度伸展,同时出现向左侧转圈、跌倒,即可纳入实验。
1.4 模型评估
神经功能缺失评估与死亡率分别于建模前、麻醉清醒后及术后对所有实验大鼠参考Longa EZ等[7]的方法进行神经功能缺失评估,其中每个时间点每组各取5只大鼠评分结果进行统计分析。0分为无神经功能缺失;1分为左侧前肢内收、屈曲;2分为自主运动时身体向左侧划圈;3分为身体向左侧倾倒;4分为不能自主行走并伴有意识障碍。1分以上收入实验分组,观察期内死亡动物剔除并予以补足。
1.5 处理方法
所有大鼠给予普通饮食,假手术组仅作颈动脉分离,空白组和假手术组于造模后第2天取材检测,模型组中各小组分别于造模后6 h、24 h、48 h、72 h和2 w取材检测。
针刺组分别于再灌注后 6 h、24 h、48 h、72 h和2 w进行针刺。取百会、大椎、足三里。大鼠百会穴位于顶骨正中;大椎穴定位第7颈椎与第1胸椎间,背部正中;足三里穴定位在膝关节后外侧,在腓骨小头下约 5 mm处。采用 0.35 mm×13 mm毫针刺入穴位,进针后轻度捻转,以局部轻颤为度,留针 30 min,期间每15 min行针1次。
1.6 观察指标
1.6.1 神经行为学评估
各组大鼠经各自处理后,对其进行神经行为学评估,依然参考Longa EZ等[7]的方法。
1.6.2 免疫组织化学检测
①组织匀浆及蛋白的提取;②电泳;③转膜;④封闭;⑤一抗孵育;⑥二抗孵育;⑦蛋白检测。
1.7 统计学方法
采用SPSS17.0软件进行统计分析。计量资料采用均数±标准差表示,以析因设计的方差分析作差异的显著性分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 模型组和针刺组大鼠缺血再灌注各时间点神经功能评分比较
由表1、图1可见,模型组大鼠缺血再灌注各时间点神经功能评分与针刺组比较差异均具有统计学意义(P<0.05)。针刺组再灌注6 h的神经功能评分与同组其他再灌注时间比较差异均具有统计学意义(P<0.05)。
2.2 各组不同时间段ROCK表达比较
由表2及图2、图3可见,模型组(缺血再灌注6 h、24 h、48 h、72 h)ROCK表达与空白组比较,均显著上调(P<0.05),其中6 h ROCK表达达到峰值。针刺组(缺血再灌注6 h、24 h、48 h)ROCK表达与模型组(缺血再灌注 6 h、24 h、48 h)点对点比较,差异均具有统计学意义(P<0.01,P<0.05),其中针刺缺血再灌注6 h组ROCK下调最为显著。而针刺组(缺血再灌注72 h、2 w)ROCK表达与模型组(缺血再灌注72 h、2 w)比较,差异均无统计学意义(P>0.05)。
2.3 针刺组与模型组神经功能缺损评分与ROCK表达相关性分析
由图 4可见,针刺 6 h组脑缺血再灌注模型大鼠ROCK表达下调最为显著,与针刺组(24 h、48 h、72 h)比较,差异均具有统计学意义(P<0.05)。同时针刺6 h组神经功能评分下调幅度最大,与针刺组(24 h、48 h、72 h)比较,差异均具有统计学意义(P<0.05)。
表1 模型组和针刺组大鼠缺血再灌注各时间点神经功能评分比较 (±s,分)

表1 模型组和针刺组大鼠缺血再灌注各时间点神经功能评分比较 (±s,分)
注:与模型组比较1)P<0.05;与同组再灌注6 h比较2)P<0.05
组别 n 再灌注6 h 再灌注24 h 再灌注48 h 再灌注72 h 再灌注2 w模型组 75 3.20±0.41 2.60±0.51 2.00±0.65 1.40±0.51 0.80±0.41针刺组 75 2.80±0.411) 2.20±0.411)2) 1.60±0.511)2) 1.00±0.651)2) 0.60±0.511)2)
表2 各组大鼠缺血再灌注各时间点ROCK表达活性比较 (±s)

表2 各组大鼠缺血再灌注各时间点ROCK表达活性比较 (±s)
注:与模型组比较1)P<0.01,2)P<0.05;与同组再灌注6 h比较3)P<0.05;与空白组比较4)P<0.05;与假手术组比较5)P<0.05
组别 n 再灌注6 h 再灌注24 h 再灌注48 h 再灌注72 h 再灌注2 w空白组 15 1.31±0.02 - - - -假手术组 15 1.32±0.02 - - - -模型组 75 2.96±0.014)5) 2.81±0.014)5) 2.71±0.014)5) 2.62±0.014)5) 1.47±0.02针刺组 75 1.77±0.021) 1.98±0.022)3) 2.19±0.022)3) 2.57±0.013) 1.47±0.013)

图1 模型组和针刺组大鼠脑缺血再灌注各时间点神经功能评分

图2 模型组不同时间ROCK表达比较
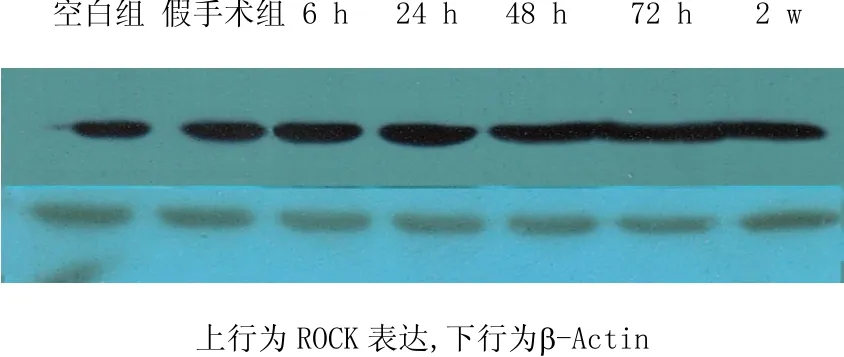
图3 针刺组不同时间ROCK表达比较
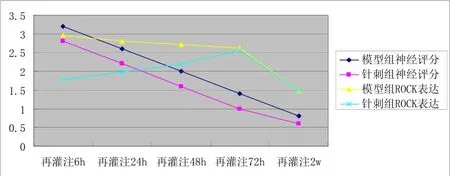
图4 两组神经功能缺损评分与ROCK表达相关性分析
4 讨论
Rho/ROCK通路是人和动物体内普遍存在的一条信号传导通路,它参与多种生物学行为,包括细胞增殖与凋亡、调控细胞形态维持、细胞粘附与迁移等[8-9]。近些年来,关于ROCK抑制剂进行了大量的动物试验及临床研究,也证实了ROCK活性与缺血性脑卒中的密切关系[10]。它在保护皮型一氧化氮合酶的活性、修复神经损伤、抑制炎症反应、防治动脉粥样硬化等具有显著的优势[11-15]。Yagita Y等[16]发现抑制内皮细胞ROCK表达,可以阻止卒中后脑梗死体积的扩大,改善神经功能。Satoh S等[17]研究发现,ROCK抑制剂盐酸法舒地尔通过降低血液黏稠度并阻止脑组织内中性粒细胞的聚集,减少梗死体积,促进神经功能恢复。由此可见,抑制ROCK表达对于缺血性脑卒中患者神经功能恢复具有重要意义。本实验主要精选百会、大椎、后三里等穴位对局灶性脑缺血再灌注模型大鼠进行针刺,动态观察模型大鼠ROCK的变化,确定最佳针刺时间点。百会为督脉要穴,又称三阳五会,入络于脑,有通督调神之功。《普济方》:“凡忽中风,言语謇涩,半身不遂……穴百会,耳前发际,……神效。”大椎为诸阳之会,是手足三阳经与督脉交会穴,具有宣通诸阳之气而通督活络之效。《新铸铜人腧穴针灸图经》:“手足三阳、督脉之会。”足三里为足阳明经合穴,以调和经脉、疏通气血,还可健脾胃以运化水湿和水谷精微。三穴合用可奏通督调神、行气活血之功。神经功能缺损评分结果显示,针刺组(6 h、24 h、48 h、72 h)与模型组点对点比较均具有显著差异(P<0.05),说明针刺可以有效改善模型大鼠的神经功能缺损状况,促进其神经功能的恢复。其中,针刺6 h组神经功能缺损评分下调幅度最大,与针刺24 h、48 h、72 h组相比具有显著差异(P<0.05);观察不同时间点针刺对局灶性脑缺血大鼠ROCK的表达的影响,结果显示,假手术组与空白组ROCK表达相比较没有显著差异(P>0.05);模型组(缺血再灌注6 h、24 h、48 h、72 h)与空白组相比较ROCK表达均显著上调(P<0.05),2 w组与空白组相比较,差异无统计学意义(P>0.05)。其中,缺血再灌注 6 h ROCK上调达到峰值。针刺组(6 h、24 h、48 h)ROCK表达与模型组(缺血再灌注 6 h、24 h、48 h)点对点比较具有显著差异(P<0.05)。其中,缺血再灌注 6 h针刺组 ROCK下调最为显著,而针刺组(72 h、2 w组)ROCK表达与模型组(72 h、2 w组)比较,差异均无统计学意义(P>0.05)。由此可见,ROCK表达与脑缺血再灌注损伤有着密切的联系,在大鼠脑缺血再灌注的不同时间点ROCK表达呈现一个动态演变的过程。其中,脑缺血再灌注6 h ROCK上调最为显著,随着时间的推移ROCK表达呈现下降的趋势,直到缺血再灌注2 w与正常空白组趋向一致。而针刺的介入对于脑缺血再灌注大鼠ROCK的调节也呈现一个动态演变的过程,脑缺血再灌注6 h后针刺对ROCK下调最为显著,随后ROCK表达呈现下降的趋势,直到缺血再灌注2 w针刺组与正常空白组趋向一致。而脑缺血再灌注6 h恰为缺血性脑血管病的超级性期,本实验证明针刺对于超级性期缺血性脑血管病大鼠ROCK的下调具有显著意义,可以更大程度保护和改善神经功能,这为临床寻找缺血性脑血管病最佳治疗时间点提供了可靠的实验证据。同时也为脑缺血治疗提供新的靶点。
[1]Pulsinelli WA, Jacewicz M, Levy DE,et al. Ischemic brain injury and the therapeutic window[J]. Ann N Y Acad Sci, 1997,835:187-193.
[2]孙世晓,武桂娟.滞针兼透刺疗法治疗中风肢体痉挛状态临床观察[J].针灸临床杂志,2006,22(6):37-38.
[3]陈文,顾红卫,马维平,等.针刺足三里、悬钟对缺血性中风患者脑血管功能的影响:多中心随机对照研究[J].中国针灸,2006,26(12):851-853.
[4]彭君华,于海波,皮敏,等.调任通督针刺法结合康复训练治疗缺血性中风的临床观察[J].广东医学,2009,29(8):1410-1411.
[5]欧阳钢,贾少微,王凡,等.不同电针刺激频率对脑卒中患者脑血流灌注和脑功能的影响[J].中国针灸,2005,25(11):776-778.
[6]张晨茜,储浩然,程红亮,等.针刺风池、风府穴对缺血性脑卒中患者血浆内皮素的影响[J].上海针灸杂志,2012,31(1):15-17.
[7]Longa EZ, Weinstein PR, Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[8]Etienne-Manneville S, Hall A. Rho GTPases in cell biology[J]. Nature,2002,420(6916):629-635.
[9]Buchsbaum RJ. Rho activation at a glance[J]. J Cell Sci, 2007,120(7):1149-1152.
[10]Marinissen MJ, Chiariello M, Tanos T,et al. The small GTP-binding protein RhoA regulates c-jun by a ROCK-JNK signaling axis[J]. Mol Cell, 2004,14(1):29-41.
[11]Shin HK, Salomone S, Potts EM,et al. Rho-kinase inhibition acutely augments blood flow in focal cerebral ischemia via endothelial mechanisms[J]. J Cereb Blood Flow Metab, 2007,27(5):998-1009.
[12]Wolfrum S, Dendorfer A, Rikitake Y,et al. Inhibition of Rho-kinase leads to rapid activation of phosphatidylinositol 3-kinase/protein kinase Akt and cardiovascular protection[J]. Arterioscler Thromb Vasc Biol, 2004,24(10):1842-1847.
[13]Feske SK, Sorond FA, Henderson GV,et al. Increased leukocyte ROCK activity in patients after acute ischemic stroke[J]. Brain Res,2009,1257:89-93.
[14]Fournier AE, Takizawa BT, Strittmatter SM. Rho kinase inhibition enhances axonal regeneration in the injured CNS[J]. J Neurosci, 2003,23(4):1416-1423.
[15]Lingor P, Tonges L, Pieper N,et al. ROCK inhibition and CNTF interact on intrinsic signaling pathways and differentially regulate survival and regeneration in retinal ganglion cells[J]. Brain, 2008,131(1):250-263.
[16]Yagita Y, Kitagawa K, Sasaki T,et a1. Rho-kinase activation in endothelial cells contributes to expansion of infarction after focal cerebral ischemia[J]. J Neurosci Res, 2007,85(11):2460-2469.
[17]Satoh S, Toshima Y, Hitomi A,et a1. Wide therapeutic time window for Rho kinase inhibition therapy in ischemic brain damage in a rat cerebral thrombosis model[J]. Brain Res, 2008,l193:102-108.

