脊柱结核椎间盘MMPs和TIMPs表达的意义
王 寒,蒋电明
(重庆医科大学附属第一医院骨科 400016)
脊柱结核椎间盘MMPs和TIMPs表达的意义
王 寒,蒋电明△
(重庆医科大学附属第一医院骨科 400016)
目的 探讨基质金属蛋白酶(MMPs)和基质金属蛋白酶抑制剂(TIMPs)在脊柱结核椎间盘中表达的意义。方法 选取该院2011年1月至2014年5月在脊柱外科接受手术治疗的脊柱结核患者42例作为脊柱结核组(TB组);选取同期因椎间盘突出接受手术治疗的40例患者作为椎间盘突出组(ID组);另选同期因外伤性脊柱骨折接受手术治疗的患者34例作为对照组;应用ELISA和免疫组织化学检测受试者椎间盘中MMP-1、MMP-13、TIMP-1及TIMP-3的表达水平。结果 TB组中MMP-1、MMP-13和TIMP-3的表达水平,MMP-1/TIMP-1和MMP-13/TIMP-3比值均高于其他两组,TIMP-1表达水平低于另两组,差异均有统计学意义(P<0.05)。结论 MMPs和TIMPs在脊柱结核椎间盘破坏的发病机制中发挥了重要的作用。
椎间盘;基质金属蛋白酶类;基质金属蛋白酶抑制剂;脊柱结核
WHO报道2010年全球新发结核病患者约880万[1]。其中,1%~5%的人会发生脊柱结核[2]。脊柱结核占骨结核的50%~60%,可致骨破坏、脊柱畸形、脊髓神经压迫损伤、甚至截瘫等,致残率较高[3]。结核分枝杆菌可以诱导巨噬细胞分泌基质金属蛋白酶(MMPs),对结核患者的局部组织造成损伤,在脊柱结核的发病机制中发挥重要作用。MMPs为细胞外基质(ECM)降解的重要细胞因子,MMPs在人体蛋白激酶活化作用下,具有降解细胞基底膜、分解ECM、减低细胞内黏附力等作用,基质金属蛋白酶抑制剂(TIMPs)则为MMPs的特异性拮抗剂。本研究采用ELISA技术和免疫组化技术,检测MMP-1,MMP-13,TIMP-1和TIMP-3在结核性椎间盘组织、退行性椎间盘组织和正常椎间盘组织内的表达情况及差异性,旨在为阐明脊柱结核患者椎间盘损害的发生机制,为脊柱结核治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取本院2011年1月至2014年5月在脊柱外科接受手术治疗的脊柱结核患者42例作为脊柱结核组(TB组),其中男24例,女18例,年龄21~72岁,平均(41.4±16.9)岁。纳入标准:具有中度发热、肢体乏力、腰痛和下肢肌力减退等脊柱结核的典型症状;患者血液检查,结核菌素皮肤试验,组织病理学检查和影像学检查,如X线摄影,计算机断层扫描(CT)和磁共振成像(MRI)均支持脊柱结核疾病诊断;排除获得性免疫缺陷综合征(AIDS),肿瘤和强直性脊柱炎的患者。选取同期因椎间盘突出接受手术治疗的40例患者作为椎间盘突出组(ID 组),其中男27例,女13例,年龄24~75岁,平均(42.3±17.2)岁。椎间盘突出组患者临床症状以及影像学检查均符合椎间盘突出症诊断标准。另选同期因外伤性脊柱骨折接受手术治疗的患者34例作为对照组,其中男19例,女15例,年龄19~68岁,平均(39.4±16.6)岁。患者手术前明确为外伤所致的脊柱骨折,手术前影像学检查未有椎间盘退行性改变。排除脊柱相关性疾病,如脊柱结核、椎间盘突出、强直性脊柱炎的患者。本研究经伦理委员会批准,所获得的标本均履行告知义务并签署知情同意书,符合国务院颁布的《医疗机构管理条例》的相关要求。
1.2 检测仪器与试剂 MK3型酶标仪购自美国Thermo公司,采用ELISA免疫法测定MMP-1、MMP-13、TIMP-1及TIMP-3水平,试剂盒由上海生物科技有限公司提供,操作步骤严格按照说明书进行。MMP-1和TIMP-1鼠抗人单克隆抗体购自福州迈新公司,MMP-13和TIMP-3兔抗人单克隆抗体购自美国San Cruz公司,两步法SP抗兔/鼠通用型免疫组化试剂盒及DAB显色试剂盒均购自武汉博士德生物技术有限公司。
1.3 方法 外科手术获得标本后,经两名经验丰富的病理学家检查,以确保样本的准确性。每位患者标本均分成两份,第1份制成石蜡切片行HE染色、免疫组化法;第2份进行ELISA检测。取部分组织以10%甲醛固定48 h,以石蜡包埋切片,部分组织迅速移至-80 ℃冰箱冻存备用,供ELISA检测。使用酶标仪测定标准品和标本的光密度值。试验前先将椎间盘组织称质量,超声波粉碎,加入PBS研磨制成匀浆,3 500 r/min离心10 min,取上清液。采用ELISA法测定两组椎间盘组织中的MMP-1、MMP-13、TIMP-1及TIMP-3。按说明书进行操作。所有髓核组织标本用10%甲醛常规固定,石蜡包埋,4 μm切片,一片作常规HE染色,其余采用SP免疫组化方法检测MMP-1、MMP-13、TIMP-1及TIMP-3的表达。所有免疫组化切片应用Image-ProPlus 5.1图像分析系统对所拍照片进行分析,每张切片随机取5个视野计算出平均值,作为这张切片的平均灰度值,以灰度值反映阳性表达率。
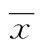
2 结 果
2.1 ELISA检测MMP-1、MMP-13、TIMP-1和TIMP-3在不同组髓核中的表达 MMP-1、MMP-13、TIMP-1和TIMP-3在不同组椎间盘中均能检测。TB组中MMP-1、MMP-13水平和TIMP-3水平,MMP-1/TIMP-1和MMP-13/TIMP-3比值均高于其他两组,TIMP-1水平低于另两组,差异均有统计学意义(P<0.05),见表1、2。
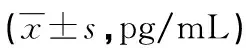
表1 不同组髓核中MMP-1、TIMP-1和MMP-1/TIMP-1的比较
a:P<0.05,与对照组比较;b:P<0.05,与ID组比较。
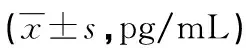
表2 不同组髓核中MMP-13、TIMP-3和MMP-13/TIMP-3的比较
a:P<0.05,与对照组比较;b:P<0.05,与ID组比较。
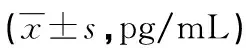
表3 不同组髓核中MMP-1、TIMP-1和MMP-1/TIMP-1的比较
a:P<0.05,与对照组比较;b:P<0.05,与ID组比较。
2.2 免疫组化检测MMP-1、MMP-13、TIMP-1和TIMP-3在不同组髓核中的表达 MMP-1、MMP-13、TIMP-1和TIMP-3阳性表达均分布于细胞质,呈黄色或棕黄色颗粒。对照组椎间盘组织中MMP-1和MMP-13的表达较少,TB组中MMP-1、MMP-13和TIMP-3表达,MMP-1/TIMP-1和MMP-13/TIMP-3比值均高于其他两组,TIMP-1表达低于另两组,差异均有统计学意义(P<0.05),见表3、4。
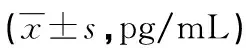
表4 不同组髓核中MMP-13、TIMP-3和MMP-13/TIMP-3的比较
a:P<0.05,与对照组比较;b:P<0.05,与ID组比较。
3 讨 论
椎间盘破坏是脊柱结核的一个特征性改变。蛋白多糖是稳定椎间盘结构的重要成分,核心蛋白又是人体蛋白多糖的主要功能区。MMPs是核心蛋白的重要降解酶[4-5],其高水平表达有利于结核分枝杆菌的组织播散[6]。TIMPs是MMPs的特异性抑制物,MMPs与TIMPs两者之间的平衡状态,直接影响了体内细胞基质的降解情况。
MMP-1主要降解Ⅰ、Ⅱ,Ⅲ和Ⅹ型原纤维胶原。TIMP-1对所有胶原酶的活性均有抑制作用[7]。研究发现,结核分枝杆菌对MMP-1表达具有特异性上调的作用[8-9]。而新近研究表明,多脏器受累的结节病患者的MMP-1基因表达显著增加,空洞性肺结核病患者的MMP-1基因表达也呈现明显增加趋势[10]。梁莉等[11]发现MMP-1高表达是支气管结核狭窄的危险因素,参与了支气管结核的发病。本研究显示3组髓核均有MMP-1及TIMP-1表达,TB组中有高表达的MMP-1,而TIMP-1增加甚少,MMP-1/TIMP-1失调,TIMP-1不能抑制MMP-1对细胞外基质的过度降解,导致Ⅱ型胶原过度降解,细胞外基质中胶原纤维的结构破坏,髓核空洞形成、纤维化,甚至椎间盘破坏、塌陷,对脊髓容易形成压迫,发生瘫痪等严重并发症。
MMP-13又称胶原酶-3,具有极强的Ⅱ型胶原降解能力。MMP-13的高表达有利于结核破坏部位的细胞外基质降解,与结核扩散转移及其预后密切相关。动物研究发现椎间盘在负荷状态下发生退变,其组织中MMP-13表达也显著增强[12-13]。国内外研究还发现,MMP-13显著表达可以有效降解椎间盘髓核的Ⅱ型胶原,从而导致椎间盘髓核细胞外基质的过度降解。Gonzlez-Avila等[14]证实结核分枝杆菌通过增加人肺成纤维细胞中MMP-1和MMP-13的表达,参与了多种胶原蛋白的合成和降解。本研究发现,TB组的MMP-13表达显著增高,明显高于ID组和对照组,而TIMP-3虽有增加,MMP-3 /TIMP-3比值进一步扩大,TIMP-3不能调控MMP-3对Ⅱ型胶原的过度降解,可见MMP-13同样参与了椎间盘的结核性破坏过程,而且比在椎间盘退行性过程中表达更加强烈,作用更加明显。
MMPs和TIMPs在脊柱结核椎间盘的破坏性过程中发挥了重要的作用,但是脊柱结核的发病机制是一个十分复杂的过程,而MMPs和TIMPs参与脊柱结核椎间盘破坏的发病机制中的具体作用环节还不明了,需要进一步深入研究。
[1]Ramsay A,Steingart KR,Cunningham J,et al.Translating tuberculosis research into global policies:the example of an international collaboration on diagnostics[J].Int J Tuberc Lung Dis,2011,15(10):1283-1293.
[2]Schirmer P,Renault CA,Holodniy M.Is spinal tuberculosis contagious?[J].Int J Infect Dis,2010,14(8):e659-666.
[3]Jin D,Qu D,Chen J,et al.One-stage anterior interbody autografting and instrumentation in primary surgical management of thoracolumbar spinal tuberculosis[J].Eur Spine J,2004,13(2):114-121.
[4]Merdad A,Karim S,Schulten HJ,et al.Expression of matrix metalloproteinases (MMPs) in primary human breast cancer:MMP-9 as a potential biomarker for cancer invasion and metastasis[J].Anticancer Res,2014,34(3):1355-1366.
[5]Bauters D,Van Hul M,Lijnen HR.Gelatinase B (MMP-9) gene silencing does not affect murine preadipocyte differentiation[J].Adipocyte,2014,3(1):50-53.
[6]Ciurea ME,Cernea D,Georgescu CC,et al.Expression of CXCR4,MMP-13 and β-catenin in different histological subtypes of facial basal cell carcinoma[J].Rom J Morphol Embryol,2013,54(4):939-951.
[7]Erwin WM,Islam D,Inman RD,et al.Notochordal cells protect nucleus pulposus cells from degradation and apoptosis:implications for the mechanisms of intervertebral disc degeneration[J].Arthritis Res Ther,2011,13(6):R215.
[8]Iizuka S,Ishimaru N,Kudo Y.Matrix metalloproteinases:the gene expression signatures of head and neck cancer progression[J].Cancers (Basel),2014,6(1):396-415.
[9]Said AH,Raufman JP,Xie G.The role of matrix metalloproteinases in colorectal cancer[J].Cancers (Basel),2014,6(1):366-375.
[10]Huang CD,Lin SM,Chang PJ,et al.Matrix metalloproteinase-1 polymorphism is associated with persistent airway obstruction in asthma in the Taiwanese population[J].J Asthma,2009,46(1):41-46.
[11]梁莉,乐军,刘丽蓉,等.MMP-1基因1 G/2 G多态性在支气管结核狭窄中的作用[J].中华医院感染学杂志,2012,22(11):2261-2264.
[12]Omlor GW,Lorenz H,Engelleiter K,et al.Changes in gene expression and protein distribution at different stages of mechanically induced disc degeneration-an in vivo study on the New Zealand white rabbit[J].J Orthop Res,2006,24(3):385-392.
[13]MacLean JJ,Roughley PJ,Monsey RD,et al.In vivo intervertebral disc remodeling:kinetics of mRNA expression in response to a single loading event[J].J Orthop Res,2008,26(5):579-588.
[14]González-Avila G,Sandoval C,Herrera MT,et al.Mycobacterium tuberculosis effects on fibroblast collagen metabolism[J].Respiration,2009,77(2):195-202.
Expression and significance of MMPs and TIMPs in intervertebral disc of spinal tuberculosis
WangHan,JiangDianming△
(DepartmentofOrthopedic,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Objective To investigate the expression and significance of matrix metalloproteinases (MMPs) and tissue inhibitors of matrix metalloproteinase (TIMPs) in intervertebral disc of spinal tuberculosis.Methods Forty two cases of spinal tuberculosis underwent surgical treatment in our hospital from January 2011 to May 2014 were collected as tuberculosis group (TB group);forty patients who underwent surgery for lumbar disc herniation were selected as lumbar disc herniation (ID group);and other 34 cases of fracture patients underwent surgery due to trauma spine were collected as the control group;enzyme linked immunosorbent assay and immunohistochemical detection were used to detect the expression level of MMP-1,MMP-13,TIMP-1 and TIMP-3 of the subjects in intervertebral disc.Results The expression levels of MMP-1,MMP-13 and TIMP-3,MMP-1/TIMP-1 and MMP-13/TIMP-3 ratio in TB group were higher than those of the other two groups,the expression level of TIMP-1 was lower than that of the other two groups,the differences were statistically significant (P<0.05).Conclusion MMPs and TIMPs play important role in the pathogenesis of the intervertebral disc damage in spinal tuberculosis.
intervertebral disk;matrix metalloproteinases;tissue inhibitors of metalloproteinases;spinal tuberculosis
王寒(1988-),在读硕士,主要从事骨科脊柱的研究。△
,Tel:(023)62385326;E-mail:1940594497@qq.com。
·临床研究
10.3969/j.issn.1671-8348.2015.21.016
R681.5
A
1671-8348(2015)21-2926-02
2015-01-19
2015-03-25)

