重度子痫前期患者外周血CD4+CD25+Foxp3+调节性T淋巴细胞改变与发病孕周的关系*
张莉英,张 檀,覃世榕
(宁波市妇女儿童医院妇产科,浙江宁波 315120)
重度子痫前期患者外周血CD4+CD25+Foxp3+调节性T淋巴细胞改变与发病孕周的关系*
张莉英,张 檀△,覃世榕
(宁波市妇女儿童医院妇产科,浙江宁波 315120)
目的 探讨子痫前期患者外周血CD4+CD25+Foxp3+调节性 T淋巴细胞(Treg)的比例改变与发病孕周之间的关系。方法 2010年1月至2011年12月对宁波市妇女儿童医院早发型重度子痫前期患者20例、晚发型重度子痫前期患者20例、28~34周的正常妊娠组20例及34周以后的正常妊娠20例,采用流式细胞仪检测其外周血 CD4+CD25+Foxp3+Treg的比率,分析其与子痫前期发病及发病孕周之间的关系。结果 早发型和晚发型子痫前期患者妇女外周血CD4+CD25+Foxp3+Treg比例分别为(2.80±0.54)%、(3.23±0.44)%,分别低于28~34、>34周正常妊娠组妇女外周血 CD4+CD25+Foxp3+Treg比例 (3.48±0.31)%、(3.58±0.41)%,差异有统计学意义(P<0.05)。且早发型子痫前期患者妇女外周血CD4+CD25+Foxp3+Treg比例低于晚发型子痫前期患者,差异有统计学意义(P<0.01)。28~34、>34周正常妊娠组妇女外周血 CD4+CD25+Foxp3+Treg比例比较,差异无统计学意义(P>0.05)。结论 CD4+CD25+Foxp3+Treg的减少可能参与子痫前期的发病,下降程度可能与子痫前期发病孕周密切相关。
先兆子痫;流式细胞术;CD4+CD25+Foxp3+调节性T淋巴细胞
子痫前期严重威胁母婴安全,尤其是早发型子痫前期,已成为妊娠妇女和围产儿死亡的主要原因之一。尽管其病因和发病机制尚不清楚,但研究显示子痫前期患者存在母胎免疫耐受不良依据[1-3]。CD4+CD25+调节性 T淋巴细胞(regulatory T cells,Treg)是近年来新发现的机体维持外周免疫耐受自然机制的决定因素,Foxp3是控制CD4+CD25+Treg发育及其功能效应的关键基因。有研究认为CD4+CD25+Treg可能是调控母胎界面局部免疫耐受形成的一个重要因素[4-6]。本研究分别对早发型子痫前期患者、晚发型子痫前期患者以及与他们孕周相对应的正常妊娠妇女外周血中CD4+CD25+Foxp3+Treg的比例进行了分析研究,旨在探讨Treg与重度子痫前期发病及发病孕周的关系。
1 资料与方法
1.1 一般资料 早发型子痫前期组:选择2010年1月至2012年12月宁波市妇女儿童医院住院的34周或34周前诊断为重度子痫前期患者共20例作为研究对象,年龄22~34岁,中位数年龄28岁,孕周28~34周,中位数孕周32周。晚发型子痫前期组:选择同期住院的34周后诊断为重度子痫前期患者共20例,年龄24~39岁,中位数年龄30岁,孕周34+~41周,中位数孕周37周。28~34周正常妊娠组:选择同期门诊妊娠28~34周正常妊娠妇女,本次妊娠期间无异常。共20例,年龄25~32岁,中位数年龄29岁,中位数孕周33周。>34周正常妊娠组:同期门诊和住院的大于34周的妊娠妇女共 20例,年龄24~33岁,中位数年龄27岁,孕周34+~41周,中位数孕周37周。上述4组妇女的年龄、孕次、产次比较差异无统计学意义(P>0.05)。4组妇女既往均无高血压、糖尿病、肾炎、感染、系统性红斑狼疮等疾病。子痫前期诊断标准参照乐杰主编《 妇产科学》 教材第 7版诊断标准。
1.2 方法
1.2.1 主要试剂 异硫氰酸酯(FITC) 荧光标记鼠抗人抗体CD4、藻红蛋白(PE) 标记的鼠抗人抗体CD25、藻红蛋白-青色素染料5(PE-Cy5) 标记的抗人抗体Foxp3、细胞固定剂和透膜剂等均购自美国eBioscience公司;淋巴细胞分离液购自联科生物公司。FACScalibur流式细胞仪购自美国Becton-Dickinson公司。
1.2.2 标本的采集 采集所有孕妇静脉血3 mL,肝素钠抗凝,所有标本在采集后4 h内测定。用淋巴细胞分离液分离外周血单个核细胞,用PBS调整单个核细胞浓度为1×107个/mL。1.2.3 细胞染色和流式细胞术分析 取3支试管,分别加入上述细胞悬液100 μL,第2、3管各加入抗人CD4-FITC抗体 20 μL和抗人CD25-PE抗体20 μL,第1管加入相对应的同型对照20 μL,混匀后避光孵育30 min,用预冷的流式细胞缓冲液洗1次,每管各加入1 mL新鲜准备的固定液重悬混匀,4 ℃避光孵育30 min,2 000×g离心5 min后弃上清液,用预冷的流式细胞缓冲液洗细胞1次,用1 mL透膜剂重悬细胞,4 ℃避光孵育30 min,2 000×g离心5 min后弃上清液,用预冷的流式细胞缓冲液洗细胞1次,再于第3管加入抗人Foxp3-PE-Cy5抗体20 μL,第2管加入相对应的同型对照20 μL,4 ℃避光孵育30 min,2 000×g离心5 min后弃上清液,将细胞重悬于500 μL流式细胞缓冲液中,立即上机检测。
2 结 果
早发型子痫前期患者外周血CD4+CD25+Foxp3+Treg表达率低于28~34周正常妊娠组,差异有统计学意义(P<0.01)。晚发型子痫前期患者外周血CD4+CD25+Foxp3+Treg与大于34周正常妊娠组妇女比较低,差异有统计学意义(P<0.05)。早发型子痫前期患者外周血CD4+CD25+Foxp3+Treg低于晚发型子痫前期患者,差异有统计学意义(P<0.01)。28~34周与大于34周正常妊娠组妇女外周血 CD4+CD25+Foxp3+Treg比较,差异无统计学意义(P>0.05)。4组孕妇外周血CD4+CD25+Foxp3+Treg表达率比较,见表1。
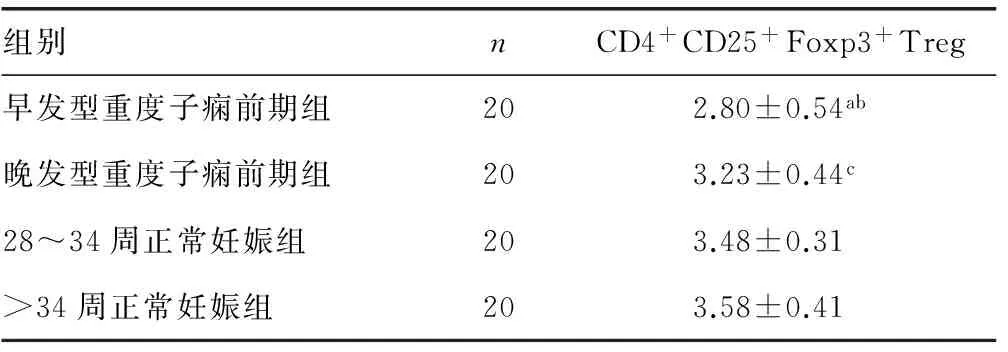
表1 4组孕妇外周血CD4+CD25+Foxp3+Treg表达率(%)
a:P<0.01,与晚发型子痫前期比较;b:P<0.01,与28~34周正常妊娠组比较;c:P<0.05,与大于34周正常妊娠组比较。
3 讨 论
尽管子前期的发病机制尚不清楚,但研究显示子痫前期患者普遍发生免疫异常:子痫前期患者体内抗血管内皮细胞抗体、免疫复合物和补体增加,Th1/Th2比值向诱导免疫排斥的Th1偏移,炎症细胞及炎症因子增加,提示子痫前期是一种母胎免疫耐受不良性疾病[1-3]。
妊娠中胎儿作为一种同种半异体抗原能够在母体内生存、发育和生长而不被排斥,是由于母体免疫耐受机制能确保阻止母体对胎儿的免疫攻击。母胎免疫耐受的诱导和维持涉及诸多因素,诸如,辅助性T淋巴细胞Th1/Th2平衡、CD95及其配体的相互作用、胎盘人类白细胞(HLA)的表达等。近年来许多研究表明,机体可能更主要的是通过Treg抑制自身反应性T淋巴细胞来诱导母胎免疫耐受而维持妊娠[4-6]。人体研究显示:正常妊娠妇女循环系统及蜕膜中均含CD4+CD25+Treg,早期增高,妊娠中期达高峰,产后降低[7-8]。原因不明复发性流产患者外周血和脱膜中CD4+CD25+T细胞显著低于正常早孕妇女[9],且CD4+CD25+T对CD4+CD25-T增殖抑制能力降低[10]。
Treg是机体维持外周免疫耐受自然机制的决定因素。Treg和炎症细胞之间的平衡将决定免疫应答是否发生、免疫耐受是否形成。Treg包括两大类,第1类是胸腺来源的天然 Treg,即CD4+CD25+T细胞,它在健康人中占CD4+T细胞的1%~10%;第2类是外周诱导的获得性Treg,包括Th3细胞、Tr1细胞等。Treg主要表型标记包括CD25、细胞毒T淋巴细胞相关抗原4(CTLA4),糖皮质激素诱导的肿瘤坏死因子相关蛋白(GITR),Foxp3。其中Foxp3的mRNA及其编码蛋白仅特异性表达于 CD4+CD25+Treg,其他CD4+T细胞亚群均极少表达Foxp3及其编码分子[11],因此,Foxp3是最适宜的 Treg鉴定标记。Foxp3还是控制 Treg发育及其功能效应的关键[12]。
目前已有数个子痫前期外周血Treg的研究,但缺乏关于早发型子痫前期外周血Treg 方面的分层研究。Sasaki等[13]发现子痫前期患者CD4+CD25+Treg减少,并且证明CD4+CD25brigtTreg主要是Foxp3+细胞。曹霞等[14]研究发现各种病情的子痫前期患者的外周血CD4+CD25+Foxp3+Treg和CD4+CD25+Foxp3+Treg表达水平均明显低于正常妊娠晚期组。同时,不同病情子痫前期患者之间,这两项调节性T细胞表达水平也有显著区别,轻度子痫前期患者的外周血CD4+CD25+Foxp3+Treg和CD4+CD25+Foxp3+Treg水平均低于重度子痫前期。但Prins等[15]研究发现子痫前期患者CD4+CD25+Foxp3+Treg比例与正常妊娠妇女类似,CD4+CD25high Foxp3+Treg比例也不存在显著下降,但早产子痫前期患者(孕周小于37周)CD4+Treg比例显著低于相对应孕周正常妊娠妇女,他们认为CD4+Treg更能反应Treg的状态。
也有研究提示子痫前期与外周血CD4+CD25+Treg变化并无相关性[16]。但由于表面标志CD25、CTLA4、GITR也动态表达于激活的CD4+Th细胞,因此,仅仅依靠这些表型很难区别新近激活的CD4+Th细胞和Treg,尤其是妊娠时候,CD4+细胞存在对表达在胎儿细胞的父方抗原发生的正常激活反应。
有鉴于此,在本研究中,选择Foxp3作为Treg特异标志,分别以早发型子痫前期患者、晚发型子痫前期患者作为研究对象,并以孕周相对应的正常孕妇作为对照,采用流式细胞仪检测外周血单个核细CD4+CD25+Foxp3+Treg细胞的比率,发现早发型和晚发型子痫前期患者外周血CD4+CD25+Foxp3+Treg比例均低于其对应孕周正常妊娠组妇女外周血 CD4+CD25+Foxp3+Treg比例,差异有统计学意义(P<0.05)。且相对于晚发型子痫前期患者,早发型子痫前期患者外周血CD4+CD25+Foxp3+Treg比例进一步减少,而与早发型和晚发型子痫前期孕周分别对应的正常妊娠妇女外周血CD4+CD25+Foxp3+Treg比例比较差异无统计学意义。提示CD4+CD25+Foxp3+Treg减少参与了子痫前期的发病,而且其下降程度与发病孕龄密切相关。外周血CD4+CD25+Foxp3+Treg的减少可能使子痫前期患者免疫耐受调控机制受损,使得针对胎儿父方抗原成分的效应细胞及分子增加,打破了机体免疫反应与免疫耐受之间的平衡,从而引起母体免疫损伤,导致了子痫前期的发生。
子痫前期中,又以孕34周前发病的早发型子痫前期危害严重。目前终止妊娠仍是子痫前期治疗的主要手段,由于早发型子痫前期孕龄小、胎儿不成熟,极低体重儿和超低体重儿的死亡率高,常常使得临床处理很难兼顾母婴安全。因此,探讨Treg与子痫前期发现孕周的关系尤为重要。基于本次研究的结论,CD4+CD25+Foxp3+Treg有望成为早发型子痢前期患者的实验室诊断的新指标及免疫治疗的新思路,如静脉输注免疫球蛋白、抗TNF的阻断剂等[4]。为了进一步明确Treg在子痫前期发病机制中的作用,应该进一步研究子痫前期发病前是否存在Treg的下降。
[1]Darmochwal-Kolarz D,Saito S,Rolinski J,et al.Activated T lymphocytes in pre-eclampsia[J].J Reprod Immunol,2007,58(1):39-45.
[2]Schiessl B.Inflammatory response in preeclampsia[J].Mol Aspects Med,2007,28(2):210-219.
[3]Saito S,Shiozaki A,Nakashima A.The role of the immune system in preeclampsia[J].Mol Aspects Med,2007,28(2):192-209.
[4]Zenclussen AC.Regulatory T cells in pregnancy[J].Springer Semin Immunopathol,2006,28(1):31-39.
[5]Leber A1,Teles A,Zenclussen AC.Regulatory T cells and their role in pregnancy[J].Am J Reprod Immunol,2010,63(6):445-459.
[6]Alijotas-Reig J.Potentiating maternal immune tolerance in pregnancy:A new challenging role for regulatory T cells[J].Placenta,2014,35(4):241-248.
[7]王轶英.正常妊娠孕妇外周血中CD4+CD25+T细胞比例的变化[J].河南大学学报:医学版,2008,27(3):20-21.
[8]Somerset DA,Zheng Y,Kilby MD,et al.Normal human pregnancy is associated with an elevation in the immune suppressive CD25+CD4+regulatory T-cell subset[J].Immunology,2004,112(1):38-43.
[9]邱丽华,林其德,沈仲毅,等.调节性T淋巴细胞与原因不明复发性流产的相关性研究[J].中华妇产科杂志,2004,39(12):816-818.
[10]刘雨生,赵淑云,季静娟,等.原因不明复发性流产患者调节性T淋巴细胞比例及功能的测定[J].中华妇产科杂志,2007,42(3):176-179.
[11]Fehervari Z,Sakaguchi S.Control of Foxp3+CD25+CD4+regulatory cell activation and function by dendritic cells[J].Int Immunol,2004,16(12):1769-1780.
[12]Hori S,Nomura T,Sakaguchi S.Control of Regulatory T Cell Development by the Transcription Factor Foxp3[J].Science,2003,299(5609):1057-1061.
[13]Sasaki Y,Darmochwal-Kolarz D,Suzuki D,et al.Proportion of peripheral blood and decidual CD4+CD25(bright) regulatory T cells in pre-eclampsia[J].Clin Exp Immunol,2007,149(1):139-145.
[14]曹霞,王莲莲,梁杰.子痫前期孕妇外周血调节性 T细胞差异表达的临床意义[J].东南大学学报:医学版,2010,29(6):621-622.
[15]Prins JR,Boelens HM,Heimweg J,et al.Preeclampsia is Associated with Lower Percentages of Regulatory T Cells in Maternal Blood[J].Hypertens Pregnancy,2009,28(3):300-311.
[16]Paeschke S,Chen F,Horn N,et al.Pre-eclampsia is not associated with changes in the levels of regulatory T cells in peripheral blood[J].Am J Reprod Immunol,2005,54(6):384-389.
验交流·
10.3969/j.issn.1671-8348.2015.21.029
浙江省医药卫生科学研究基金资助项目(2008A147)。 作者简介:张莉英(1969-),硕士,主任医师,主要从事妇产科方面的研究。△
,E-mail:zly2028@126.com。
R71
B
1671-8348(2015)21-2965-03
2015-02-11
2015-04-04)

