生长抑制因子5抑制肺癌细胞增殖作用的研究
张旭涛++孟瑾++张峰
[摘要] 目的 探讨生长抑制因子5(ING5)抑制肺癌细胞增殖的作用。 方法 采用慢病毒介导的基因转染方法建立A549细胞ING5高表达细胞系A549-ING5-OE和A549细胞空质粒对照细胞系A549-control。采用细胞增殖实验和克隆形成实验观察ING5过表达对肺癌A549细胞增殖能力的影响;采用皮下接种方法建立裸鼠皮下移植瘤模型,观察ING5对裸鼠皮下成瘤能力及肿瘤体积大小的影响。 结果 本实验成功构建了肺癌A549-ING5过表达细胞系,与A549-control比较,细胞系A549-ING5-OE中ING5表达显著增高;增殖实验结果显示ING5高表达显著抑制了肺癌细胞的增殖能力;克隆形成实验结果显示细胞系A549-ING5-OE中ING5高表达的肺癌细胞克隆形成能力明显低于A549-control肺癌细胞(P < 0.01);裸鼠在体水平研究结果显示ING5高表达可以抑制裸鼠皮下成瘤及移植瘤的生长。 结论 ING5可以抑制肺癌细胞的增殖,为临床治疗肺癌提供新的治疗靶点。
[关键词] 肺癌细胞;生长抑制因子5;增殖;克隆形成;裸鼠成瘤
[中图分类号] R734 [文献标识码] A [文章编号] 1673-7210(2015)02(a)-0004-04
肺癌的发生是个涉及多基因改变的复杂过程,其中癌基因的激活和抑癌基因的失活是两大关键要素。生长抑制因子(inhibitor of growth,ING)作为候选抑癌基因家族在肿瘤发生、发展中起重要抑制作用[1],目前已发现5个成员,包括ING1、ING2、ING3、ING4、ING5[2]。ING编码的蛋白在结构上具有相似性,功能上存在共同的作用,ING蛋白参与磷脂酰肌醇介导的脂类信号通路及激素介导的通路,抑制细胞生长,诱导细胞凋亡和DNA损伤修复[3-7],同时ING蛋白也具有各自的特点[8-13]。在多种肿瘤中ING家族基因的表达均下调[7],已有的研究表明,在肝癌的发生、发展中ING1、ING2、ING4均起到重要作用[14-15]。ING5作为家族的最新成员于2003年被首次报道。2006年Cote课题组[16]研究揭示ING5参与构成两种组蛋白乙酰基转移酶(HAT)复合体,并且能与组蛋白结合而作为连接HAT与组蛋白的桥梁分子参与组蛋白修饰和染色质重构,表明ING5可通过辅助HAT表观调控基因表达而发挥抑癌作用。ING5与临床肿瘤发生的关系研究表明,61%的原发口腔肿瘤组织中ING5 mRNA水平降低,31例中有3例检测到ING5基因发生突变;在肝癌组织中ING5 mRNA表达量下降,起到抑癌基因的作用[17];在食管鳞癌组织中ING5 mRNA的表达量同样下降[18]。进一步研究表明ING5可与P53相互作用,并促进P53转录活化,而引起结肠癌细胞周期阻滞和凋亡[19]。但ING5在肺癌中的作用尚未见报道,本实验拟建立ING5高表达肺癌细胞株,采用细胞增殖、克隆形成及裸鼠皮下荷瘤模型探讨ING5对肺癌细胞的抑制作用。
1 材料与方法
1.1 材料
A549细胞(中科院上海细胞库),GV218载体购自上海吉凯基因化学技术有限公司,蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒、细胞裂解液均购自西安碧云天科技生物有限公司,蛋白酶抑制剂购自瑞士Roche,G418购自美国Gibco,细胞培养液DMEM高糖、胎牛血清、胰蛋白酶消化液均购自美国HyClone,青链霉素混合液购自北京Solarbio,ING5抗体购自美国Proteintech,ECL化学发光试剂盒购自美国Advansta,兔二抗购自英国Abcam,电子游标卡尺购自哈尔滨量具刃具有限责任公司,4%多聚甲醛购自西安科昊生物技术有限公司,裸鼠由第四军医大学(以下简称“我校”)实验动物中心提供。
1.2 GV218慢病毒载体转染构建A549-ING5-OE和A549-control细胞系
含ING5 cDNA的慢病毒载体和对照载体为吉凯公司构建。用胰蛋白酶消化液消化293T细胞,计数,调整细胞密度为6×105个/mL,接种于细胞培养皿,待细胞密度达80%时进行转染。转染前2 h将培养液换成无血清培养液,将转染复合物加入293T细胞培养液中,培养8 h后弃掉含有转染复合物的培养液,用PBS清洗细胞,加入10%胎牛血清的DMEM高糖培养液培养。48 h后收集293T细胞上清液,1000 r/min离心除去细胞碎片,收集上清即为病毒颗粒浓缩液。对数生长期A549细胞,培养液中加入病毒颗粒浓缩液进行感染,12 h后观察细胞状态,没有明显的细胞毒副作用,继续培养24 h后更换新的培养液,感染3 d后观察GFP基因的的表达。感染后A549细胞计数,调整密度为300个/孔,接种至6孔板,用G418筛选,药物浓度为5 μg/mL,每隔24 h更换新的培养液,筛选3 d后,用荧光显微镜观察细胞克隆,挑取阳性克隆扩大培养,直至获得需要的细胞量。
1.3 Western blot检测ING5在A549-control和A549-ING5-OE细胞中的表达
收集对数生长期A549-control和A549-ING5-OE细胞在冰上裂解30 min,细胞裂解液为150 mmol/L NaCl、1%NP-40、0.5% 去氧胆酸、0.1%SDS、50 mmol/L Tris(pH 8.0),蛋白酶抑制剂(1∶25),裂解后高速离心20 min,收集上清即为细胞总蛋白,蛋白定量试剂盒定量。SDS-PAGE凝胶配制试剂盒配制10%的凝胶。电泳,样品在浓缩胶电压100 V,20 min,在分离胶电压120 V继续电泳。转膜,电压55 V,210 min,转膜结束后用丽春红染液染色,PBST脱色。牛奶封闭1 h,一抗ING5(1∶1000)封闭4℃过夜。PBST洗3次,每次5 min,二抗封闭1 h,PBST洗3次,每次5 min。用增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Amersham Bioscience)检测蛋白的表达。
1.4 检测ING5对肺癌细胞增殖的抑制
将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整细胞密度为1×104个/孔,接种至24孔板,两种细胞各种4个复孔,每孔加1 mL 10%胎牛血清DMEM培养液。从细胞贴壁开始计时24、48、72、96 h后各计数1次。
1.5 检测ING5对肺癌细胞克隆形成能力的抑制
将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整细胞密度为300个/孔,接种至6孔板,每孔加2 mL 10%胎牛血清DMEM培养液。细胞接种5 d后每孔各加500 μL胎牛血清继续培养。贴壁生长15 d后,PBS洗3次,4%多聚甲醛固定15 min。固定后用0.1%结晶紫溶液染色15 min,PBS轻轻冲洗细胞,室温风干后计数多于50个细胞的克隆。根据公式计算克隆形成率:克隆形成率(%)=克隆数/300×100%。
1.6 ING5抑制裸鼠皮下成瘤实验
出生4周雄性裸鼠,对照组和实验组各7只随机分组,由第四军医大学(以下简称“我校”)实验动物中心代养。裸鼠适应7 d后,将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整密度为每只裸鼠5×106个/200 μL,混匀在无血清DMEM培养液,分别接种至对照组和实验组裸鼠皮下。7 d后裸鼠皮下成瘤,每隔3 d用电子游标卡尺测1次移植瘤长径(a)和短径(b),并计算肿瘤体积(V):ab2/2,绘制肿瘤生长曲线。裸鼠实验遵循我校关于动物保护和做好动物福利规定,并经我校实验动物伦理委员会批准。
1.7 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 Western blot检测ING5蛋白表达
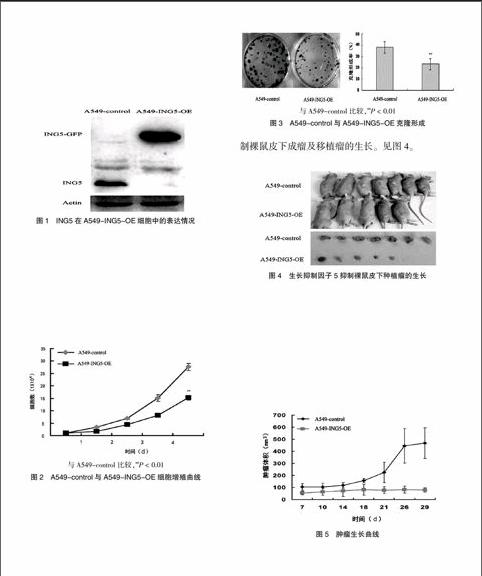
为了检测ING5是否在所转染细胞中高表达,将A549-control和ING5高表达细胞对数生长期时用细胞裂解液提取总蛋白,Western blot结果显示与A549-control相比,ING5在A549-ING5-OE细胞中表达量显著增高。见图1。
图1 ING5在A549-ING5-OE细胞中的表达情况
2.2 ING5抑制肺癌细胞增殖
显微镜下观察可见A549-control和A549-ING5-OE细胞生长良好,紧密排列,形态为梭形,细胞之间形成连接。A549-ING5-OE细胞的增殖速度明显低于A549-control细胞,增殖速度为A549-control的一半,差异有高度统计学意义(P < 0.01)。见图2。
与A549-control比较,**P < 0.01
图2 A549-control与A549-ING5-OE细胞增殖曲线
2.3 ING5抑制肺癌细胞克隆形成能力
A549-control和A549-ING5-OE细胞接种在6孔板15 d后,计数细胞数多于50个的克隆,结果表明与A549-control相比ING5高表达肺癌细胞的克隆形成能力明显降低,A549-ING5-OE细胞的克隆形成率为A549-control细胞的50%,差异有高度统计学意义(P < 0.01)。见图3。
2.4 ING5抑制裸鼠皮下成瘤及移植瘤的生长
裸鼠皮下接种A549-control和A549-ING5-OE细胞,7 d后成瘤,随着时间的增加,接种A549-control裸鼠肿瘤生长较快,接种A549-ING5-OE的裸鼠肿瘤生长明显较慢,结果表明ING5高表达后显著抑制裸鼠皮下成瘤及移植瘤的生长。见图4。
图4 生长抑制因子5抑制裸鼠皮下种植瘤的生长
2.5 接种A549-ING5-OE及A549-control细胞后大鼠体积变化情况
接种A549-ING5-OE细胞成瘤,肿瘤体积大小基本无增加。A549-control细胞接种成瘤,肿瘤体积明显增大。从肿瘤生长曲线可以看出ING5高表达的肺癌细胞肿瘤生长明显被抑制,肿瘤体积较对裸鼠A549-control细胞接种显著减小。见图5。
图5 肿瘤生长曲线
3 讨论
作为候选抑癌基因家族成员,近年来ING家族在肿瘤发生、发展过程中的作用和机制受到越来越多的关注。路美玲等[17]研究结果表明,与正常肝组织相比,肝癌细胞株ING5 mRNA表达明显降低,在肿瘤转化过程中与正常组织相比ING5表达明显被抑制。赵春阳等[18]研究结果表明,在肿瘤细胞中ING5表达水平越低,肿瘤的恶性程度就越高。
研究表明,肺癌的发生、发展以及侵袭、转移是多基因参与、多步骤发生的过程[19-20]。随着近年来外科技术发展的日趋完善,新的化学治疗药物和局部治疗方法不断出现,但对肺癌的总体治疗效果却不甚理想,因此从分子水平研究肺癌发生、发展中的分子机制,针对肺癌中异常分子的治疗药物和治疗方法就成了新的研究热点,并促进了肺癌分子靶向治疗的出现。本研究中,通过慢病毒介导的基因转染方法使ING5在A549细胞中高表达,发现ING5高表达后与对照肺癌细胞相比,其增殖能力和克隆形成能力均降低,说明在细胞水平ING5抑制了肺癌细胞的增殖和克隆形成能力。通过裸鼠在体水平的研究同样发现,ING5抑制了裸鼠皮下成瘤及移植瘤的生长,动物实验研究结果同样说明ING5抑制了肺癌细胞的增殖,与上述细胞实验结果相符。
综上所述,ING5在肺癌细胞高表达后抑制了肺癌细胞的增殖,提示ING5在肺癌的发生和发展中起到了抑癌基因的作用,为肺癌的基因治疗提供了新的靶点。
[参考文献]
[1] Unoki M,Kaumamoto K,Takenoshita S,et al. Reviewing the current classification of inhibitor of growth family proteins [J]. Cancer Sci,2009,100(7):1173-1179.
[2] Shah S,Smith H,Feng X,et al. ING function in diverse model systems [J]. Biochem Cell Biol,2009,87(1):117-125.
[3] Zhang F,Rode M,Ji P,et al. The inhibitor of growth protein 5(ING5)depends on INCA1 as a co-factor for its antiproliferative effects [J]. PLos One,2011,6(7):207-215.
[4] Campos EI,Chin MY,Kuo WH,et al. Biological function of the ING family tumor suppressors [J]. Cell Mol Life Sci, 2004,61(19-20):2597-2613.
[5] Garkavtsev I,Grigorian IA,Ossovskaya VS,et al. The candidate tumor suppressor p33ING1 cooperate with p53 in cell growth control [J]. Nature,1998,391(6664):295-298.
[6] He GH,Helbing CC,Wagner MJ,et al. Phylogenetic analysis of the ING family of PHD finger proteins [J]. Mol Biol Evol,2005,22(1):104-116.
[7] Coles AH,Jones SN. Inhibitor of growth-4 promotes I-kappa B promoter activation to suppress NF-kappa B signaling and innate immunity [J]. Proc Natl Acad Sci USA,2010,107(25):11423-11428.
[8] Tallen G,Riabowol K. Keep-ING balance:tumor suppression by epigenetic regulation [J]. FEBS Lett,2014,588(16):2728-2742.
[9] Soliman MA,Riabowol K. After a decade of study-ING,a PHD for a versatile family of proteins [J]. Trends Biochem Sci,2007,32(11):509-519.
[10] Gong W,Suzuki K,Russell M,et al. Function of the ING family of PHD proteins in cancer [J]. Biochem Cell Biol,2005,37(5):1054-1065.
[11] Shiseki M,Nagashima M,Pedeux RM,et al. P29ING4 and p28ING5 bind to p53 and p300,and enhance p53 activity [J]. Cancer Res,2003,63(10):2373-2378.
[12] Ohgi T,Masaki T,Nakai S,et al. Expression of p33(ING1)in hepatocellular carinoma:relationships to tumor differentiation and cyclin E kinase activity [J]. Scand J Gastroenterol,2002,37(12):1440-1448.
[13] Zhu Z,Luo Z,Li Y,et al. Human inhibitor of grow 1 inhibits hepatoma cell growth and influences p53 stability in a variant-dependent manner [J]. Hepatology,2009,49(2):504-512.
[14] Zhang HK,Pan K,Wang H,et al. Decreased expression of ING2 gene and its clinicopathological significance in hepatocellular carcinoma [J]. Cancer Lett,2008,261(2):183-192.
[15] Fang F,Luo LB,Tao YM,et al. Decreased expression of inhibitor of growth 4 correlated with poor prognosis of hepatocellular carcinoma [J]. Cancer Epidemiol Biomarkers Prev,2009,18(2):409-416.
[16] Doyon Y,Cayrou C,Ullah M,et al. ING tumor suppressor proteins are critical regulators of chromatin acetylation required for genome expression and perpetuation [J]. Mol Cell,2006,21(1):51-64.
[17] 路美玲,陈斐,王勤婉.ING5在肝癌中表达的研究[J].胃肠病学,2010,15(2):86-89.
[18] 赵春阳,徐广全.ING5在食管鳞癌中的表达及意义[J].高师理科学刊,2013,33(3):71-72.
[19] Shiseki M,Nagashima M,Pedeux RM,et al. P29ING4 and p28ING5 bind to p53 an p300,and enhance p53 activity [J]. Cancer Res,2003,63(10):2373-2378.
[20] 常莎,王瑞平.基于CT三维图像的肺结节良恶性鉴别研究[J].北京生物医学工程,2013,32(1):12-16.
(收稿日期:2014-11-14 本文编辑:任 念)

