超声辅助提取发酵豆渣蛋白工艺研究
刘 帅,聂乾忠*,方媛媛
(湖南农业大学食品科学技术学院,湖南 长沙 410128)
豆渣是豆腐、豆乳、豆油等大豆制品的副产物,目前,我国每年平均排放豆渣1 500万t,由于豆渣的水分含量大、水溶性差、口感粗糙,多年来一直没有得到充分利用,大部分作为饲料使用[1-2]。豆渣中含有丰富的蛋白质、膳食纤维、脂肪、异黄酮以及维生素和矿物质,豆渣蛋白具有较低的过敏性,并且具有人体所需的各种必需氨基酸[3]。国内外研究表明,豆渣具有重要的药用价值和生理功能,豆渣由于富含膳食纤维、蛋白质、维生素、异黄酮等成分,具有预防肠癌和减肥的功效,以及降低人体的胆固醇含量、降血压、预防糖尿病及抗氧化等功能[4-7]。因此豆渣具有一定的利用和开发价值,可以作为一种食品资源加以利用。
蛋白的提取方法有很多,如酶法、碱溶酸沉法、反胶束法、盐析法等[8-9]。近年来利用微生物发酵豆渣生成具有一定生理功能的生物活性肽,以及利用豆渣蛋白粗提物生产功能性食品,成为豆渣开发和利用的主要方向和热点[10]。豆渣经过微生物发酵后,还原糖、水溶性蛋白、小分子肽、氨基酸的含量得到很大提高,同时在微生物的作用下还产生一些新的功能性成分,具有较大的加工价值[11-13]。另外利用微生物发酵豆渣成本较低,并且减少了化学试剂的使用和残留,对于倡导绿色食品的今天,采用发酵来生产具有保健功能的豆渣食品具有重要的意义。
本试验首先采用黑曲霉(Aspergillus niger)对豆渣进行发酵,使部分难溶的豆渣蛋白分解为溶解性较好的多肽,然后采用超声法和酸溶碱沉法结合的方法,以料液比、碱提温度、超声功率、碱液浓度、超声时间为主要因素,以豆渣蛋白提取率为评价指标,通过单因素和正交试验,探讨豆渣蛋白的最佳提取工艺,为豆渣蛋白的提取与应用提供新的研究思路,以及豆渣的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜豆渣:购于湖南农业大学滨湖市场;麸皮:市购;黑曲霉(Aspergillus niger):湖南农业大学食品科技学院微生物研究室提供;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:广东环凯微生物科技有限公司。
氢氧化钠、硫酸、盐酸、硫酸铜、硼酸、硫酸钾、甲基红、溴甲酚绿、乙醇、硼砂等均为国产分析纯。
1.2 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;GZ-250-S生化培养箱:韶关市广智科技设备发展有限公司;FW177型中药粉碎机:天津市泰斯特仪器有限公司;KQ-250DE型数控超声波清洗仪:昆山市超声仪器有限公司;TD5Z型台式离心机:湖南凯达科学仪器有限公司;PHS-3C型pH计:上海精密科学仪器有限公司;FD-1B型冷冻干燥机:北京博医康实验仪器有限公司;KDN-04A定氮仪:上海精隆科学仪器有限公司。
1.3 试验方法
1.3.1 菌种活化
将黑曲霉接种于马铃薯葡萄糖琼脂(PDA)斜面培养基上,28 ℃培养72 h,加入一定量的无菌水振荡洗下成熟的孢子,用无菌纱布过滤,转移至100 mL三角瓶,在磁力搅拌器上搅拌0.5 h,使孢子分散,制成孢子悬液,用血球计数法控制孢子悬液浓度至106个/mL,作为豆渣发酵的菌悬液[5]。
1.3.2 发酵豆渣蛋白提取的工艺流程及操作要点
新鲜豆渣→前处理→灭菌(121 ℃、20 min)→冷却→黑曲霉接种→拌匀→发酵(28 ℃、72 h)→灭菌(121 ℃、20 min)→冷却→干燥(65 ℃、6 h)→粉碎→过筛(100目)→碱法提取/超声辅助碱法提取→离心(8 000 r/min、20 min)→上清液→酸(HCl)沉(pH 5.4)→离心(8 000 r/min、20 min)→收集沉淀→冷冻干燥(-50 ℃、24 h)→豆渣粗蛋白
操作要点:
前处理:选取新鲜豆渣,除去其中的杂质,并用3层滤布进行压榨,除去过多的水分。
灭菌:将前处理过的豆渣装入250 mL锥形瓶中,每瓶20 g,厚度为2~3 cm,121 ℃条件下蒸汽灭菌20 min。
黑曲霉接种:待豆渣冷却至室温后,每瓶接种10 mL黑曲霉孢子悬液,并用已灭菌的玻璃棒搅拌均匀。
发酵:用3层灭菌纱布封住瓶口,将已接种的豆渣置于28 ℃恒温培养箱中,培养72 h。
干燥:发酵结束后,将发酵产物平摊在浅盘中,65 ℃干燥6 h。
离心:将豆渣蛋白提取液在8 000 r/min的条件下离心20 min。
酸沉:向已离心的上清液中加入0.1 mol/L的HCl溶液,调节至豆渣蛋白等电点pH 5.4,使其沉淀。
冷冻干燥:将收集的豆渣蛋白沉淀在-50 ℃条件下,冷冻干燥24 h,得到豆渣粗蛋白。
1.3.3 发酵豆渣蛋白提取的单因素试验设计(1)料液比对豆渣蛋白提取率的影响
碱液浓度为0.3 mol/L,提取温度为50 ℃,超声提取时间为75 min,超声功率300 W,料液比分别于1∶16、1∶18、1∶20、1∶22、1∶24、1∶26、1∶28(g∶mL)提取发酵豆渣蛋白,测定蛋白质提取率。
(2)提取时间对豆渣蛋白提取率的影响
料液比1∶24(g∶mL),碱液浓度为0.3 mol/L,温度50 ℃,超声功率300 W的条件下提取30 min、45 min、60 min、75 min、90 min、105 min、120 min,测定蛋白质提取率。
(3)提取温度对豆渣蛋白提取率的影响
料液比为1∶24(g∶mL),碱液浓度为0.3 mol/L,超声提取时间为75 min,超声功率300 W,温度分别于35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃提取发酵豆渣蛋白,测定蛋白质提取率。
(4)碱液浓度对豆渣蛋白提取率的影响
料液比1∶24(g∶mL),提取温度50 ℃,超声提取时间75 min,超声功率300 W,碱液浓度分别于0.05 mol/L、0.1 mol/L、0.2 mol/L、0.3 mol/L、0.4 mol/L、0.5 mol/L提取发酵豆渣蛋白,测定蛋白质提取率。
(5)超声功率对豆渣蛋白提取率的影响
料液比1∶24(g∶mL),碱液浓度为0.3 mol/L,提取温度50 ℃,超声提取时间75 min,超声功率分别为100 W、200 W、300 W、400 W、500 W,测定豆渣蛋白的提取率。
1.3.4 发酵豆渣蛋白提取条件的正交试验优化
以豆渣蛋白提取率为评价指标,通过单一碱溶酸沉法和超声辅助碱溶酸沉法分别研究料液比、提取温度、提取时间和碱液浓度对豆渣蛋白质提取率的影响,在单因素试验的基础上,采用正交试验确定豆渣蛋白最佳提取工艺,正交试验因素与水平见表1。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
1.3.5 测定指标
蛋白质含量测定采用国标GB/T 5009.5—2010《食品中蛋白质的测定》中的凯氏定氮法。蛋白质提取率计算公式如下:
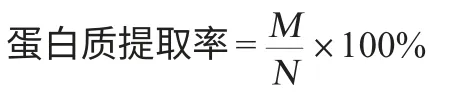
式中:M为提取蛋白质含量,g;N为豆渣中蛋白质含量,g。
2 结果与分析
2.1 料液比对豆渣蛋白提取率的影响
由图1可知,两种方法的提取率都是随着料液比的增大,先增加后趋于不变。超声辅助碱溶酸沉法的提取率明显高于单一碱溶酸沉法。单一碱溶酸沉法在料液比达到1∶24(g∶mL)时,提取率达到64.75%,然后变化幅度变小,超声辅助碱溶酸沉法在料液比1∶22(g∶mL)时,提取率达到79.18%,随后趋于不变。最初料液比增加,提取率增加,可能是由于随着料液比增加,体系的黏度降低,蛋白质的扩散速率加快,有利于蛋白质溶解在碱液中,当料液比增加到一定的程度后,提取率逐渐趋于稳定,这是因为随着加水量的增多,使得蛋白质浓度过低[14]。因此选择料液比为1∶22、1∶24、1∶26(g∶mL)进行正交试验。

图1 料液比对豆渣蛋白提取的影响Fig.1 Effect of solid-liquid ratio on okara protein extraction rate
2.2 提取时间对豆渣蛋白提取率的影响
由图2可知,两种方法的提取率都是随着提取时间的增长先上升后达到一个平衡值,不再上升,可能是因为豆渣在提取过程中需要一定的时间进行溶胀,并且超声使得蛋白的溶出和扩散速度不断增加,使得提取时间大大缩短。单一碱溶酸沉法在提取时间为120 min时,提取率达到64.25%,同时超声辅助碱溶酸沉法时间为120 min时,提取率达到77.5%,提取率比单一碱溶酸沉法有较大提高,而超声辅助碱溶酸沉法提取率在60~120 min,变化不大,因此选择提取时间60 min、75 min、90 min进行正交试验。
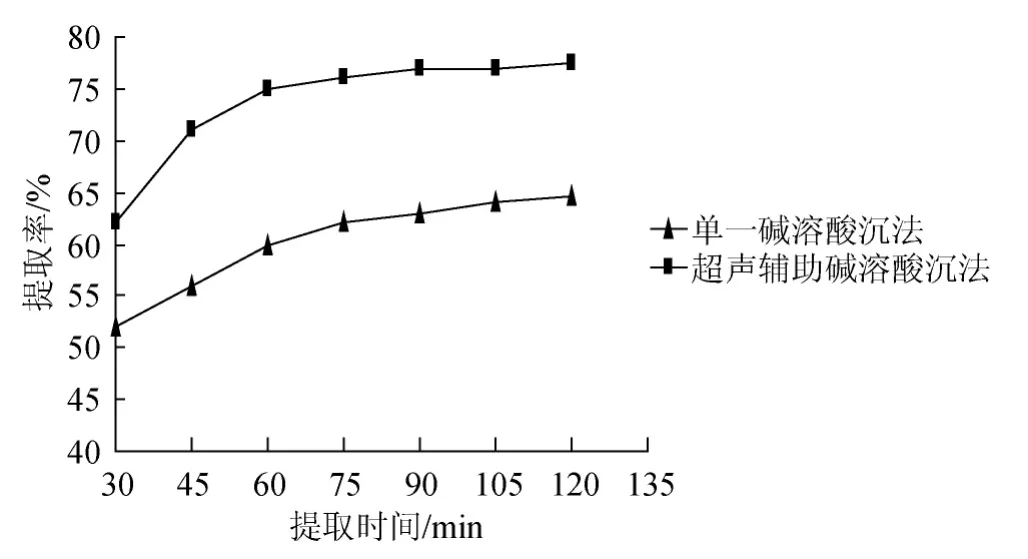
图2 提取时间对豆渣蛋白提取率的影响Fig.2 Effect of extraction time on okara protein extraction rate
2.3 提取温度对豆渣蛋白提取率的影响
由图3可知,两种提取方法的提取率都是随着提取温度的上升先增加后降低,单一碱溶酸沉法在温度为50 ℃时,提取率达到最大值69.15%,超声辅助碱溶酸沉法在温度为55 ℃时达到最大提取率为77.23%。随着提取温度的升高,蛋白质的提取率增加,可能是因为温度上升,分子的热运动加剧,蛋白质的溶解和扩散程度增加,从而提高了提取率,但是温度过高,提取率下降是因为温度过高使豆渣蛋白分子变性,溶解度降低[9]。因此选择提取温度为45 ℃、50 ℃、55 ℃进行正交试验。

图3 提取温度对豆渣蛋白提取率的影响Fig.3 Effect of extraction temperature on okara protein extraction rate
2.4 碱液浓度对豆渣蛋白提取率的影响
由图4可知,随着氢氧化钠浓度的升高,豆渣蛋白的提取率不断增加,在增加到一定程度后,趋于稳定,甚至略有下降。单一碱溶酸沉法在氢氧化钠达到0.3 mol/L时,提取率达到61.35%,然后增大的幅度逐渐减小,超声辅助碱溶酸沉法在氢氧化钠浓度达到0.3 mol/L时,提取率达到最大值78.46%,然后逐渐下降。研究表明,在碱液浓度过高时,蛋白质会发生变性,使得蛋白的溶解度下降,并在后期的酸沉淀中生成大量的盐,不利于蛋白质的除盐纯化[15]。综合考虑,选择氢氧化钠浓度为0.2 mol/L、0.3 mol/L、0.4 mol/L进行正交试验。

图4 碱液浓度对豆渣蛋白提取率的影响Fig.4 Effect of NaOH concentration on okara protein extraction rate
2.5 超声功率对豆渣蛋白提取率的影响
由图5可知,豆渣蛋白提取率随着超声功率的增加,提取率先上升,后逐渐趋于平缓,这可能是由于随着超声功率的增加,可产生强烈的空化、湍动和热效应使得空化泡崩溃的时间变短,从而提高了蛋白质的溶解速率,当声强达到一定的强度后,会使得蛋白质变性,从而不利于蛋白质提取[16]。已发酵豆渣蛋白提取率明显高于未发酵豆渣,可能是因为在发酵过程中,蛋白酶的作用使得部分大分子蛋白质酶解为可溶性小分子多肽,从而增加了蛋白的溶解性。综合考虑,超声功率为300 W。

图5 超声功率对豆渣蛋白提取率的影响Fig.5 Effect of ultrasonic power on okara protein extraction rate
2.6 提取条件优化正交试验结果分析
在单因素试验的基础上,采用正交试验确定豆渣蛋白最佳提取工艺,正交试验结果与分析见表2,方差分析见表3。

表2 提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2极差分析结果可知,影响豆渣蛋白提取率的各因素依次是:提取温度>提取时间>碱液浓度>料液比,最佳提取工艺为A3B3C2D2,即提取温度为55 ℃,提取时间为90 min,碱液浓度为0.3 mol/L,料液比为1∶24(g∶mL)。在此最佳条件下进行3次验证试验,豆渣蛋白平均提取率为83.84%。由表3方差分析结果可知,超声时间和提取温度对发酵豆渣蛋白的提取率有显著影响(P<0.05),料液比和碱液浓度对发酵豆渣蛋白的提取率影响均不显著。
3 结论
由单因素试验结果可知,超声辅助碱溶酸沉法比单一碱溶酸沉法在同样条件下蛋白提取时间缩短,提取率升高,已发酵豆渣比未发酵豆渣蛋白提取效果好,同样条件下提取率大幅提高。
由正交试验结果可知,影响豆渣蛋白提取率的各因素依次是:提取温度>提取时间>碱液浓度>料液比,超声辅助碱溶酸沉法提取发酵豆渣条件是:提取温度为55 ℃,提取时间为90 min,碱液浓度为0.3 mol/L,超声功率为300 W,料液比为1∶24(g∶mL)。在此最佳条件下,发酵豆渣蛋白的提取率是83.84%,对于豆渣蛋白的提取与应用具有一定的参考意义。
[1]祝团结,郑为完.大豆豆渣的研究现状与展望[J].食品研究与开发,2004,25(4):25-39.
[2]夏剑秋,江连洲,王喜泉,等.国内外大豆加工业生产现状与发展趋势[J].中国油脂,2003,28(9):8-14.
[3]高金燕.豆渣的营养及药用价值[J].中国粮食与营养,2003(11):49-51.
[4]ALEIXANDRE A,MIGUEL M.Dietary fiber in the prevention and treatment of metabolic syndrome:a review[J].Crit Rev Food Sci Nutr,2008,48(10):905-910.
[5]王 慧,刘 莹,胡博涵,等.豆渣不同菌种发酵后成分变化的研究[J].现代食品科技,2013,29(6):1277-1280.
[6]WAKITA Y,HARADA O,KUWATA M,et al.Preparation of subcritical water-treated okara and its effect on blood pressure in spontaneously hypertensive rats[J].Food Sci Technol Res,2004,10:164-166.
[7]LAIRON D.Dietary fiber and control of body weight[J].Nutr Metab Cardiovasc Dis,2007,17(1):1-6.
[8]周德红,郑为完,祝团结.酶法水解豆渣制备水解蛋白工艺[J].南昌大学学报,2005,27(2):74-76.
[9]徐 赏,华欲飞,张彩猛.豆渣蛋白的制备及其研究进展[J].中国油脂,2013,38(2):36-39.
[10]MATSUO M.In vivoantioxidant activity of okara koji,a fermented okara,byAspergillus oryzae[J].Biosci Biotechnol Biochem,1997,61:1968-1971.
[11]王杰夫,鲁 绯,张 健,等.微生物发酵豆渣食品的研究进展[J].食品工业科技,2007,28(9):212-215.
[12]PAMDJAITAN N,HETTIARACHCHY N,JU Z Y,et al.Evaluation of genistin and genistein contentsin soybean varietiesand soyprotein concentrate prepared with 3 basic methods[J].Food Sci,2000,33(5):99-102.
[13]肖少香.三种发酵豆渣产品的研制[J].食品科技,2009,34(11):87-90.
[14]马秀婷,肖志刚,罗志刚,等.豆渣蛋白提取与检验试验[J].江苏大学学报,2014,35(2):176-181.
[15]王卫香,刘 颖,王 玲.超声波辅助萃取豆渣中可溶性多糖工艺[J].中国酿造,2012,31(4):92-96.
[16]唐鑫媛,夏延斌,文新昱.超声辅助碱法提取辣椒渣中蛋白质的工艺优化[J].食品与机械,2015,31(2):222-226.

