草鱼鱼肠抗菌活性物质的提取
刘伦伦,刘 焱*,黎 迅
(湖南农业大学 食品科技学院,湖南 长沙 410128)
抗菌肽是具有抗菌活性的肽类的总称,抗菌肽不但具有广谱的抗菌活性,而且还有抗癌、抗病毒、抗寄生虫、促进伤口愈合等作用[1]。DE LATOUR F A[2]从眼镜蛇中提取的抗菌肽能抑制大肠杆菌的生长;袁永俊等[3]研究表明,酶解得到的酪蛋白抗菌肽对金黄色葡萄球菌、蜡样芽孢杆菌和大肠杆菌有抑菌作用;HWANG B等[4]从柑橘凤蝶中提取的抗菌肽Papiliocin通过调节活性氧和羟自由基的积累控制白色念珠菌的凋亡;此外,相关研究表明某些抗菌肽对癌细胞的抑制作用明显[5-7]。据BARONI A等[8]的报道,蛙皮素可能参与伤口的皮肤修复。可见,抗菌肽具有较大的药用开发价值。在近几年中,抗菌肽逐渐成为免疫学、细胞生物学和分子生物学等领域的研究热点,有望开发成为新一代肽类抗菌、抗癌等药物的来源。对抗菌物质的提取纯化是将其进行性质分析和应用的前提,因此开发利用一种新的抗菌肽,提取纯化的步骤至关重要。国内外研究报道提取抗菌肽的方法较多,如用乙腈、甲醇、盐酸、乙酸浸提,其中用乙酸浸提是最常用的方法[9-10]。CHARLET M等[11]用乙酸从贻贝中提取mytilus defensins,mytilins,mytimycin。韩俊文[12]用体积分数为80%的甲醇溶液浸提牛蛙的皮肤,得到2种抑菌活性肽;LI C等[13]用含0.1%三氟乙酸的体积分数为60%的乙腈浸提海胆,提取到了有抗菌活性的阳离子肽。草鱼肠道作为草鱼加工的副产物,直接丢弃会造成环境污染和资源浪费,从草鱼肠道中提取抗菌活性物质,有利于提高草鱼肠道的利用价值。目前草鱼肠的相关研究较少,且主要是基因方面的研究[14-16]。由于超声能够促进目标物的溶解,而低温有利于保护抗菌物的活性。因此,本试验采用超声提取与低温浸提结合的方法,从草鱼肠道中提取抗菌活性物质,并通过单因素试验和正交试验研究乙酸体积分数、料液比和超声时间对提取草鱼肠道抗菌物质的影响,以期得到草鱼肠道抗菌物质的最佳提取条件,为其进一步的分析和应用奠定基础。
1 材料与方法
1.1 材料与试剂
草鱼鱼肠:东湖小区谢师傅烤鱼店收集。
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):湖南农业大学微生物实验室贮藏。
营养琼脂、营养肉汤:广东环凯微生物科技有限公司;乙酸(分析纯)、考马斯亮蓝G250、乙醇(分析纯)、牛血清白蛋白标准品:国药集团化学试剂有限公司;磷酸(色谱纯):天津市光复精细研究所。
1.2 仪器与设备
SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司;LDZX-50KBS型高压灭菌锅:上海申安医疗器械厂;HWS-280型智能培养箱:宁波海曙赛福实验仪器厂;101-2AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;FD-1B-80型真空冷冻干燥机:北京博医康技术公司;UV-2450型紫外可见分光光度计、AUY220型分析天平:日本岛津公司;S20型pH计:美国Mettler Toledo公司;2~20 μL微量移液枪:德国Eppendorf公司;CF16RXII型立式高速冷冻离心机:日本Hitachi公司;KQ5200E型超声波清洗器:昆山市超声仪器有限公司。
1.3 方法
1.3.1 样品预处理
将收集的草鱼肠剪开,用蒸馏水洗净,并用搅碎机搅碎成浆状。
1.3.2 单因素试验
在乙酸体积分数为1%、4%、8%、12%、16%,料液比1∶1、1∶2、1∶3、1∶4、1∶5(g∶mL),超声时间分别为0、10 min、20 min、30 min、40 min的条件下,超声功率为200 W、频率为40 kHz,4 ℃浸提24 h后,20 000×g离心20 min,收集上清液,考察乙酸体积分数、料液比及超声时间对提取物质抗菌活性的影响。
1.3.3 正交试验优化提取工艺条件
在单因素试验的基础上,以抑菌圈直径作为评价指标,料液比(A)、乙酸体积分数(B)超声时间(C)为影响因素,进行3因素3水平正交试验,因素与水平见表1。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
1.3.4 抑菌活性测定
菌种活化:用接种环将大肠杆菌和金黄色葡萄球菌分别接种到营养肉汤培养基中,37 ℃培养24 h。
抑菌活性测定:抑菌活性采用纸片扩散法测定。取0.1 mL活化的菌种,均匀涂布到直径为9 cm的营养琼脂平板上,并放置直径为6 mm的滤纸片,取上清液15 μL滴在滤纸片上,并以相同pH值的乙酸稀释液为对照组,培养12 h,用游标卡尺测定抑菌圈直径。
1.3.5 紫外最大吸收峰测定
将试验离心得到的上清液用蒸馏水稀释100倍,用紫外分光光度计进行波谱扫描,扫描范围为190~700 nm,确定提取液的最大吸收波长。
1.3.6 蛋白质含量的测定
蛋白质含量测定参照《生物化学实验教程》中考马斯亮蓝(Bradford)法[17]。
1.3.7 对照组的设定
因为乙酸对大肠杆菌和金黄色葡萄球菌也有一定的抑菌作用,而在试验过程中乙酸由于被肠道碱性物质中和、被肠道匀浆液稀释和自身的挥发等,而产生了部分的减少,所以最终以与抑菌物质提取液的pH值相同的乙酸溶液作为对照组。
1.3.8 试验数据处理
采用Excel软件对数据进行处理和作图,SPSS 17.0进行数据分析,差异显著性分析采用Duncan新复极差法(SSR),且α为0.05,数据表示采用平均数±标准差和标记字母法。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙酸体积分数的选择
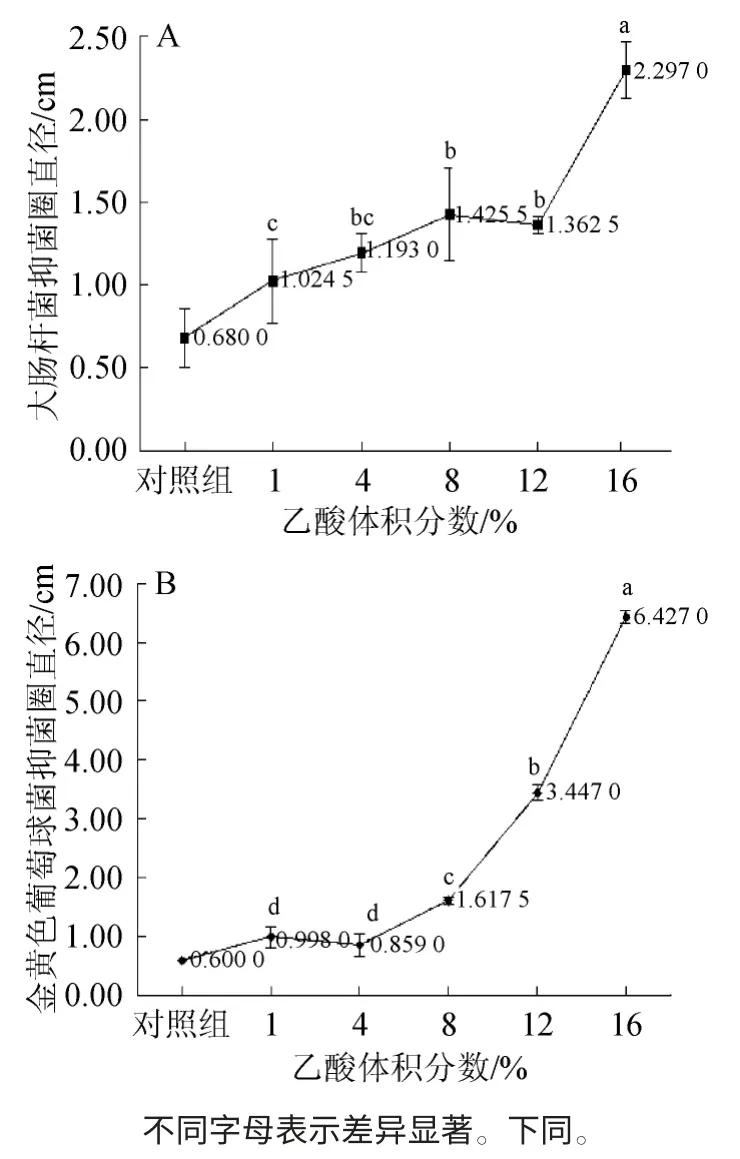
图1 不同乙酸体积分数对大肠杆菌(A)和金黄色葡萄球菌(B)抑菌效果的影响Fig.1 Effect of different acetic acid concentration on antibacterial effect ofEscherichia coli (A) andStaphylococcus aureus (B)
由图1可知,以大肠杆菌的抑菌圈直径为评价指标,乙酸体积分数为1%和4%时,抑菌圈较小,并且二者之间没有显著区别;乙酸体积分数分别为4%、8%和12%时,这三个水平之间的区别也不显著;乙酸体积分数为16%时,抑菌圈相对其他4组明显较高,为2.297 0 cm。而以金黄色葡萄球菌的抑菌圈直径为评价指标,乙酸体积分数为1%和4%时,抑菌圈直径较小,并且二者之间没有显著区别;在8%~16%的范围内,抑菌圈直径随着乙酸体积分数的增加,最高可达6.427 0 cm,抑菌效果呈现幅度较大的增加趋势,且这三个水平之间存在显著差异。
乙酸体积分数为16%时,提取液的pH值为3.30,此时,以大肠杆菌的抑菌圈直径为评价指标,对照组的抑菌圈直径为1.055 0 cm,对试验结果存在明显干扰,这是因为乙酸体积分数过大,也产生了部分抑菌效果(以金黄色葡萄球菌的抑菌圈直径为指标,对照组的抑菌圈直径为0.600 0 cm);乙酸体积分数为10%~12%时,对照组无明显的抑菌效果。综合考虑,8%~12%的乙酸体积分数比较适宜。
2.1.2 料液比的选择
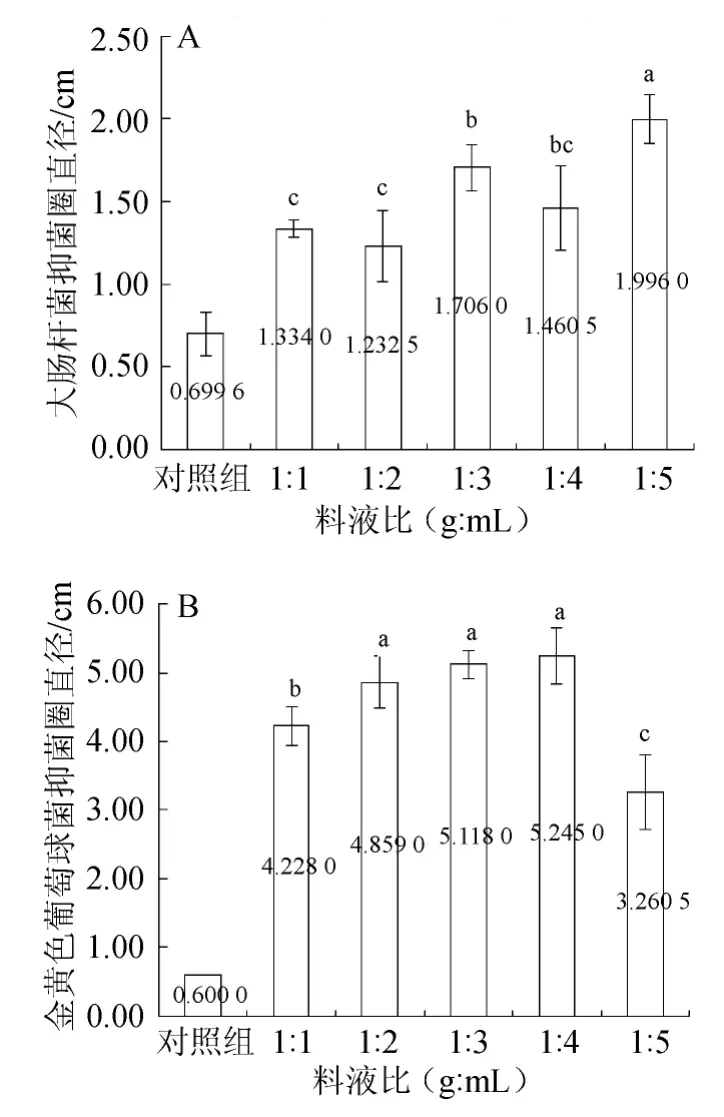
图2 不同料液比对大肠杆菌(A)和金黄色葡萄球菌(B)抑菌效果的影响Fig.2 Effect of different solid-liquid ratio on antibacterial effect ofEscherichia coli (A) andStaphylococcus aureus (B)
由图2可知,以大肠杆菌的抑菌圈直径为评价指标,料液比为1∶3(g∶mL)和1∶5(g∶mL)时,抑菌圈直径较大,分别为1.706 0 cm和1.996 0 cm,且二者水平之间存在显著差异;料液比为1∶1、1∶2、1∶4(g∶mL)时,这三个水平之间抑菌圈直径没有显著区别,且相对其他两组抑菌圈直径较小。以金黄色葡萄球菌的抑菌圈直径为评价指标,料液比为1∶5(g∶mL)时,金黄色葡萄球菌的抑菌圈直径均值最小,为3.260 5 cm;而料液比为1∶2~1∶4(g∶mL)时,金黄色葡萄球菌的抑菌圈较大,分别为4.859 0 cm、5.118 0 cm和5.245 0 cm,且这三个水平之间没有显著区别。料液比为1∶5(g∶mL)时,提取液的pH值为3.01,此时,对照组的抑菌圈直径为0.930 0 cm,对试验结果存在明显干扰,而其余4组试验的对照组无明显的抑菌效果;综合考虑,料液比为1∶3(g∶mL)比较适宜。
2.1.3 超声处理时间的选择

图3 不同超声时间对大肠杆菌(A)和金黄色葡萄球菌(B)抑菌效果的影响Fig.3 Effect of different ultrasonic time on antibacterial effect ofEscherichia coli(A)andStaphylococcus aureus(B)
由图3可知,在0~20 min的范围内,随着超声时间的增加,提取的草鱼肠道抗菌物质对大肠杆菌的抑菌效果呈现增加的趋势,且增加的趋势较为平缓;超声时间20 min时,大肠杆菌的抑菌圈直径均值最大,为1.740 5 cm;超声时间为30 min时,大肠杆菌的抑菌圈直径均值最小,为1.272 5 cm,这可能是因为超声时间过长,导致了抗菌物质结构的破坏,使其活性反而降低。在0~20 min的范围内,随着超声时间的增加,金黄色葡萄球菌的抑菌圈直径均值呈现下降的趋势;20~40 min的范围内,随着超声时间的增加,抑菌圈直径较平稳;不经过超声处理时,提取的草鱼肠道抗菌物质对金黄色葡萄球菌的抑菌效果最好,抑菌圈直径均值为4.228 0 cm,明显优于超声处理组。
超声在促进抗菌物质的溶解时,也有可能破坏抗菌物质的结构,从而降低其活性。因此,在超声处理试验中才会出现随时间变化,抑菌圈直径变化的不规律性或出现下降的现象。此5组试验的对照组的抑菌圈直径均在0.800 0 cm以内(滤纸片的直径为0.600 0 cm),而试验组抑菌圈最低是1.272 5 cm,最高是4.228 0 cm,可判断抑菌效果主要来自提取液中的抗菌活性物质。且综合考虑,超声处理10~20 min较适宜。
2.2 草鱼肠道提取物中抗菌物质的初步鉴定
草鱼肠道抗菌物质的提取液紫外光谱都是在200 nm附近有强吸收带,且在250~300 nm出现了吸收带,可能含有苯环结构。色氨酸的吲哚环在274.8 nm有较强吸收,酪氨酸的酚基最大吸收峰在280.4 nm处,胱氨酸对280 nm处的吸收值也有贡献,组氨酸的吲哚环在250~260 nm有中等强度吸收带,苯丙氨酸在247 nm、252nm、258 nm和264 nm处有4个小峰。因此,根据多肽和蛋白质的紫外吸收特点,可推测试验组提取的草鱼肠道抗菌物质为多肽或蛋白质成分。
2.3 正交试验优化提取条件
按L9(33)进行正交试验,主要以金黄色葡萄球菌抑菌圈直径大小为评价指标进行比较与分析,以大肠杆菌抑菌圈直径为辅助参考,结果与分析见表2,方差分析见表3。
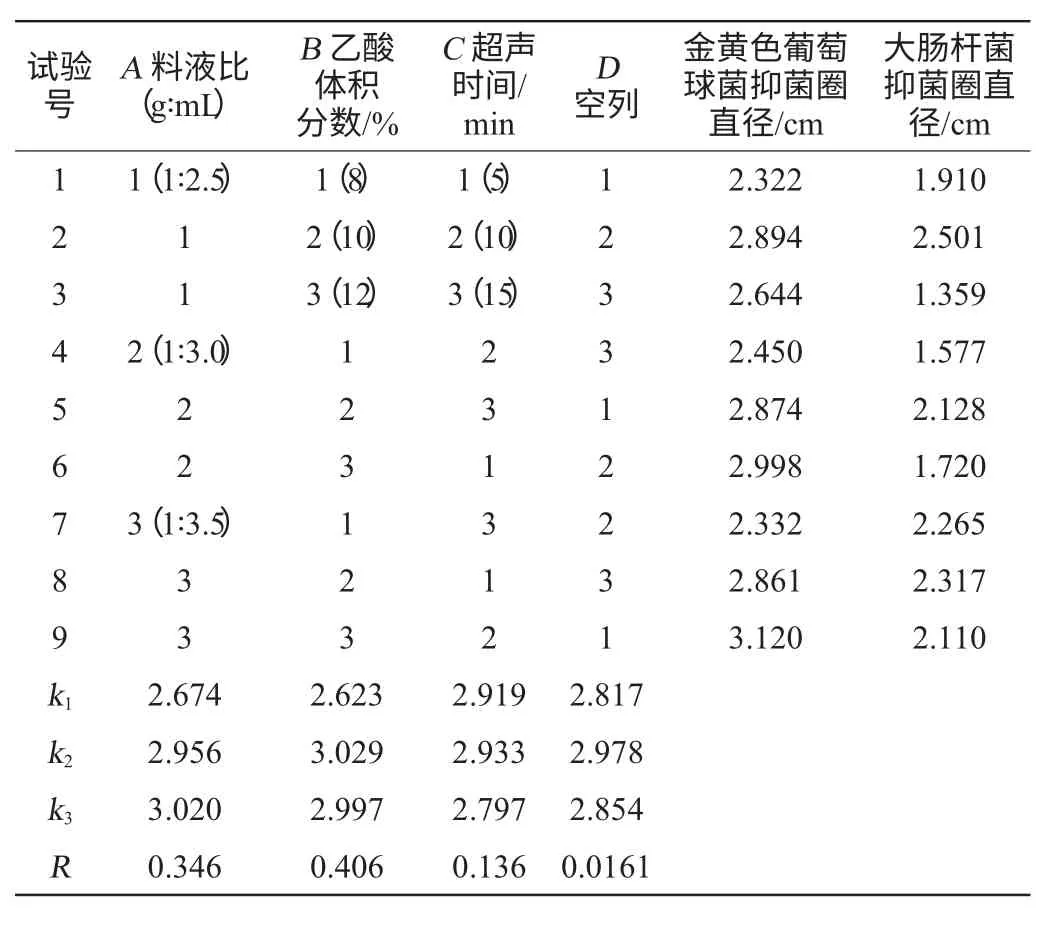
表2 提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization
由表2可知,以金黄色葡萄球菌的抑菌圈直径为评价指标,对结果影响作用大小为乙酸体积分数>料液比>超声时间。最佳提取条件为A3B2C2,即乙酸体积分数10%,料液比1∶3.5(g∶mL),超声时间10 min。在此优化条件下,提取的草鱼肠道抗菌物质抗菌活性较高,其中金黄色葡萄球菌抑菌圈直径为3.1060cm,大肠杆菌抑菌圈直径为2.0284 cm。根据相关文献,阳离子型抗菌肽与微生物细胞膜上的阴离子作用,使细胞膜的离子通道打开,细胞内渗透压发生变化,这可能是试验提取的草鱼肠道抗菌物质能够抑菌的主要原因[18]。
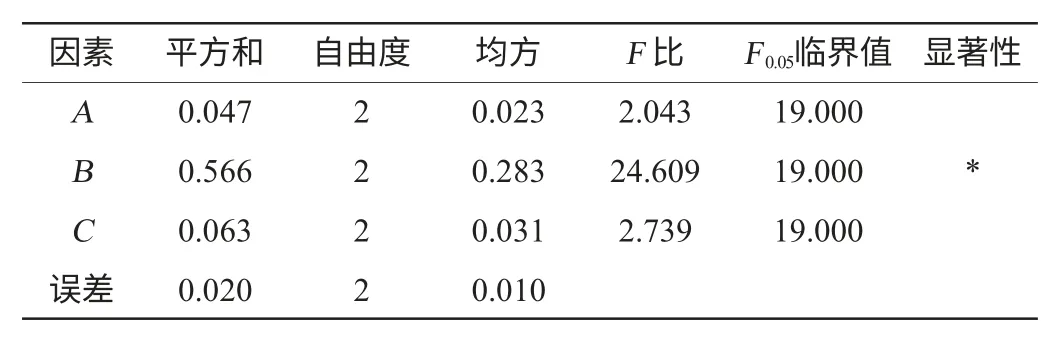
表3 以金黄色葡萄球菌抑菌圈直径为评价指标的正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results using antibacterial circle diameter ofStaphylococcus aureus as evaluation index
由表3可知,在此次试验3个因素的3个水平范围内,乙酸体积分数对试验结果有显著性影响(P<0.05);料液比和超声时间对试验结果的影响不显著。这是因为乙酸有利于抑菌活性物质的溶解,并为抑菌活性物质提供酸性环境,从而保持了其较好的抑菌活性。
2.4 粗提液蛋白质含量
以牛血清白蛋白为标样,制作的标准曲线结果见图4。按乙酸的体积分数为10%,料液比1∶3.5(g∶mL),超声时间10 min,4 ℃浸提24 h,20 000×g离心20 min的方法得到的上清液按Bradford法测得的吸光度值为0.203,即对应的蛋白质含量为252 μg/mL。
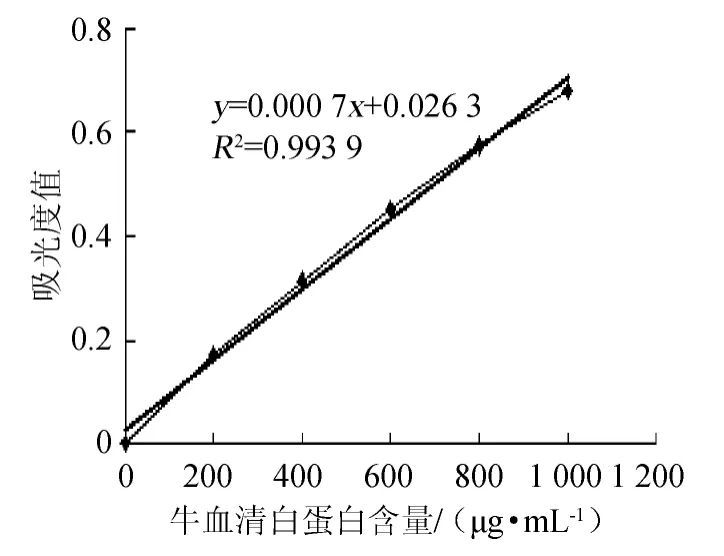
图4 牛血清白蛋白标准曲线Fig.4 Standard curve of bovine serum albumin
3 结论
采用乙酸法提取草鱼肠道抗菌物质,影响草鱼肠道抗菌物质初步提取的主次因素依次为:乙酸体积分数>料液比>超声时间。最终确定草鱼肠道抗菌物质的初步提取工艺组合为A3B2C2:即乙酸体积分数10%,料液比1∶3.5(g∶mL),超声时间10 min,4 ℃浸提24 h,按此条件提取的抗菌液,蛋白质含量为252 μg/mL,抗菌活性较高,其中金黄色葡萄球菌抑菌圈直径为3.106 0 cm,大肠杆菌抑菌圈直径为2.028 4 cm。
[1]赵喜红,何小维,罗志刚,等.抗菌肽的生物活性、作用机制及应用研究进展[J].中国酿造,2007,26(4):1-5.
[2]DE LATOUR F A,AMER L S,PAPANSTASIOU E A,et al.Antimicrobial activity of theNaja atracathelicidin and related small peptides[J].Biochem Bioph Res Co,2010,396(4):825-830.
[3]袁永俊,胡 婷,朱家骅,等.酪蛋白抗菌肽的酶法制备[J].食品与机械,2010,26(2):1-4.
[4]HWANG B,HWANG J S,LEE J,et al.Induction of yeast apoptosis by an antimicrobial peptide,Papiliocin[J].Biochem Bioph Res Co,2011,408(1):89-93.
[5]CHEN H M,WANG W,SMITH D,et al.Effects of the anti-bacterial peptide cecropin B and its analogs,cecropins B-1 and B-2,on liposomes,bacteria,and cancer cells[J].BBA-Gen Subjects,1997,1336(2):171-179.
[6]RIEDL S,ZWEYTICK D,LOHNER K.Membrane-active host defense peptides-challenges and perspectives for the development of novel anticancer drugs[J].Chem Phys Lipids,2011,164(8):766-781.
[7]LIN M C,HUI C F,CHEN J Y,et al.The antimicrobial peptide,shrimp anti-lipopolysaccharide factor(SALF),inhibits proinflammatory cytokine expressions through the MAPK and NF-κB pathways inTrichomonas vaginalisadherent to HeLa cells[J].Peptides,2012,38(2):197-207.
[8]BARONI A,PERFETTO B,CANOZO N,et al.Bombesin:a possible role in wound repair[J].Peptides,2008,29(7):1157-1166.
[9]OVCHINNIKOVA T V,BALANDIN S V,ALESHINA G M,et al.Aurelin,a novel antimicrobial peptide from jellyfishAurelia auritawith structural features of defensins and channel-blocking toxins[J].Biochem Bioph Res Co,2006,348(7):514-523.
[10]YEDERY R D,REDDY K V R.Purification and characterization of antibacterial proteins from granular hemocytes of Indian mud crab,Scylla serrata[J].Acta Biochim Pol,2009,56(1):71-82.
[11]CHARLET M,CHERNYSH S,PHILIPPE H,et al.Innate immunity isolation of several cysteine-rich antimicrobial peptides from the blood of a mollusc,Mytilus edulis[J].J Biol Chem,1996,271(36):21808-21813.
[12]韩俊友.牛蛙皮肤抗菌肽分离纯化,基因克隆表达及生物学特性的研究[D].吉林:吉林大学博士论文,2007.
[13]LI C,HAUG T,MOE M K,et al.Centrocins:Isolation and characterization of novel dimeric antimicrobial peptides from the green sea urchin,Strongylocentrotus droebachiensis[J].Dev Comp Immunol,2010,34(9):959-968.
[14]苏建明.草鱼肠道组织消减cDNA 文库的构建及免疫相关基因的克隆与表达分析[D].长沙:湖南农业大学博士论文,2007.
[15]张学俊,屈 刚,朱文漓,等.草鱼肠道cDNA 文库构建及部分ESTs分析[J].水生生物学报,2007,31(2):251-258.
[16]史玉婷.草鱼肠道β-防御素克隆表达及抗菌活性分析[D].长沙:湖南农业大学硕士论文,2012.
[17]王金亭,方 俊.生物化学实验教程[M].武汉:华中科技大学出版社,2010.
[18]OUELLET M,OTIS F,VOYER N,et al.Biophysical studies of the interactions between 14-mer and 21-mer model amphipathic peptides and membranes:Insights on their modes of action[J].BBA-Biomembranes,2006,1758(9):1235-1244.

