Notch2/Hes-1信号通路活化参与调控肾缺血-再灌注诱导炎症因子的表达研究*
黄仁发,赖虹伊,梁群卿,黄国东,向少伟,汪东涛,马晓露,黄海燕,胡维,林心如,周巧玲
(1.广西中医药大学附属瑞康医院 肾内科,广西 南宁530011;2.广西中医药大学,广西 南宁530023;3.广西中医药大学附属瑞康医院 健康管理中心,广西 南宁530011;4.中南大学湘雅医院 肾内科,湖南 长沙410008)
前期研究表明,肾缺血-再灌注损伤(ischemia-reperfusion injury,IRI)可诱导大鼠血清肿瘤坏死因子-α(tumor necrosis factorsα,TNF-α)、白介素-6(interleukin-6,IL-6)表达增多,肾小管上皮细胞单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)表达上调,证实肾IRI存在炎症过程,肾小管上皮细胞在肾IRI时可转化为炎症细胞[1]。但这种转化的信号机制是什么?本研究应用Notch信号关键酶γ-泌肽酶(γ-secretase)抑制剂DAPT阻断Notch信号通路活化后,观察Notch2/Hes-1信号通路活化是否参与调控肾缺血-再灌注(IR)诱导肾小管上皮细胞转化为炎症细胞的过程。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取10~12周龄健康雄性清洁级SD(sprasue-dawley)大鼠,体重(210±34)g,共45只,购自上海斯莱克景达实验动物有限公司长沙分公司,动物合格证号:SCXK(湘)2009-0004,于湘雅医学院实验动物学部饲养。在室温18~25℃,相对湿度50%~60%,人工12 h昼/夜循环照明环境中,用全价营养,分笼饲养。每日定时清洗笼舍,大鼠自由摄食及饮水。
1.1.2 DAPT的配置方法 5 mg的DAPT加入DMSO 1ml溶解,配制溶度为10mol/L(5mg/ml)的储存液。实验前根据大鼠体重取适量储存液,每次灌胃前加入生理盐水,配制总体积为2ml的工作液。工作液使用前在超净工作台配制。
1.1.3 主要的仪器和试剂 BX-50生物光学显微镜和激光共聚焦显微镜(德国Carl Zeiss),γ-secretase抑制剂DAPT(5mg,美国Sigma公司),蛋白提取试剂盒(上海申能博彩生物技术公司),BCA蛋白定量试剂盒(江苏碧云天生物技术公司,PMSF(江苏碧云天生物技术公司),PDVF膜(苏州广惠科技有限公司),大鼠TNF-α ELISA kit和大鼠IL-6 ELISA kit(美国BPB Biomedical公司),兔抗大鼠MCP-1(武汉博士德生物技术有限公司),兔抗大鼠Notch2多克隆抗体、兔抗大鼠Hes-1多克隆抗体和FITC标记的山羊抗兔IgG(美国Santa Cruz公司)。
1.2 方法
1.2.1 动物模型的建立与分组 实验动物术前禁食12 h,自由进水,术前用10%水合氯醛溶液(3.5ml/kg)腹腔注射麻醉。沿腹部正中线切口,逐层切开分离皮肤、肌肉、腹白线进入腹腔后,切除右侧肾脏(作为正常组大鼠肾组织),于结肠脾曲外侧切开后腹膜,暴露左侧肾脏,游离左输尿管和肾上腺避免损伤,再游离左肾蒂。稳定10min后将大鼠随机分成3组,每组15只,持续夹闭左肾动脉60min后恢复灌注。缺血-再灌注组(I/R组)恢复灌注后予以生理盐水[2ml/(d·只)]灌胃;γ-secretase抑制剂组(DAPT组)恢复灌注后予以γ-secretase抑制剂DAPT[500μg/(100 g/d)]灌胃;假手术组(Sham组)分离肾蒂但不夹闭左肾动脉,术后予以生理盐水[2ml/(d·只)]灌胃。3组在灌注后24、48和72 h各处死大鼠5只。
1.2.2 检测各组大鼠肾功能、血清TNF-α、IL-6水平 全自动生化仪检测大鼠肾功能,ELISA法检测各组大鼠血清TNF-α、IL-6水平。
1.2.3 各组大鼠肾脏病理改变 取左侧肾脏置于4%多聚甲醛磷酸缓冲液,将标本依次行固定、脱水、石蜡包埋、切片、脱蜡,HE染色,每张切片在高倍镜下取外髓质部10个视野,作半定量分析并计算均值[2]:无病变为0分;病变≤10%为1分;11%~25%为2分;26%~45%为3分;46%~75%为4分;病变>75%为5分。光学显微镜下(×20)观察各肾脏标本病理切片的形态改变,分析各组大鼠肾小管病理损伤程度。
1.2.4 激光共聚焦免疫荧光法检测各组大鼠肾组织Notch2、Hes-1、MCP-1蛋白的表达 冷冻切片95%固定,PBS冲洗,1%Triton透膜,羊血清工作液封闭,分别滴加Notch2多克隆抗体(1∶150)、Hes-1多克隆抗体(1∶150)、MCP-1多克隆抗体(1∶150),4℃孵育过夜,然后分别滴加FITC标记(绿色荧光)的山羊抗兔IgG(二抗,1∶500),50%缓冲甘油封片,激光共聚焦显微镜下观察并摄像。
1.2.5 W estern blot检 测 肾 组 织Notch2、H es-1、MCP-1蛋白的表达 取新鲜肾组织50~100mg提取总蛋白后,测蛋白浓度,经过SDS-聚丙烯酰胺凝胶电泳、转膜,Notch2多克隆抗体(1∶300)、Hes-1多克隆抗体(1∶300)、MCP-1多克隆抗体(1∶300)孵育过夜,辣根过氧化酶标记的羊抗兔IgG孵育(用含0.5%脱脂奶粉的TBET稀释1∶10 000),最后用化学发光得到胶片,蛋白条带用凝胶光密度分析软件测其OD值,用β-actin蛋白作为内参照,通过计算比值(OD目的蛋白/ODβ-actin蛋白),即目的蛋白的表达量来分析目的蛋白表达的相对水平,分析两组大鼠肾组织Notch2、Hes-1、MCP-1蛋白的表达。
1.3 统计学方法
采用SPSS 15.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,如方差齐,组间比较用方差分析及LSD多重比较;如方差不齐,则用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠尿素氮和血肌酐水平比较
生化结果显示,Sham组大鼠尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)水平无明显升高。而IR后大鼠肾功能明显受损,术后BUN、Scr水平升高,24h达到高峰,48和72h逐渐降低。与相同时间Sham组比较,24、48和72 h I/R组大鼠BUN、Scr水平升高,差异均有统计学意义(P<0.01)。经DAPT处理后,与相同时间I/R组比较,大鼠24、48和72 h BUN、Scr水平显著下降,差异均有统计学意义(P<0.01)。见表1、2。
表1 3组大鼠BUN水平比较 (n=5,mg/dl,±s)

表1 3组大鼠BUN水平比较 (n=5,mg/dl,±s)
注:1)与Sham组比较,P<0.01;2)与I/R组比较,P<0.01
组别 24 h 48 h 72 h Sham组 14.62±3.02 13.93±4.11 13.92±3.92 I/R组 50.44±6.621) 45.87±4.981) 31.77±6.001)t值 10.610 7.340 8.281 P值 0.000 0.000 0.000 DAPT组 46.03±5.112) 38.49±7.392) 25.13±6.482)t值 4.473 4.652 4.335 P值 0.002 0.001 0.005
表2 3组大鼠Scr水平比较 (n=5,mg/dl,±s)

表2 3组大鼠Scr水平比较 (n=5,mg/dl,±s)
注:1)与Sham组比较,P<0.01;2)与I/R组比较,P<0.01
组别 24 h 48 h 72 h Sham组 0.41±0.08 0.40±0.09 0.42±0.08 I/R组 3.91±0.361) 3.26±0.361) 2.32±0.261)t值 11.330 7.126 6.985 P值 0.000 0.000 0.000 DAPT组 3.33±0.282) 2.63±0.272) 1.70±0.322)t值 4.058 4.115 4.231 P值 0.005 0.003 0.002
2.2 大鼠肾脏病理改变
Sham组大鼠肾小球、肾小管间质均未见明显病变;I/R组大鼠肾小管病变以皮髓交界处最为明显,可见刷状缘丢失、基底膜裸露、小管扩张、管腔内管型形成、间质炎症细胞浸润及小管上皮细胞再生等病变。经DAPT处理后,肾小管结构较I/R组明显完整清晰,管腔内容物较I/R组减少,炎症细胞浸润较I/R组明显减轻。肾小管间质半定量评分显示,与相同时间Sham组比较,I/R组肾小管间质评分明显升高,差异均有统计学意义(P<0.01)。与相同时间I/R组比较,DAPT组大鼠肾小管间质评分明显降低,差异有统计学意义(P<0.01)。见图1和表3。
2.3 大鼠血清肿瘤坏死因子-α 和白介素-6表达比较
结果显示,肾IR诱导血清IL-6和TNF-α 水平显著升高,再灌注后24 h达最高峰,之后逐渐下降,但72h仍高于Sham组,与相同时间Sham组比较,差异有统计学意义(P<0.01);经DAPT处理后,与相同时间I/R组比较,大鼠血清IL-6和TNF-α 水平显著降低,差异有统计学意义(P<0.01)。见表4、5。
2.4 大鼠肾组织Notch2、Hes-1、MCP-1蛋白表达比较

图1 3组大鼠肾脏病理改变 (HE染色×20)
表3 3组大鼠肾小管间质半定量评分比较 (n=5,±s)

表3 3组大鼠肾小管间质半定量评分比较 (n=5,±s)
注:1)与Sham组比较,P<0.01;2)与I/R组比较,P<0.01
组别 24 h 48 h 72 h Sham组 0.38±0.16 0.36±0.24 0.32±0.13 I/R组 3.52±0.221) 2.70±0.231) 2.32±0.311)t值 12.053 8.659 7.085 P值 0.000 0.000 0.000 DAPT组 2.78±0.332) 1.90±0.212) 1.06±0.402)t值 4.121 4.132 5.231 P值 0.002 0.002 0.001
表4 3组大鼠血清IL-6水平比较 (n=5,pg/L,±s)

表4 3组大鼠血清IL-6水平比较 (n=5,pg/L,±s)
注:1)与Sham组比较,P<0.01;2)与I/R组比较,P<0.01
组别 24 h 48 h 72 h Sham组 782.23±99.19 739.84±152.42 754.65±107.71 I/R组 3 749.26±588.921) 3 000.87±381.761) 1 286.43±215.381)t值 15.067 13.613 8.257 P值 0.000 0.000 0.000 DAPT组 2 179.62±391.942) 1 735.47±422.352) 849.45±157.132)t值 8.144 7.562 4.835 P值 0.000 0.000 0.002
表5 3组大鼠血清TNF-α 水平比较 (n=5,pg/L,±s)

表5 3组大鼠血清TNF-α 水平比较 (n=5,pg/L,±s)
注:1)与Sham组比较,P<0.01;2)与I/R组比较,P<0.01
组别 24 h 48 h 72 h Sham组 112.92±47.95 108.21±36.63 113.56±39.58 I/R组 2 071.08±391.811) 1 758.44±158.051) 647.26±164.571)t值 12.053 8.659 7.085 P值 0.000 0.000 0.000 DAPT组 1 557.81±237.252) 1 155.25±262.832) 173.97±111.132)t值 4.121 4.132 5.231 P值 0.002 0.002 0.001
免疫激光共聚焦结果表明,Sham组大鼠肾小管未见Notch2阳性蛋白表达,可见少量的Hes-1和MCP-1阳性蛋白表达,肾IR后24 h可见肾小管大量的Notch2、Hes-1和MCP-1阳性蛋白表达,尤其以受损的远端肾小管荧光最强,48 h后荧光变弱,72 h仍可见阳性蛋白表达。DAPT处理24 h后,Notch2、Hes-1和MCP-1蛋白荧光均变弱,72 h仍可见少量的荧光。Western blot结果与免疫组织化学结果相似,但经DAPT处理72 h后,未见Notch2和Hes-1蛋白凝胶条带。与相同时间Sham组大鼠比较,I/R组大鼠24、48和72h的Notch2、Hes-1和MCP-1蛋白表达上调,差异有统计学意义(P<0.01)。与相同时间I/R组比较,DAPT组大鼠肾组织24、48和72 h的Notch2、Hes-1、MCP-1蛋白和Caspase-1 2蛋白表达下调,差异有统计学意义(P<0.01)。见图2~7和表6。

图2 两组大鼠肾组织Notch2蛋白的表达 (免疫激光共聚焦法×400)

图3 两组大鼠肾组织Hes-1蛋白的表达 (免疫激光共聚焦法×400)
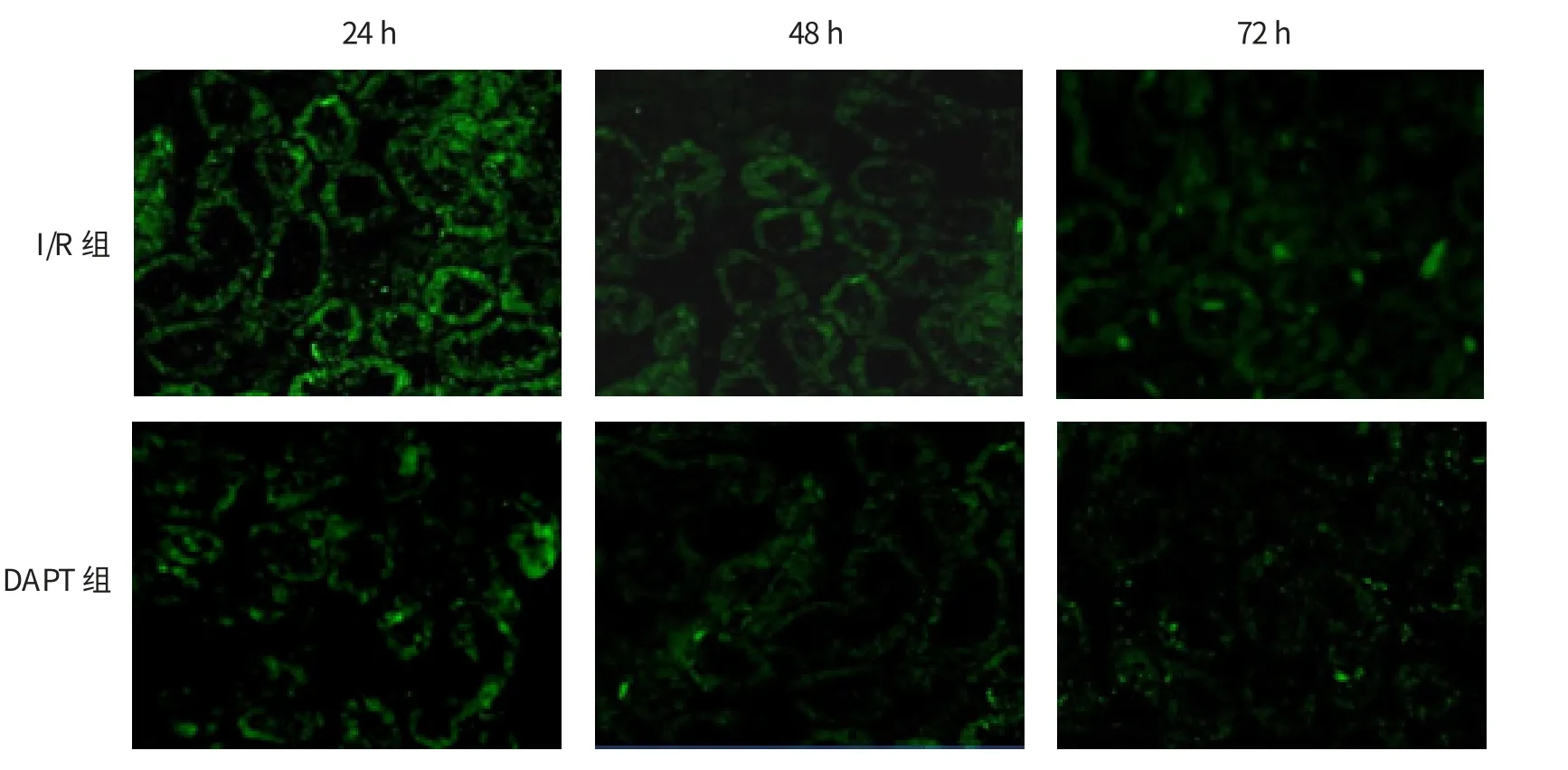
图4 两组大鼠肾组织MCP-1蛋白的表达 (免疫激光共聚焦法×400)

图5 3组大鼠肾组织Notch2、Hes-1和MCP-1蛋白表达(Western blot)

图6 3组大鼠肾组织中Hes-1蛋白的表达

图7 3组大鼠肾组织MCP-1蛋白的表达
表6 两组大鼠肾组织中Notch2蛋白表达的比较(n=5,±s)

表6 两组大鼠肾组织中Notch2蛋白表达的比较(n=5,±s)
注:†与DAPT组比较,P<0.01
组别 24 h 48 h I/R组 0.59±0.06 0.49±0.06 DAPT组 0.42±0.06† 0.40±0.05†t值 4.786 4.679 P值 0.002 0.002
3 讨论
Notch信号是一进化上高度保守的细胞间信号传导通路,作用广泛,可精确调节细胞的增生、分化、迁移、生长和死亡的过程,对个体的发育,尤其是三维结构器官的发育起决定性作用。其由一系列的蛋白分子家族组成,包括Notch受体、Notch配体、正负修饰分子以及转录因子[3-4]。Notch信号具有高度保守性,人和老鼠有4个Notch受体,即Notch1~4;Notch的配体在果蝇为Delta、Serrate,线虫为Lag-2。因此Notch的配体又被称为DSL蛋白[5]。Notch信号通路活化的关键是早老素依赖的γ-secretase(S3)裂开Notch受体的胞内段(notch intracellular domain,NICD),并释放NICD转位至细胞核,在细胞核与CSL蛋白相结合[5]。因此,笔者通过γ-secretase抑制剂DAPT阻断Notch信号后,观察下游转录分子的改变。
最近研究表明,Notch信号通路参与肿瘤的侵袭、转移[6],心肌细胞IRI[7],以及肝纤维化过程[8],而且通过影响核转录因子κB转录,调控TNF-α、IL-6、MCP-1等炎症因子表达增多,参与类风湿关节炎滑膜炎症的形成过程[9]。前期研究表明,肾IRI存在炎症过程,肾小管上皮细胞可以转化为炎症细胞[1]。有研究表明,肾IRI可以诱发Notch2/Hes-1信号通路重新活化,参与肾小管的再生过程[10]。那么,Notch2/Hes-1信号通路是否参与肾IRI诱发的炎症过程?
本研究结果显示,肾I/R后,肾小管可见刷状缘丢失、小管扩张、管腔内管型、间质炎症细胞浸润等肾小管坏死改变,肾小管间质半定量评分明显高于Sham组,提示模型建立成功。而经DAPT处理后,肾小管病理改善,半定量评分降低,表明DAPT可能具有良好的肾保护作用。
进一步研究发现,正常的肾组织无Notch2蛋白表达,仅见少量的Hes-1蛋白表达,与既往的文献报道一致[11]。然而IR诱导肾组织Notch2和Hes-1蛋白表达显著增多,提示肾IRI时肾小管上皮细胞Notch2/Hes-1信号通路被重新激活。本研究结果还发现,Notch2和Hes-1蛋白表达的高峰时间与TNF-α、IL-6和MCP-1表达一致,于再灌注后24 h达高峰,提示Notch2/Hes-1信号通路的活化可能参与肾IRI时肾小管上皮细胞TNF-α、IL-6和MCP-1的转录。笔者进一步研究发现,DAPT选择性地阻断Notch信号活化后,TNF-α、IL-6和MCP-1表达显著下调,表明活化的Notch2/Hes-1信号通路可能参与调控TNF-α、IL-6和MCP-1的转录。
目前,国内外尚未见Notch信号通路活化是否参与肾IRI相关炎症的报道,但较多研究表明,Notch信号通路的活化参与多种炎症病理过程,如KANG等[12]研究证实,Notch信号通路参与过敏性哮喘的炎症病理过程,γ-secretase抑制剂可通过调节Th1和Th2细胞的反应,抑制NF-κB信号活化,从而减轻过敏性哮喘的炎症反应。NAKAZAWA等[13-14]研究表明,类风湿关节炎滑膜细胞的Notch1信号表达增多,γ-secretase酶抑制剂可以抑制TNF-α 诱导的类风湿关节炎滑膜细胞增生,提示Notch信号通路可能参与类风湿关节炎的炎症过程。FERNANDEZ等[15]研究发现,在TNF-α 刺激下,骨髓的微环境表达Notch受体及配体增多。因此,笔者推测Notch信号通路的活化可能参与肾IRI相关的炎症过程。DAPT处理可降低血清BUN、Scr水平,改善肾小管间质损伤,提示DAPT具有良好的肾保护作用。进一步研究发现,DAPT可下调Notch2、Hes-1、TNF-α、IL-6、MCP-1的表达,提示DAPT的肾保护作用可能与一定程度地阻断Notch2/Hes-1信号通路活化后,继而抑制TNF-α、IL-6和MCP-1的转录,发挥抗炎作用有关。本研究从体内外证实Notch信号通路有望作为急性肾损伤治疗的新靶点。
[1]黄仁发,周巧玲,彭卫生,等.肾缺血-再灌注损伤后TNF-α、IL-6和MCP-1表达变化的意义[J].中国现代医学杂志,2012,22(21):13-17.
[2]NAKAGAWA T,ZHU H,MORISHIMA M,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-β[J].Nature,2000,403(5):98-103.
[3]NANTIE LB,HIMES AD,GETZ DR,et al.Notch signaling in postnatal pituitary expansion:proliferation,progenitors,and cell specification[J].Mol Endocrinol,2014,28(5):731-744.
[4]ILAGAN MX,KOPAN R.Snapshot:notch signaling pathway[J].Cell,2007,128(6):1246-1249.
[5]PERCO P,PLEBAN C,KAINZ A,et al.Gene expression and biomarkers in renal transplant ischemia reperfusion injury[J].Transpl Int,2007,20(1):2-11.
[6]裘铠杰,胡彦华,吴德全.Notch信号通路与肿瘤侵袭、转移的研究进展[J].胃肠病学和肝病学杂志,2014,23(11):1362-1364
[7]赵峻峰,祝骥,陈微,等.丹参酮ⅡA对缺血再灌注损伤的乳鼠心肌细胞Notch信号通路的影响[J].中国现代应用药学,2014,31(12):1435-1439
[8]黄颖而,许嘉彬,安海燕.Notch信号通路对肝纤维化EMT环节的影响[J].世界华人消化杂志,2014,22(30):4588-4592.
[9]秦亚录,刘天虎.Notch信号通路在风湿性心脏病炎症相关发病机制中的研究进展[J].心血管病学进展,2014,35(6):740-743.
[10]KOBAYASHI T,TERADA Y,KUWANA H,et al.Expression and function of the Delta-1/Notch-2/Hes-1 pathway during experimental acute kidney injury[J].Kidney International,2008,73(11):1240-1250.
[11]SCHWEISGUTH F.Notch signaling activity[J].Curr Biol,2004,14(3):129-138.
[12]KANG JH,KIM BS,UHM TG,et al.Gamma-secretase inhibitor reduces allergic pulmonary inflammation by modulating Th1 and Th2 responses[J].Am J Respir Crit Care Med,2009,179(10):875-882
[13]NAKAZAWA M,ISHII H,NAKAMURA H,et al.NF kappa B2 (p52)promoter activation via Notch signaling pathway in rheumatoid synoviocytes[J].Int JMol Med,2001,7(1):31-35.
[14]NAKAZAWA M,ISHII H,AONO H,et al.Role of Notch-1 intracellular domain in activation of rheumatoid synoviocytes[J].Arthritis Rheum,2001,44(7):1545-1554.
[15]FERNANDEZ L,RODRIGUEZ S,HUANG H,et al.Tumor necrosis factor-alpha and endothelial cells modulate notch signaling in the bone marrow microenvironment during inflammation[J].Exp Hematol,2008,36(5):545-558.

