伴t(8;22)(q24;q11)易位多发性骨髓瘤的研究报告附文献复习
史沛芹,朱学涛,汪海清,杨艳
(江苏省连云港市第一人民医院,江苏 连云港222000)
多发性骨髓瘤(multiple myeloma,MM)是一种以克隆性浆细胞恶性增殖和异常积聚为特征的血液系统恶性肿瘤,而细胞遗传学分析对恶性血液病的诊断、预后均有着重要的临床意义。大约30%~50%的MM患者可检出非整倍体异常,其中又以涉及14q32的易位为最多见,其次依次为13q14缺失,17p13缺失和染色体数目异常[1],而涉及t(8;22)(q24;q11)的MM在国内少见报道。本研究以1例t(8;22)(q24;q11)伴有1q三体的MM患者,对其进行了骨髓形态学、核型分析、中期荧光原位杂交(fluorescence in situ hybridization,FISH)、免疫分型及临床研究,并对相关文献进行了复习。现报告如下:
1 资料与方法
1.1 一般资料
患者 男,60岁,重度贫血伴呕吐、骨痛和骨质疏松症入院。查体:全身皮肤黏膜无黄染,浅表淋巴结未触及,腹平软,肝脾未触及,脊柱无畸形。无毒物、射线接触史。入院诊断为多发性骨髓瘤IgA ⅢB型。给予VAD方案化疗以及输血抗生素护肾保肝等对症支持治疗。
1.2 实验室检查
血常规:血红蛋白(hemoglobin,Hb)64 g/L,红细胞计数(red blood count,RBC)2.5×1012/L,白细胞计数(white blood count,WBC)5.18×109/L,血小板计数(platelt count,PLT)173×109/L。外周血分类:中性0.79,淋巴0.10,单核0.06。骨髓象:有核细胞增生明显活跃,浆系细胞明显增多,占有核细胞总数的68%;该类细胞分布不均,胞体较大,胞质强嗜碱性染蓝或深蓝色,可见细小空泡,核旁淡染区常消失;胞核呈类圆或不规则形,核染色质较细致,可见1~2个核仁。双核及多核浆细胞易见。见图1所示:粒系、红系细胞轻度受抑;淋巴、单核细胞大致正常。形态诊断为多发性骨髓瘤原浆细胞为主型。血沉:139 mm/h。血清蛋白电泳:球蛋白比例明显升高,出现异常M带;免疫球蛋白定量:IgA 31.3 g/L。C反应蛋白35.20mg/L。β2微球蛋白17.20mg/L。尿素氮28.53 mmol/L。肌酐707.32μmol/L。
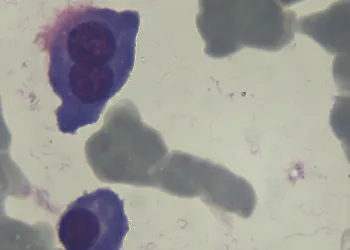
图1 骨髓象显示双核浆细胞
1.3 染色体核型分析
采用骨髓细胞直接法和不加植物血凝素的24 h培养法,按常规制备染色体并采用R显带技术进行核型分析。染色体异常按《人类细胞遗传学国际命名体制(ISCN2005)》[2]的有关规定加以识别和描述。
1.4 FISH方法
c-myc探针购自美国Vysis公司;具体步骤按说明书进行,用荧光显微镜观察中期细胞的荧光杂交信号,并应用染色体自动分析系统进行图像采集和分析。
1.5 流式细胞术检测
用流式细胞仪检测免疫表型。
2 结果
核型共分析了40中期分裂相,患者核型描述为51-53,XY,+del(1)(p11p34),+3,+6q+,+7,t(8;22)(q24;q11),+9,14q-,+18,+19[CP18]/46,XY[22],如 图2所示。异常克隆染色体数目51~53条不等,其结构异常除具有MM最常涉及的1、3、6、7、9、18和19染色体外,最令人注意的是t(8;22)(q24;q11)易位。荧光原位杂交结果显示可见3个绿色信号,表明c-myc基因发生断裂重排。见图3。免疫分型结果显示68.5%的异常细胞表达CD38和CD138。患者经VAD(长春新碱+阿霉素+地塞米松)方案3个月化疗后IgA 10.4 g/L,C反应蛋白<3.19mg/L,β2微球蛋白11.31mg/L。血红蛋白70 g/L,尿素氮15.53 mmol/L,肌酐268.4μmol/L。病情好转出院,6个月,1年后复查同。见附表。
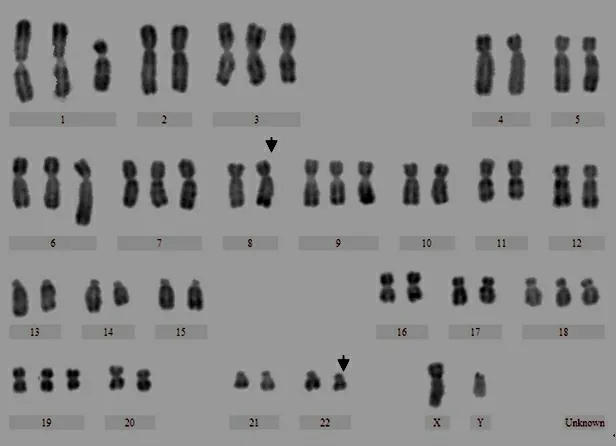
图2 骨髓细胞核型示53,XY,+del(1)(p11p34),+3,+6q+,+7,t(8;22)(q24;q11),+9,14q-,+18,+19
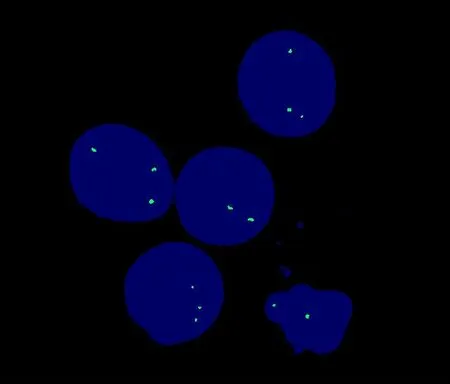
图3 应用c-m yc探针进行FISH检测结果显示c-m yc基因发生断裂重排

附表 伴有t(8;22)(q24;q11)MM的染色体异常核型
3 讨论
MM是骨髓内单一浆细胞克隆异常增生的一种恶性肿瘤,其特征是单克隆浆细胞恶性增殖并分泌过量的单克隆免疫球蛋白或其多肽链亚单位。本例患者骨髓增生明显活跃,浆细胞异常增多占68%,出现异常M蛋白,IgA增高、β2微球异常增高,CD38+和CD138+,肾功不全,结合染色体检查发现克隆性染色体异常。因此,可确诊为MM[3]。
MM的染色体异常多为复杂畸变,可同时涉及多条染色体的数目和结构异常。这些获得性的遗传学改变会使骨髓瘤细胞的生物学调控发生变化,继而出现MM的临床特征性改变[4]。MM的染色体异常包括染色体的数量与结构改变。根据染色体数量的改变将其主要划分为超二倍体组与非超二倍体组。其中超二倍体组多见于奇数染色体,如1、3、5、7、9、11、15、19和21号染色体的三体;非超二倍体则包括假二倍体、亚二倍体、近四倍体等等情况外,还包括染色体的缺失、扩增及易位改变,1q三体为最常见伴随异常[5]。
MM以涉及14q32的易位为最多见,最常见的 是t(11;14)(q13;q32)和t(8;14)(q24;q32),其14q32的IgH基因分别与11q13的CCND1和8q24的c-myc基因并置。而累及8q24的c-myc基因者多为伯杰特淋巴瘤或B细胞急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)[6]。c-myc基因产物为62 kD的磷酸化蛋白P62c-myc,由3个外显子两个启动因子P1和P2组成,P1和P2控制的c-myc基因的转录,P2启动被认为是最积极的推动者,启动子的选择取决于表达的myc水平上。c-myc基因的第1个外显子不编码,只起调节作用,只有外显子2和3共同编码的439个氨基酸组成的蛋白质,定位细胞核内,为核蛋白,具有转化细胞的能力,并具有与染色体、DNA结合的特性,在调节细胞生长、分化及恶性转化中发挥作用。t(8;14)(q24;q32)以后导致c-myc基因易位到IgH位点的高活性转录区,从而组成一个高转录活性的重排基因,启动c-myc转录,使c-myc表达增强,c-myc表达失调更具侵袭性,促进细胞恶变,最后导致肿瘤的发生。c-myc基因的其他少见的伴侣基因为Ig K、Igλ链的基因,位点分别在2p12和22q11,t(2;8)(p12;q24)(10-20%)和t(8;22)(q24;q11)(5%)[7]。本研究总结复习国内外报告的伴有t(8;22)(q24;q11)MM的染色体异常核型[8-12]。该类患者对常用化疗方案差,CR率35%,长期无病生存率0%~25%,预后恶劣。通过文献复习总结MM中异常克隆染色体数目多变,其结构异常14q32、16q22、22q11和8q24为最重要,而11q13、12q13、13q21、13q14和17p13为常见的二级结构异常,而3号染色体与MM IgA型及严重的肾脏损害有直接相关,可作为独立预后的依据[13]。另外,在MM中,8q24和22q11属于小片段易位,容易漏检,而1q自身的大片段复制则很容易发现。因此,如发现有1q重复或1q三体,应仔细观察8号染色体,以免漏检[14]。t(8;22)易位是单株前B细胞突变的一种表现,异常克隆的检出也证实疾病的恶性本质,有助于MM的早期诊断,治疗和预后判断,而对其基因重排易位的关键作用、与其他B细胞疾病的联系由于例数太少,尚需积累更多资料,进行更深入地研究。
染色体异常是目前针对MM遗传学检测最多、研究最广的项目,对疾病发生、发展以及预后起着重要作用[15],通过FISH可以检测到细胞分裂间期中特有的遗传学改变,常用于诊断与危险分层治疗的指标。
[1]薛永权.白血病细胞遗传学及图谱[M].天津:天津科学技术出版社,2003:74-77.
[2]SHAFFER LG,TOMMERUP N.An international system for human cytogenetic nomenclature[M].S Karger Basel,2005:1-130.
[3]张之南,沈悌.血液病诊断及疗效标准[M].第3版,北京:科学出版社,2007:232-235.
[4]PALUMBO A,ANDEMON K.Multiple myeloma[J].N Engl J Med,2011,364(17):1046-1060.
[5]GONZÁLEZ D,VAN DER BURG M,GARCÍA-SANZ R,et a1.Immunoglobulingene rearrangements and the pathogenesis of multiple myeloma[J].Blood,2007,110(9):3112-3121.
[6]谢晓燕,徐卫,仇海荣,等.伯杰特白血病的细胞遗传学研究[J].中华医学遗传学杂志,2008,25:214-217.
[7]史沛芹.一例伴有t(8,22)(q24,q11)易位的多发性骨髓瘤[J].中华血液学杂志,2013,34(12):1079.
[8]MOHAMED AN,BENTLEY G,BONNETT ML,et al.Chromosome aberrations in a series of 120 multiple myeloma cases with abnormal karyotypes[J].Am J Hematol,2007,82(12):1080-1087.
[9]CALASANZ MJ,CIGUDOSA JC,ODERO MD,et al.Cytogenetic analysis of 280 patients with multiple myeloma and related disorders:primary breakpoints and clinical correlations[J].Genes Chromosomes Cancer,1997,18(2):84-93.
[10]SÁEZ B,MARTÍN-SUBERO JI,LARGO C,et al.Identification of recurrent chromosomal breakpoints in multiple myeloma with complex karyotypes by combined G-banding,spectral karyotyping,and fluorescence in situ hybridization analyses[J].Cancer Genet Cytogenet,2006,169(2):143-149.
[11]GUTIÉRREZ NC,HERNÁNDEZ JM,GARCÍA JL,et al.Correlation between cytogenetic abnormalities and diseasecharactersieics in multiple myeloma:momosomy of chromosome 13 and structural abnormalities of 11q are associated with a highpercentage of S-phase plasma cells[J].Haematologica,2000,85(11):1146-1152.
[12]LLOVERAS E,GRANADA I,ZAMORA L,et al.Cytogenetic and fluorescence in situ hybridization studies in 60 patients with multiplemyeloma and plasma cell leukemia[J].Cancer Genet Cytogenet,2004,148(1):71-76.
[13]DUBINSKY R,AMICL A,MANOR Y,et al.Fluorescence In situ hybridization(FISH)for retrospective detection of trisomies 3 and 7 in multiple myeloma[J].Cancer Genet Cytogenet,1995,83(2):115-118.
[14]吴亚芳,薛永权,陈苏宁,等.9例伴有t(8,14)(q24,q32)和1q重复的B细胞肿瘤患者临床和实验研究[J].中华血液学杂志,2011,32(2):124-126.
[15]菅原,陈文明.多发性骨髓瘤的遗传学基础与危险分层白血病[J].淋巴瘤,2013,22(1):32-34.

