乳腺癌分子分型与临床病理特征和预后的关系
周兴,钱立庭
(安徽医科大学附属省立医院 肿瘤放疗科,安徽 合肥230000)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率与死亡率呈现明显上升趋势[1],乳腺癌的分子分型是近年来的研究热点,目前关于分子分型与预后的研究相对较少。本文回顾性分析了安徽省立医院肿瘤放疗科自2002年1月-2011年12月收治的改良根治术后的乳腺癌患者,对这些患者的分子分型、临床病理特征和预后进行分析。
1 资料与方法
1.1 临床资料
收集2002年1月-2011年12月的原发性乳腺癌改良根治术后女性患者162例,临床病理资料完整,中位年龄45岁(28~71岁),绝经前患者107例,绝经后患者55例。肿瘤最大径≤2 cm者31例,2~5 cm者121例,>5 cm者10例,按照2002年美国肿瘤研究联合委员会乳腺癌分期第六版进行病理分期。其中,Ⅰ期2例(1.2%),Ⅱ期51例(31.5%),Ⅲ期109例(67.3%)。病理类型:浸润性导管癌140例(86.4%),浸润性小叶癌9例(5.6%),浸润性小叶癌合并浸润性导管癌2例(1.2%),浸润性导管癌伴导管内癌2例(1.2%)、浸润性导管癌伴黏液腺癌2例(1.2%)、单纯癌、乳头状腺癌、神经内分泌癌、髓样癌、黏液腺癌、浸润性筛状癌和导管内癌各1例(0.62%)。162例患者中腋窝淋巴结阳性者155例,阳性率95.7%,其中N1(1~3枚淋巴结转)49例,N2(4~9枚淋巴结转移)61例,N3(≥10枚淋巴结转移)45例。
1.2 分子分型
按雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子2(human epidermal growth factor 2,HER-2)的免疫组化结果分为luminalA 型(ER 或PR+,HER2-)89例、luminalB型(ER或PR+,HER2+)37例、HER-2型(ER和PR-,HER2+)20例、basal-like型(ER-,PR-,HER2-)16例,各占54.90%、22.80%、12.30%和9.90%。
1.3 治疗与随访
本组患者全部行改良根治术,术前未接受任何抗肿瘤治疗,术后均辅以化疗及常规放射治疗,并根据免疫组化结果行内分泌治疗和(或)靶向治疗。生存时间从手术日期开始计算,随访截止2013年8月31日,14例失访,失访率8.64%,随访时间为5~139个月,中位随访时间为51个月。
1.4 统计学方法
采用SPSS 17.0软件进行统计学分析。单因素分析采用χ2检验及精确概率Fisher检验,多因素分析采用逐步COX回归分析,采用Log-rank检验比较各亚型患者的生存率,生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结果
2.1 不同分子分型的临床病理特征
本组患者不同分子分型的临床病理特征见表1。4种分子分型的平均发病年龄为(47.1700±10.0310)岁、平均大小为(3.4450±1.3247)cm,在以上两个方面及是否绝经,差异均无统计学意义(P=0.530、P=0.387和P=0.418),腋窝淋巴结转移数目分层方面的差异虽未显示有统计学意义(P=0.053),但在≥4枚阳性淋巴结患者中,luminalA型占69.6%、luminalB型62.1%、HER-2型80.0%和basal-like型31.3%,差异有统计学意义(P=0.014),HER-2型有较高水平的淋巴结转移数,basal-like型转移数最少。在Ⅲ期患者中,HER-2型比例最高,差异有统计学意义(P=0.026)。
2.2 不同分子分型的复发转移及生存情况
各分型的复发及生存情况比较见表2。至随访结束,29例患者出现复发转移,χ2检验显示差异无统计学意义(P=0.659),经Log-rank检验显示,各分型间的总生存率差异有统计学意义(P=0.035),统计分析显示4型间的无瘤生存差异无统计学意义(P=0.438),导致此结果的原因可能是不同分型间出现转移或复发后的生存时间段不同。不同分子分型的总生存曲线见图1,无瘤生存曲线见图2。luminalA型预后最好,复发转移率低,而basal-like型则有高复发转移率和低生存率。luminalA型、luminalB型、HER-2型与basal-like型的3年总生存率分别为97.30%、96.29%和88.89%、85.70%,5年总生存率为86.30%、76.47%、75.00%和57.10%,差异有统计学意义(P<0.05)。对luminal型与非luminal型的死亡率进行分析,未发现有统计学意义(P=0.052),对患者的年龄、肿瘤大小、是否绝经、腋窝淋巴结转移情况和分子分型等进行多因素预后分析,结果显示淋巴结转移情况及分子分型是影响预后的独立因素。见表3。

图1 不同分子分型的总生存曲线比较(P=0.035)
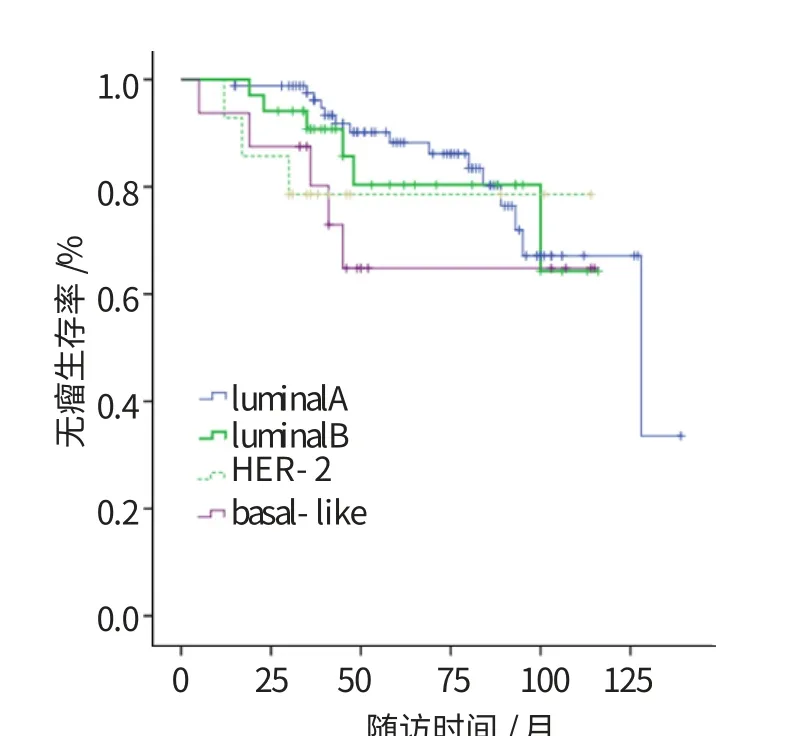
图2 不同分子分型的无瘤生存曲线比较(P=0.438)
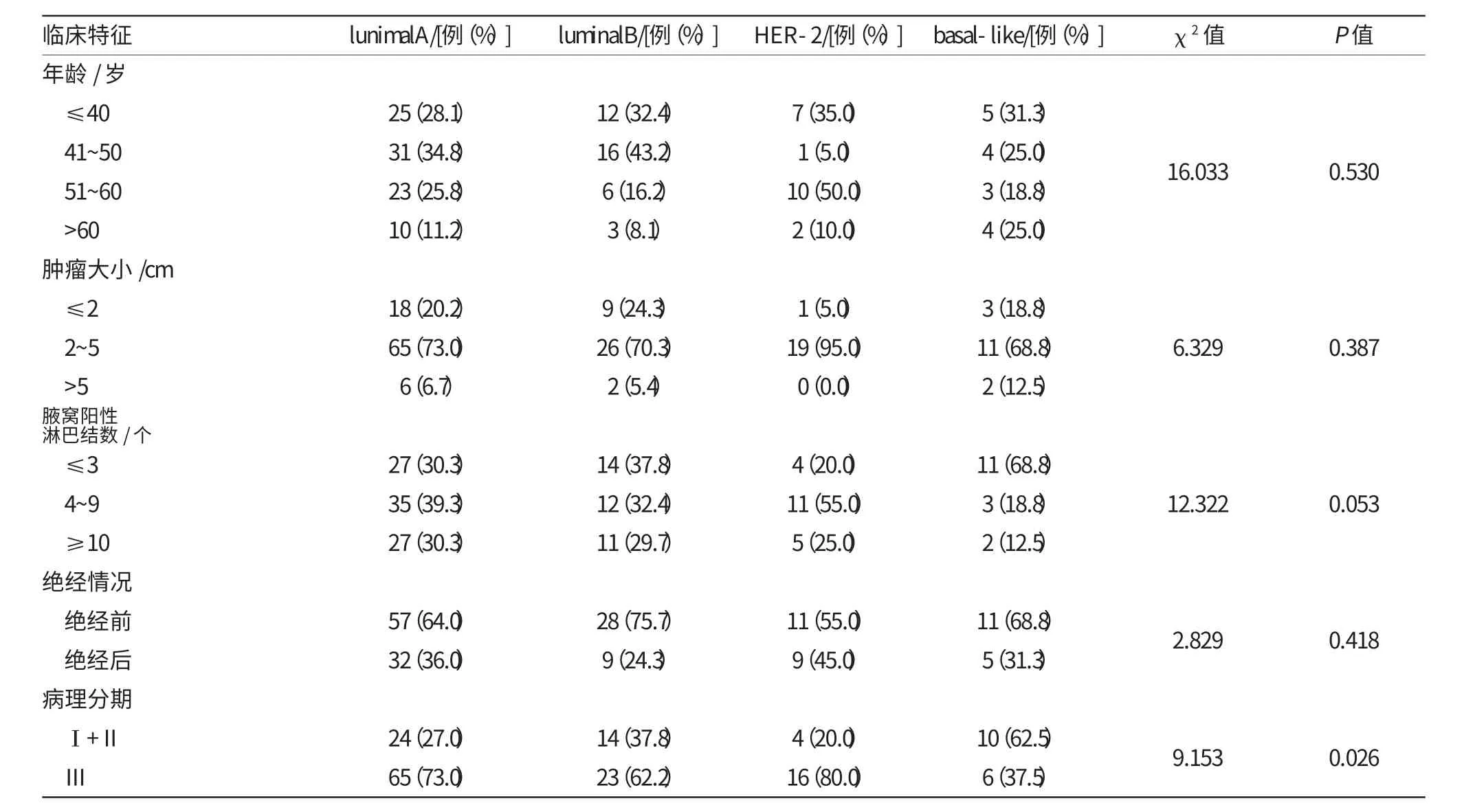
表1 不同分子亚型乳腺癌患者的临床病理特征
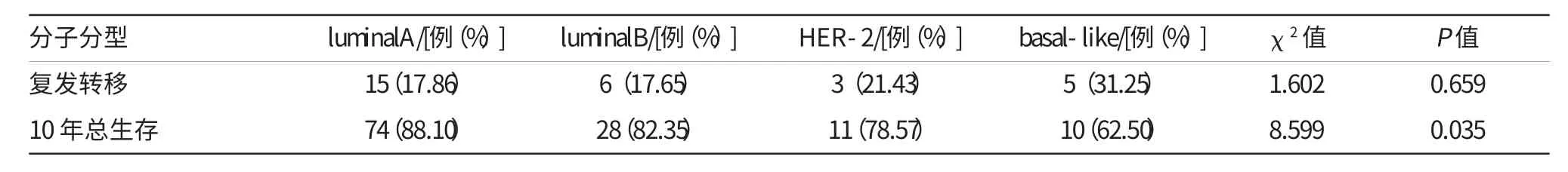
表2 不同分子亚型乳腺癌患者的复发及生存情况比较
3 讨论

表3 乳腺癌患者总生存时间的多因素分析
随着分子生物学技术的不断发展,肿瘤的诊断和治疗已进入分子时代。PEROU和SORLIE及其同事[2-3]提出根据乳腺癌基因表达的不同,将乳腺癌分为luminalA型、luminalB型、HER-2型、basal-like型和normal-like型,自此,研究者开始ER、PR和HER-2等的表达情况作为组合来看待,为认识乳腺癌这一异质性疾病提供了新的出发点。但由于费用昂贵、操作复杂,甚至检测标准不一致等原因,基因检测尚未能在临床上得以普及。目前,最常用的是根据ER、PR和HER-2的免疫组化结果把乳腺癌简易分为4类,即luminalA型(ER或PR+,HER2-)、luminalB型(ER或PR+,HER2+)、HER-2型(ER和PR-,HER2+)和basal-like型(ER-,PR-,HER2-),本研究也据此对162例乳腺癌患者进行了简易分型分析。
有关不同分子分型的乳腺癌所占比例,不同研究的结果存在一定差异。IHEMELANDU[4]等对372例美国的非洲后裔乳腺癌患者进行了研究,其中,luminal A 型 占55.40%,luminal B 型11.80%,basal-like型21.20%,HER-2型11.60%。国内的有关研究中,曹华等[5]对510例乳腺癌患者的研究显示luminal A型占56.86%,luminal B型占9.02%,basal-like型占30.59%,HER-2型占3.53%。各研究都一致认为luminalA型是乳腺癌各分型中的最常见的,多数研究[4-10]显示该型比例集中在50.00%~62.00%之间。本研究中luminalA型占54.90%,与上述几项研究结果有一致性,luminalB型、basal-like型和HER-2型分别占22.80%、9.90%和12.30%。目前关于basal-like型与HER-2型所占比例,不同的研究结果差异较大[5,8-9,11],此差异可能由于研究对象基因背景、研究方法不同等导致。本研究中luminalB型比例高于上述几项研究,可能由于本研究对于IHC检测为HER-2(++)的部分患者未做荧光原位杂交(fluorescence in situ hybridization,FISH)检测,参考有关文献[12-13]将其按阳性处理有关。
不同分子分型有不同的临床病理特征。本研究中未发现4种分型间在平均发病年龄及平均大小方面的差异有统计学意义,与杨钱[11]对1 153例乳腺癌患者的分析结果有一致性,而IHEMELANDU[4]的研究却显示不同分子分型的平均发病年龄差异有统计学意义(P=0.001),同时还认为各型的发病时间呈双峰特点,其中,basal-like型的双峰时间早于其他3型,luminalA与luminalB型首末峰时间都较晚。本研究未发现各型发病的双峰特点,basal-like型的发病高峰年龄相对较早,出现于40岁以下年龄段,不同分子分型中≤40岁的患者比例最高的为HER-2型(35.00%),luminalA型最低(28.10%),提示年轻患者预后并非最好。关于不同分型的淋巴结转移情况,目前多数研究都认为不同分子分型间淋巴结转移情况存在明显差异,但具体哪一种分子分型的淋巴结转率较高,各研究的结果并不一致。IHEMELANDU[4]的研究认为basal-like型的转移率最高,也有研究[7]认为HER-2型的淋巴结转移率高于其他分型,而且认为basal-like型具有较少的淋巴结转移,魏志敏[8]的研究也认为basal-like型在淋巴结转移方面与其他类型无明显差别,主要是通过血行转移发生远处转移。本研究中也显示,≥4枚阳性淋巴结患者中,不同分型间的差异有统计学意义,其中HER-2型比例最高(80.00%),basal-like型最低(31.30%)。因此认为,basal-like型并非主要由淋巴道发生转移。腋窝淋巴结转移情况是公认的影响乳腺癌患者长期生存的重要因素,本研究显示HER-2型的转移率较高,但HER-2型生存率并非最低,与其较多的淋巴结转移并不一致,据此可猜想分子分型与淋巴结转移数可能属于不同的影响乳腺癌患者预后的系统,两者可能是基因差异在相互独立的层面的不同表现形式,都是对肿瘤的生物学特征的反映。
不同分子分型生存预后的讨论。不同分子分型的预后差异有统计学意义,各研究均认为luminal型预后最好,关于预后最差的分型,各研究的结论并不一致。IHEMELANDU[4]对4型患者平均生存期进行了分析,认为basal-like和HER-2过表达型预后最差,luminal型最好,袁中玉[10]的研究也显示luminal型的预后最好,预后最差的为HER-2型。本研究的结果显示,luminal型的生存率最高,basal-like型最低,这与当前认为basal-like型预后最差的观点一致,有研究[14]认为HER-2型预后最差,可引起放疗抵抗,容易出现复发和转移,导致较差的预后,但本研究中患者都接受了术后常规放射治疗,而HER-2型并非预后最差的类型,与此观点并不一致。本研究样本量较少,结果可能有一定局限性,大样本、长时间的随访研究可能有进一步的发现。此外,多因素预后分析发现,乳腺癌患者预后与淋巴结转移及分子分型有关,分子分型对临床的治疗有重要的指导意义。
综上所述,乳腺癌不同的分子分型有不同的临床病理及预后特征,HER-2显示较差的临床病理特点,但basal-like型预后较差,张晓辉的研究也发现了临床病理特点与预后存在不一致的[9]。由于本研究为回顾性研究,未对患者的具体化疗方案制定统一的纳入标准,对生存率的分析的可能有一定影响,但本研究从一定程度上分析了不同分子分型的乳腺癌生物学特点,分子分型可与临床病理特征相结合,综合指导乳腺癌的个体化治疗和预后评估。
[1]李连弟,鲁凤珠,张思维,等.中国恶性肿瘤死亡率20年变化趋势和近期预测分析[J].中华肿瘤杂志,1997,19(1):3-9.
[2]PEROU CM,SORLIE T,EISEN MB,et al.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[3]SORLIE T,PEROU CM,TIBSHIRANI R,et al.Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications[J].Proc Natl Acad Sci USA,2001,98(19):10869-10874.
[4]IHEMELANDU CU,LEFFALL LD,DEWITTY RL,et al.Molecular breast cancer subtypes in premenopausal and postmenopausal African-American women:age-specific prevalence and survival[J].J Surg Res,2007,143(1):109-118.
[5]曹华,闫茂生,郑涛,等.乳腺癌分子分型的临床意义[J].中华乳腺病杂志:电子版,2011,5(6):670-680.
[6]ZHAO J,LIU H,WANG M,et al.Characteristics and prognosis for molecular breast cancer subtypes in Chinese women[J].Surg Oncology,2009,100(2):89-94.
[7]PARK S,KOO JS,KIM MS,et al.Characteristics and outcomes according to molecular subtypes of breast cancer as classified by a panel of four biomarkers using immunohistochemistry[J].Breast,2012,21(1):50-57.
[8]魏志敏,谷海燕,赵洁,等.乳腺癌的分子分型与临床病理特征的关系[J].癌症进展,2010,8(6):622-625.
[9]张晓辉,孙强,周易冬,等.腋窝淋巴结转移乳腺癌患者的分子分型与临床病理特征和预后的关系[J].肿瘤,2013,33(3):271-275.
[10]袁中玉,王树森,朱美琴,等.不同分子亚型乳腺癌的临床特征和预后[J].中华肿瘤杂志,2008,30(6):456-461.
[11]杨钱,陈洁,李宏江,等.不同分子亚型乳腺癌的临床病理特征及预后分析[J].中华肿瘤杂志,2010,33(1):42-46.
[12]温戈,张玉晶,祝喻甲,等.分子分型对1~3个腋窝淋巴结转移早期乳腺癌患者局部或区域复发风险的预测价值[J].中华放射肿瘤学杂志,2013,22(2):89-93.
[13]王淑莲,李晔雄,宋永文,等.激素受体和人表皮生长因子受体2的表达与改良根治术后淋巴结阳性乳腺癌患者预后的关系[J].中华肿瘤杂志,2010,32(7):520-525.
[14]DI LEO A,CHAN S,PACSMANS M,et al.HER-2/neu as a predictive marker in a population of advanced breast cancer patients random ly treated either with single-agent doxorubicin or single-agent docetaxed[J].Breast Cancer Retreat,2004,86(3):197-199.

