氯胺酮、人参皂苷Rg-1和氯化锂逆转电休克后抑郁大鼠认知障碍的机制研究*
童珊珊,刘超
(1重庆市江津区中心医院 麻醉科,重庆402260;2天津市胸科医院 麻醉科,天津300222)
电休克(electmconrulsive therapy,ECT)是在安全范围内让电流通过大脑,通过引起意识丧失与电抽搐,是重度抑郁患者的首选治疗。ECT时间超过120~180 s可造成认知障碍,其原因与病理性的Glu信号系统功能异常有关,其可引起氧化应激,导致海马长时程增强作用(long-term potentiation,LTP)饱和状态,造成突触可塑性障碍,无法接收新的信息,导致认知障碍。
Tau蛋白即低分子微管相关蛋白,分布于神经元的轴突和树突,为不对称磷蛋白,促进轴突微管的装配和稳定,保持微管间距离,影响神经细胞轴突的物质运输,促进神经元生长发育,抑制脂质过氧化,抑制微管蛋白聚集,与认知密切相关。Tau蛋白磷酸化是调节神经元功能的主要手段,其被异常磷酸化后发生错误折叠和分子聚集[1],可削弱其稳定微管的功能,造成递质运输、储存和释放障碍,导致认知障碍[2]。
氯胺酮(ketamine hydrochloride)作用于中枢神经系统。兴奋性氨基酸在脑缺氧、缺血时对神经元的兴奋性毒性作用是造成脑损伤的主要机制之一。氯胺酮可直接减少脑内兴奋性氨基酸递质的释放[3],从而减轻ECT导致的抑郁大鼠认知障碍[4]。Rg-1是人参的主要成分之一,研究证明其有中枢神经系统的保护作用[5],可易化认知的获得、巩固和再现,但其透过血脑屏障的能力很弱。锂可通过诱导GSK-3β在Ser9位点的磷酸化水平增加而发挥其对糖原合成 酶 激 酶-3β (glycogen synthase kinase-3β,GSK-3β)的抑制作用[6],进而抑制细胞Tau蛋白磷酸化。
那么,ECT引起的Glu升高是否通过上调Tau蛋白的过度磷酸化而造成认知障碍,以及氯胺酮、Rg-1或氯化锂是否可以阻止这一过程成为研究焦点。本研究通过观察氯胺酮、Rg-1和氯化锂对ECT后嗅球切除抑郁模型大鼠认知、海马内Glu浓度以及Tau蛋白过度磷酸化的影响,比较三者相关机制的异同。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 盐酸氯胺酮纯度标准物质(产品编号GBW09207,纯度>99.5%,北京谱朋科技有限公司);Rg-1单体(Rg-1,纯度>98%,芜湖甙而塔医疗科技有限公司);氯化锂(lithium,纯度>97%,上海实验试剂有限公司);纯品L-谷氨酸(L-Glutamic acid,美国Sigma公司);兔抗人p-AT8Ser202单克隆抗体(美国Gene Tex公司);小鼠抗牛Tau5单克隆抗体(美国Millipore公司);Harvard啮齿类动物ECT仪(美国自然基因有限公司);莫瑞斯水迷宫(morris water maze,MWM)视频分析系统(北京军事医学科学院);HPLC色谱系统(美国Waters公司);蛋白电泳系统(美国Bio-Rad公司);金盘多媒体图像处理系统(成都金盘电子科大多媒体技术有限公司)。
1.1.2 实验动物 备选24周健康雄性SD(Sprague-Dawley)大鼠,体重250~300 g,由天津医科大学实验动物科学部提供。适应性饲养1周后,建立大鼠嗅球切除抑郁模型[7]:2.75%戊巴比妥钠(55mg/kg,2ml/kg)腹腔注射,正中缝两侧旁开2mm距前囟前7~8mm处,钻两个直径2mm孔,用探针破坏嗅球并吸出。青霉素(20万u/ml)冲洗切口,连续3 d肌肉注射青霉素4万u。2周后行旷场实验(Open field test)。旷场实验又称敞箱实验,是以实验动物在新奇环境之中活跃行为的发生频率和持续时间评估实验动物抑郁程度的方法。单位时间内动物某一肢体越过的格子数为水平得分,后肢站立次数为垂直得分。测试均于上午9∶00开始,取旷场内水平得分及垂直得分总和在30~120 s间的64只大鼠(此为评定为中度抑郁的实验大鼠,即造模成功的实验大鼠)。
1.2 方法
1.2.1 动物实验原则 《实验动物处理原则》和《实验动物使用和处理指南》。
1.2.2 实验动物分组原则 采用随机单位组析因设计分组原则:将每只大鼠视为1个单位,对每个单位予两个处理因素,即ECT干预(2水平:无处置、1疗程ECT)和药物干预(4水平:海马CA1区微量注射生理盐水、氯胺酮、Rg-1和氯化锂)的所有组合。
1.2.3 实验动物干预措施 将造模成功的64只大鼠随机分为8组(n=8):I组(海马CA1区微量注射1μl氯胺酮纯品20μg+1个疗程ECT);II组(海马CA1区微量注射1μl Rg-1 20μg+1个疗程ECT);III组(海马CA1区微量注射1μl氯化锂20μg+1个疗程ECT);IV组(海马CA1区微量注射1μl生理盐水+1个疗程ECT);V组(海马CA1区微量注射1μl氯胺酮纯品,20μg);VI组(海马CA1区微量注射1μl Rg-1 20μg);VII组(海马CA1区微量注射1μl氯化锂20μg);VIII组(海马CA1区微量注射1μl生理盐水)。
1.2.4 脑立体定位及海马微量注射 大鼠麻醉后,以前囟点(Bregma)为坐标原点,向海马处(AP-3.8 mm,RL+/-2.5mm,V 2.5mm)植入一直径0.9mm带内芯的不锈钢套管,用磷酸水门汀固定,外层用牙托粉加固,实验中采用微量进样器通过埋植套管给注射药品。
1.2.5 ECT处置 每次施行ECT前15min注射每组相应药物,于大鼠双颞侧安放电极,行ECT,予方波(单个正弦半波20ms,50 Hz),电流50mA,持续1 s,引起大鼠强直阵挛抽搐发作为成功,隔天1次,共7次,于9∶00 am开始。不施行ECT的组在同样时间以同样剂量注射相应药物。
1.2.6 MWM 视频分析系统检测大鼠的空间认知
ECT疗程结束24 h内行MWM检测。MWM内水加墨汁,将平台置I象限水下2 cm。实验9∶00 am~3∶00 pm进行,水温(24±1)℃。Morris 1.0软件跟踪记录并分析数据。第1~6天行定位航行实验:按逆时针方向分别从4个象限将大鼠面向池壁置水中,观察并计时120 s,将平台置I象限正中水下2 cm。记录大鼠寻找并爬上平台的时间为逃避潜伏期(escape latency,EL),若120 s内未找到平台,则引导其至平台,停留30 s,逃避潜伏期记为120 s。检测结束后以第1~6天逃避潜伏期的平均值为学习成绩。第7天空间行探索实验:撤平台,将大鼠从III象限面向池壁置水中,记录大鼠在60 s内各象限游泳时间,以原I象限游泳时间即空间探索时间(space exploration time,SET)为记忆成绩。
1.2.7 取材 在MWM测试结束后24 h内取海马,左侧海马用锡箔纸标记包裹后置于液氮中过夜,-80℃超低温冰箱保存,备做免疫印迹(Western blot,WB);右侧海马称重,加入1ml甲醇-水离心液,低温匀浆,取部分匀浆液4℃,10 000×g,离心15min,取上清,滤膜过滤后-80℃保存待测Glu含量(以μg/g计)。
1.2.8 高效液相色谱法(high performance liquid chromatography,HPLC)检测Glu浓度 取海马匀浆上清液;调整色谱条件为18-ODS色谱柱柱温35℃,流动相A为0.1mol/L醋酸钾,流动相B为甲醇,行二元梯度洗脱,流动相经0.45m微孔滤膜过滤,超声脱气,流速1.0ml/min,激发波长250 nm,发射波长410 nm,以Glu峰面积定量;建立Glu标准曲线;测定Glu含量。
1.2.9 WB法检测p-AT8Ser202和Tau-5的表达 取左侧海马匀浆,提取蛋白,测定蛋白浓度,调节蛋白浓度一致。取等量蛋白样品稀释,煮沸5min;另用1×SDS加样缓冲液溶解预染蛋白质分子量标准混合物,煮沸3min。标本15μl上样(甘油醛-3-磷酸脱氢酶为蛋白质上样标定),SDS-PAGE电泳至预染蛋白质分子量标准示目的分子量出现为止,湿法转膜,脱脂奶粉封闭,加抗体[兔抗人p-AT8Ser202单克隆抗体或小鼠抗牛Tau-5单克隆抗体(1︰200)]4℃孵育过夜,辣根酶标记IgG(1︰200)37℃孵育2 h,DAB显色,金盘多媒体图像处理系统测阳性条带积分吸光度值。
1.3 统计学方法
2 结果
2.1 实验大鼠的MWM成绩
ECT可延长EL(F=119.82,P=0.011)缩短SET(F=99.93,P=0.010)。氯胺酮单独使用亦可造成认知障碍,而ECT和氯胺酮合用后认知障碍反而减轻;Rg-1和氯化锂单独使用对认知无影响,但与ECT合用则改善ECT后的认知(EL:F=56.41,P=0.009;SET:F=37.71,P=0.004)。ECT与药物有交互作 用(EL:F=62.00,P=0.001;SET:F=63.36,P=0.001)。见表1和2。
2.2 HPLC法检测G lu的浓度
ECT可明显增加海马中Glu的浓度(F=273.15,P=0.003)。氯胺酮和Rg-1在ECT前后均可减少海马Glu(ECT前:F=10.15,P=0.008;ECT后:F=35.00,P=0.012)(总效应:F=67.95,P=0.003);且ECT干预与氯胺酮和Rg-1有交互作用(F=33.01,P=0.015)。氯化锂对海马中Glu的浓度无明显影响。见表3。
2.3 WB法检测Tau蛋白的表达
ECT和氯胺酮、Rg-1和氯化锂对总Tau蛋白(即Tau-5蛋白) 表达无影响:(ECT:F=1.87,P=0.322;实验药物:F=0.21,P=0.907);ECT和实验药物剂无交互效应(F=0.07,P=0.934)。ECT可增加磷酸化p-AT8Ser202的表达(F=11.13,P=0.024);而氯胺酮、Rg-1和氯化锂可减少p-AT8Ser202的表达(F=21.29,P=0.015);氯胺酮、Rg-1和氯化锂减缓磷酸化Tau蛋白增加幅度(F=12.43,P=0.040)。见附图、表4和5。
表1 MWM成绩:EL(s,n=8,±s)
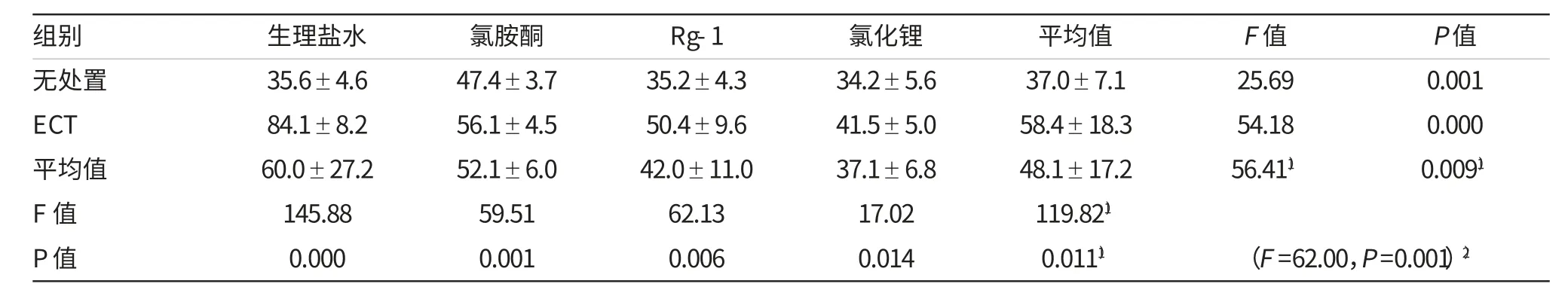
表1 MWM成绩:EL(s,n=8,±s)
注:1)主效应的F统计量和P值;2)交互效应的F统计量和P值
组别 生理盐水 氯化锂 平均值 F值 P值无处置 35.6±4.6 34.2±5.6 37.0±7.1 25.69 0.001 ECT 84.1±8.2 41.5±5.0 58.4±18.3 54.18 0.000氯胺酮 Rg-1 47.4±3.7 35.2±4.3 56.1±4.5 50.4±9.6平均值 60.0±27.2 37.1±6.8 48.1±17.2 56.411) 0.0091)52.1±6.0 42.0±11.0 F值 145.88 17.02 119.821)P值 0.000 0.014 0.0111) (F=62.00,P=0.001)2)59.51 62.13 0.001 0.006
表2 MWM成绩:SET(s,n=8,±s)

表2 MWM成绩:SET(s,n=8,±s)
注:1)主效应的F统计量和P值;2)交互效应的F统计量和P值
组别 生理盐水 氯化锂 平均值 F值 P值无处置 31.0±6.1 30.2±5.0 25.9±8.9 40.05 0.000 ECT 11.0±1.6 21.3±3.0 17.0±5.0 39.66 0.000氯胺酮 Rg-1 12.0±1.7 32.9±4.7 15.7±2.0 18.8±1.4平均值 20.0±9.6 26.0±5.8 21.8±8.5 37.711) 0.0041)13.8±3.2 25.8±8.2 F值 83.33 15.97 99.931)P值 0.000 0.008 0.0101) (F=63.36,P=0.001)2)22.08 56.69 0.000 0.000
表3 G lu在海马中的浓度(HPLC法) (μmol/gprot,n=8,±s)

表3 G lu在海马中的浓度(HPLC法) (μmol/gprot,n=8,±s)
注:1)主效应的F统计量和P值;2)交互效应的F统计量和P值
组别 生理盐水 氯化锂 平均值 F值 P值无处置 48.9±7.9 46.2±8.0 42.3±8.3 10.15 0.008 ECT 177.8±35.7 170.4±37.0 150.0±40.0 35.00 0.012氯胺酮 Rg-1 39.9±8.6 37.5±6.0 135.3±30.0 114.0±24.1平均值 112.5±73.6 112.9±71.7 100.1±62.1 67.951) 0.0031)90.2±53.8 78.5±42.7 F值 98.95 90.12 273.151)P值 0.000 0.000 0.0031) (F=33.01,P=0.015)2)115.13 55.21 0.000 0.000

表4 Tau-5蛋白的表达(WB,积分吸光度值) (n=8)

表5 p-AT8Ser202蛋白的表达(WB,积分吸光度值) (n=8)
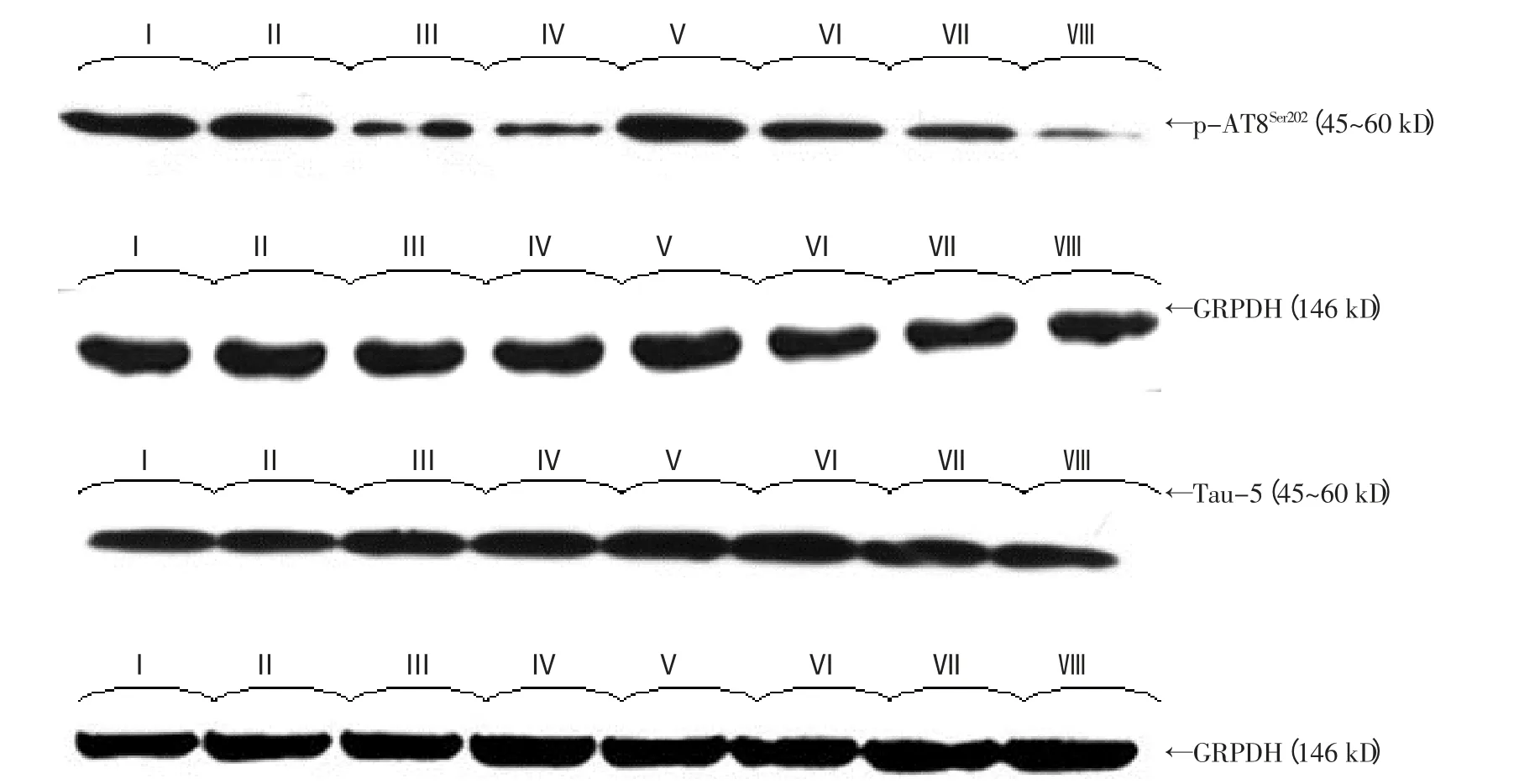
附图 p-AT8Ser202和Tau-5的表达(WB) (n=8)
3 讨论
海马CA1区和齿状回在大鼠空间长时记忆形成中具重要作用[8]。本实验发现ECT导致的认知障碍伴发Glu在海马内浓度明显升高,验证了过高浓度的Glu可诱发兴奋性毒性,使神经元受损,导致认知障碍,与以往实验结果一致。同时,本实验结果也将ECT导致认知障碍的副作用与Glu的过高浓度联系起来,揭示了其神经机制。
本实验发现p-AT8Ser202位点磷酸化程度与ECT关系密切,而且与相关研究结果一致[2]。本实验中观察到ECT后Glu在神经元中的浓度明显升高的同时海马内磷酸化Tau蛋白p-AT8Ser202表达均上调,与武凤英等[9]发现应激可激活兴奋性神经传递系统诱导海马Tau蛋白过磷酸化的研究结果一致;亦与TAN等[10]发现低体温可以诱发Tau蛋白过度磷酸化的结果一致。
本实验发现氯胺酮单独使用会导致认知功能减退,但与ECT时合用则可明显减轻ECT后的认知障碍,这两点与既往研究一致。而且,实验发现氯胺酮可以减少海马中Glu的浓度,尤其以ECT后为甚,此点或与氯胺酮改善ECT后认知功能相关。推测其机制,氯胺酮属于非竞争性N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)受体拮抗剂,与NMDA受体通道复合物的苯环己哌啶调节位点结合,通过变构调节来干扰兴奋性氨基酸与NMDA受体的正常结合,减轻NMDA受体过度激活所致的氧自由基损伤作用。氯胺酮还可通过阻断已开放通道及降低通道开放频率而阻滞NMDA受体,临床剂量的氯胺酮有明显的脑保护作用,可提高暴露在30mmol/L NMDA培养液中的大鼠皮质神经元细胞的存活率。本研究与LOO等的研究的结论一致,LOO认为氯胺酮能够减轻ECT后的认知功能障碍,尤其在ECT后的一周之内效果明显[11]。
本实验发现Rg-1和氯化锂单独短期内应用对认知没有明显影响,但与ECT合用则可明显逆转ECT后的认知能力。在三种实验药物中,氯化锂改善应激后认知的效果最为明显。探究其机制,发现无论行ECT与否,氯胺酮和Rg-1均可减少海马中Glu浓度;而氯化锂对Glu浓度似无明显影响。但三种药物都能降低ECT前后的Tau蛋白磷酸化程度,且这一过程与改善ECT后认知能力密切相关,这一结论与以往的实验一致。同时,本实验发现氯胺酮、Rg-1和氯化锂对ECT前后的总Tau蛋白表达似无明显影响。
综上所述,可知三种药物作用机制的不同,氯胺酮、Rg-1可减少Glu的浓度、拮抗其兴奋性毒性,逆转Tau蛋白的过度磷酸化;氯化锂可拮抗Glu兴奋性毒性,逆转Tau蛋白的过度磷酸化。
[1]BRISTER MA,PANDEY AK,BIELSKA AA,et al.OGlcNAcylation and phosphorylation have opposing structural effects in Tau:phosphothreonine induces particular conformational order[J].J Am Chem Soc,2014,136(10):3803-3816.
[2]KOPEIKINA KJ,CARLSON GA,PITSTICK R,et al.Tau accumulation causes mitochondrial distribution deficits in neurons in a mouse model of tauopathy and in human Alzheimer's disease brain[J].Am J Pathol,2011,179(4):2071-2082.
[3]O'CONNOR RM,PUSCEDDU MM,DINAN TG,et al.Impact of early-life stress,on group III mGlu receptor levels in the rat hippocampus:effects of ketamine,electroconvulsive shock therapy and fluoxetine treatment[J].Neuropharmacology,2013,66:236-241.
[4]CATENA-DELL'OSSO M,FAGIOLINI A,ROTELLA F,et al.Glutamate system as target for development of novel antidepressants[J].CNS Spectr,2013,18(4):188-198.
[5]FANG F,CHEN X,HUANG T,et al.Multi-faced neuroprotective effects of Ginsenoside Rg1 in an Alzheimer mouse model[J].Biochim Biophys Acta,2011,1822(2):286-292.
[6]XIA Y,RAO J,YAO A,et al.Lithium exacerbates hepatic ischemia/reperfusion injury by inhibiting GSK-3β/NF-κB-mediated protective signaling in mice[J].Eur J Pharmacol,2012,697(1-3):117-125.
[7]SMAGA I,POMIEMY B,KRZYZANOWSKA W,et al.N-acetylcysteine possesses antidepressant-like activity through reduction of oxidative stress:behavioral and biochemical analyses in rats[J].Prog Neuropsychopharmacol Biol Psychiatry, 2012, 39(2):280-287.
[8]PREISSMANN D,BERTHOLET L,SIERRO G,et al.Accurate performance of a rat model of schizophrenia in the water maze depends on visual cue availability and stability:a distortion in cognitive mapping abilities[J].Behav Brain Res,2011,223(1):145-153.
[9]WU FY,FENG Q,CHENG M,et al.The activation of excitatory amino acid receptors is involved in tau phosphorylation induced by cold water stress[J].Prog Biochem Biophys,2010,37(5):510-516.
[10]TAN W,CAO X,WANG J,et a1.Tau hyperphosphorylation is associated with memory impairment after exposure to 1.5%isoflurane without temperature maintenance in rats[J].Eur J Anaesthesiol,2010,27(9):835-841.
[11]LOO CK,KATALINIC N,GARFIELD JB,et al.Neuropsychological and mood effects of ketamine in electroconvulsive therapy:a randomised controlled trial[J].J Affect Disord,2012,142(1-3):233-240.

