腰椎植骨融合内固定术中植骨粒体积对术后融合效果的影响
郝建学,周斐,王明昊,张建鹏,任康,邸丽萍,陈美青,刘锁利,万建设
(1.河北省保定市第一医院 骨外科,河北 保定071000;2.承德医学院 研究生院,河北 承德067000;3.河北省保定市第一医院 妇产科,河北 保定071000)
脊柱椎弓根钉内固定配合植骨融合及椎间融合器(posterior interbody cage,简称Cage)初期固定坚强,而被广泛用于治疗腰椎间盘突出症、椎管狭窄症等腰椎退行性疾病。其目的是恢复腰椎正常排列、解除神经压迫和重建脊柱稳定性。有文献报道后路内固定椎间植骨融合术(posterior lumbar interbody fusion,PLIF)在生物力学和临床上具有明显优势[1],但目前临床上对于术中放置Cage后,植骨粒体积的选择不同学者有不同看法,国内学者对于此类研究报道尚不多见。本研究对行椎弓根钉棒系统内固定配合Cage植骨融合术的患者,按照术中椎间植骨粒体积的不同进行分组,并对其临床疗效进行对比,研究植骨粒体积对术后融合效果的影响。报道如下:
1 临床资料
1.1 一般资料
随访自2010年6月-2012年6月在河北省保定市第一医院行椎弓根钉棒系统内固定配合Cage植骨融合术的病例82例,按照患者手术顺序将患者分为三组,术中分别植入不同体积的植骨粒,其中A组28例,植骨粒体积平均为0.20 cm3;B组27例,植骨粒体积平均为0.10 cm3;C组27例,植骨粒体积平均为0.05 cm3。三组患者性别、年龄、病程、病变节段等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 手术方法
所有患者均采用全身麻醉,患者取俯卧位,常规消毒铺无菌巾,C型臂X线透视引导下确定手术间隙,以手术间隙为中心取后正中入路切口约5 cm,依次切开皮肤、皮下组织,保留棘上棘间韧带,剥离双侧椎旁肌显露双侧椎板及关节突,行患侧部分椎板切除减压,咬除黄韧带,显露硬脊膜、神经根,神经根拉钩将硬膜囊及神经根拉向内侧,显露椎间盘和后纵韧带,摘除突出的腰椎间盘组织,探查减压狭窄的侧隐窝、神经根管,充分松解受压粘连的神经根。使用槽刀扩大椎间隙,刮除该间隙椎间盘及软骨终板,直至骨性终板。将切除的椎板骨质按分组不同咬成大小不等的骨粒,部分用植骨器直接植入椎间隙,其余用于填满相应型号的单枚椎间融合器并斜形敲入椎间隙。椎弓根钉内固定,双极电凝充分止血,生理盐水冲洗伤口,放置引流,依次缝合。术后24~48 h拔除引流管,第2天行腰椎X线片检查,以确认手术情况。术后3~4天鼓励患者配戴支具坐起并下地活动。术后2周拆线出院,定期随访。
1.3 观测指标
1.3.1 植骨粒体积及椎间植骨量总体积的测量 所有病历术中植骨粒修剪及体积测量均由同一术者完成。测量方法:骨粒修剪时尽量使每颗骨粒的大小一致,将修剪好的骨粒放入一容量为10ml的量筒内,以1ml为单位依次加入生理盐水,直至生理盐水完全淹没骨粒,此时量筒内溶液的读数减去加入生理盐水的体积即为骨粒的总体积,总体积除以粒数即为每个骨粒的平均体积。
1.3.2 临床评估 手术前后分别采用疼痛视觉模拟评分(visual analogue score,VAS)评估下腰痛及双下肢疼痛症状,Oswestry功能障碍指数(oswestry dability index,ODI)评估功能恢复情况。
1.3.3 影像学评估 随访时摄腰椎正侧位X线片,将侧位X线片投照位上同一椎体的左、右下关节突影像重合,以减少因旋转造成的误差。测量手术节段椎间隙前、中、后高度后取均值,并以上位椎体横径作为参考以避免放大误差。
1.4 统计学方法
采用SPSS18.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用方差分析,两两比较采用SNK检验;计数资料组间比较采用秩和检验或χ2检验;检验水准α=0.05。
2 结果
2.1 植骨粒体积、椎间植骨总体积及Cage高度测量
术后患者切口均Ⅰ期愈合,无早期并发症发生。患者均获随访,随访时间24~48月,平均35个月。
A组平均值骨粒体积为(0.21±0.07)cm3,椎间植骨总体积为(6.7±1.2)cm3,Cage高度为(10.7±1.0)mm;B组平均值骨粒体积为(0.12±0.06)cm3,椎间植骨总体积为(6.9±1.8)cm3,Cage高度为(10.1±0.9)mm;C组平均值骨粒体积为(0.05±0.03)cm3,椎间植骨总体积为(6.8±1.4)cm3,Cage高度为(10.4±0.9)mm。各组植骨粒体积比较,差异均有统计学意义(P<0.05);椎间植骨总体积及Cage高度比较,差异均无统计学意义(P>0.05)。
2.2 临床评估
术前各组均行下腰痛、双下肢疼痛VAS评分及ODI评分,各组之间比较,差异均无统计学意义(P>0.05)。末次随访时,各组3个指标均较术前显著降低(P<0.05)但组间两两比较差异均无统计学意义(P>0.05),见表1。
2.3 影像学评估
术后1年复查X线片显示,A组植骨融合22例(78.6%),B组植骨融合24例(88.9%),C组植骨融合18例(66.7%);术后2年A组植骨融合23例(82.1%),B组植骨融合25例(92.6%),C组植骨融合19例(70.4%)。B组植骨融合率均显著高于A、C组,A组高于C组,组间比较差异均有统计学意义(P<0.05),见附图。
表1 手术前后各组下腰痛VAS评分、双下肢疼痛VAS评分及ODI评分比较 (±s)
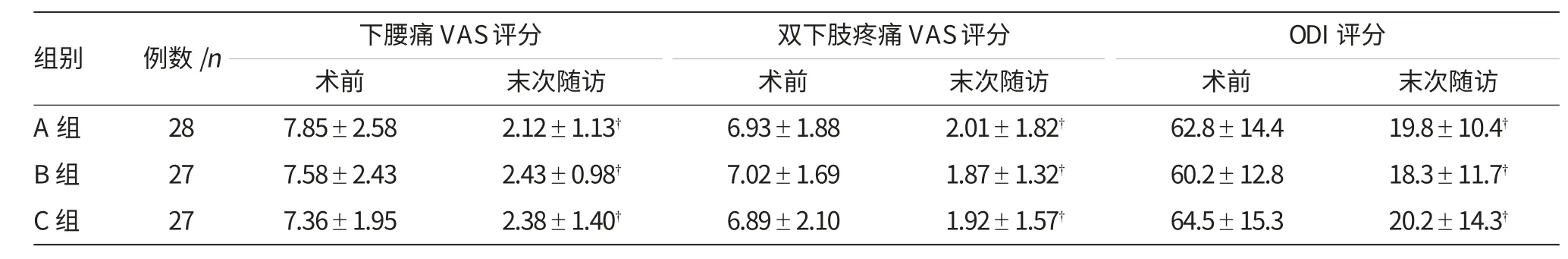
表1 手术前后各组下腰痛VAS评分、双下肢疼痛VAS评分及ODI评分比较 (±s)
注:†与术前比较,P<0.05
组别 例数/n 双下肢疼痛VAS评分 ODI评分术前 术前 末次随访A组 28 6.93±1.88 2.01±1.82† 62.8±14.4 19.8±10.4†下腰痛VAS评分术前7.85±2.58 2.12±1.13†末次随访 末次随访B组 27 7.02±1.69 1.87±1.32† 60.2±12.8 18.3±11.7†7.58±2.43 2.43±0.98†C组 27 6.89±2.10 1.92±1.57† 64.5±15.3 20.2±14.3†7.36±1.95 2.38±1.40†
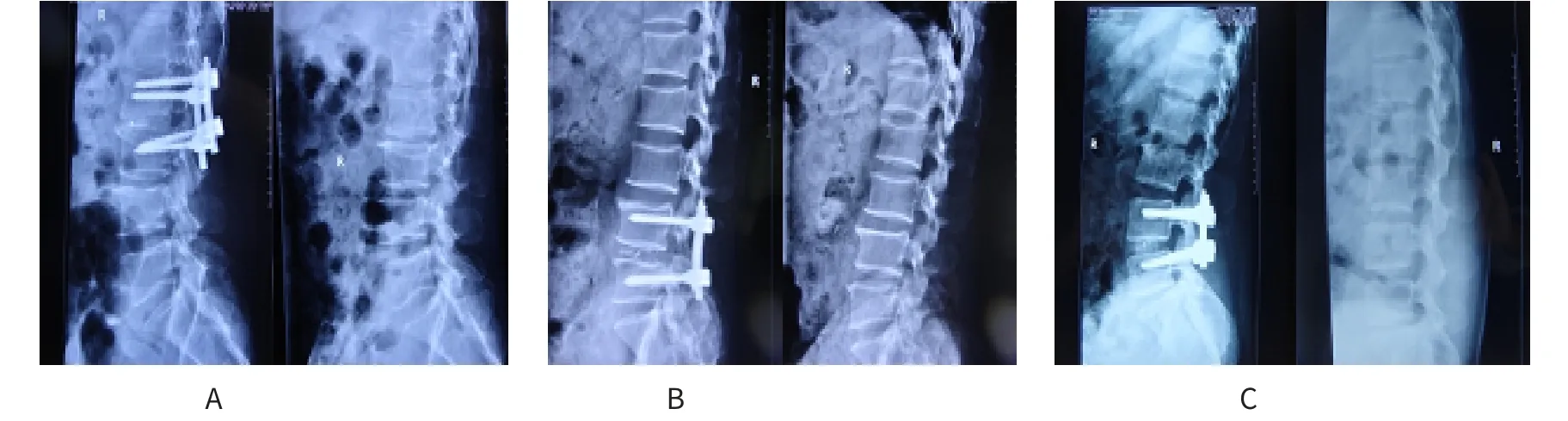
附图 各组术前及术后2年影像学变化
如表2所示,各组术后及末次随访时椎间隙高度与术前相比均有显著提高,差异有统计学意义(P<0.05);与术后即刻比较,末次随访时A、B、C组椎间隙高度变化分别为(8.7±1.7)mm、(10.1±1.8)mm、(8.8±1.7)mm,B组显著小于A、C组,差异有统计学意义(P<0.05);A、C组间差异无统计学意义(P>0.05)。
表2 手术前后各组椎间隙高度比较 (±s)

表2 手术前后各组椎间隙高度比较 (±s)
注:1)与术前比较,P<0.05,2)与A组比较,P<0.05;3)与B组比较,P<0.05
组别 例数/n 术前/mm 术后即刻/mm 末次随访/mm A组 28 7.7±1.8 11.1±1.71) 8.7±1.71)3)B组 27 7.4±1.9 10.7±1.41) 10.1±1.81)2)C组 27 7.8±2.1 11.4±1.51) 8.8±1.71)2)3)
3 讨论
经后路行脊柱椎弓根钉内固定配合Cage支撑植骨融合术治疗腰椎间盘突出症、椎管狭窄症等腰椎退行性疾病由于其初期固定坚强而被广泛应用。其目的是为了恢复腰椎正常排列、解除神经压迫和重建脊柱稳定性[2]。本组病例中,术后末次随访大部分融合,未出现假关节形成、内固定松脱或折断等并发症。良好的植骨床准备及植骨块的质与量是椎间融合的重要条件,本研究发现植骨粒体积的大小对于术后患者症状的改善没有明显差异,但中等体积的植骨粒术后融合率明显高于较小或较大的植骨粒体积,在术后椎间高度的丢失方面,中等体积的植骨粒也有明显优势。
腰椎后路椎弓根钉内固定配合Cage支撑植骨融合术中,植骨粒多为松质骨,在承受较大力量时容易发生塌陷[3],在植骨前期炎性反应及后期骨痂改建和重塑过程中,成骨细胞在发挥形成连接骨痂作用的同时,破骨细胞会对坏死骨及应力轴线以外的骨组织起吸收作用[4-5]。本组病例中,植入骨粒较大时,骨粒相互累积产生较多的空隙,其相互挤压造成骨小梁的断裂,这种自身网架结构的破坏会导致植入骨的破坏吸收大于改建重塑,不利于术后初期的稳定及椎间的融合。HA等[6]通过CT扫描发现椎间隙内植骨粒体积会随时间延长发生丢失。本组病例中各组术后即刻的椎间高度与末次随访相比均有不同程度的丢失,进一步证实了以上观点。
而较小体积的植骨粒在制取过程中,由于骨板结构破坏较多,无形中延长了骨粒之间、骨粒与终板之间形成纤维连接的时间,故修复重建过程较慢。术后由于腰椎活动,产生骨-骨界面微动,不利于骨小梁的重建与修复[7],较慢的修复过程又加剧了骨-骨界面的微动,从而形成了恶性循环[8]。相对于体积较小的植骨粒,大块的植骨粒由于自身骨小梁结构丰富,并有一定的连续性及完整性,所以在形成纤维连接及骨痂连接方面更具有优势。
综上所述,本组病例中采用不同植骨粒体积在术后患者症状改善方面没有明显差异,但中等体积植骨粒(0.10 cm3/粒)术后影像学评价效果良好,明显提高了术后椎间融合率,减小了椎间隙高度丢失,对腰椎后路椎弓根钉内固定配合Cage支撑植骨融合术有一定指导意义。
[1]FLOMAN Y,MILLGRAM MA,ASHKENAZI E.Instrumented slip reduction and fusion for painful unstable isthmic spondylolisthesis in adults[J].J Spinal Disord Tech,2008,21(7):477-483.
[2]李兴华,翟明玉,吴卫新,等.椎问融合器在腰椎滑脱症手术治疗中的应用[J].中国骨与关节损伤杂志,2005,20(6):373-375.
[3]LEE CK,VESSA P,LEE JK.Chronic disabling low back pain syndrome caused by internal disc derangements.The results of disc excision and posterior lumbar interbody fusion[J].J Spinal Disord Tech,1995,20(3):356-361.
[4]STROHM PC,KUBOSCH DC,SPRECHER CM,et al.Graft integration in the lumbar spine of bovine cancellous bone compared to autologous iliac crest in a sheep model[J].Z Orthop Unfall,2010,148(6):666-673.
[5]TOGAWA D,BAUER TW,BRANTIGAN JW,et al.Bone graft incorporation in radiographically successful human intervertebral body fusion cages[J].J Spinal Disord Tech,2001,26(24):2744-2750.
[6]HA KY,LEE JS,KIM KW.Bone graft volumetric changes and clinical outcomes after instrumented lumbar or lumbosacral fusion:a prospective cohort study with a five-year follow-up[J].J Spinal Disord Tech,2009,34(16):1663-1668.
[7]王荣茂,林翔,石树培,等.后路椎体间自体髂骨融合与Cage融合治疗下腰椎不稳的比较研究[J].中国修复重建外科杂志,2008,22(8):928-932.
[8]姚声,李祖兵.自体骨移植重建下颌骨中坚强内固定技术的应用效果评估[J].中国修复重建外科杂志,2005,19(10):796-798.

