不同分期糖尿病视网膜病变泪液TNF-α 的表达*
张洁,王伟超,王虹,刘素波,李雅婷
(1.石家庄市第三医院 眼科,河北 石家庄050011;2.石家庄市第一医院 内分泌科,河北 石家庄050011;3.石家庄市第一医院 干部老年病科,河北 石家庄050011;4.石家庄市第七医院 健康检查科,河北 石家庄050031)
近年来,糖尿病已成为排在心脑血管疾病和肿瘤之后的第三位影响人类健康的主要疾病。糖尿病引起的糖尿病性视网膜病变作为糖尿病的主要并发症之一,为致盲的主要原因[1],随着糖尿病病程进展,发病率逐渐增高,病程10年以上发病率增至60%~90%[2],严重地影响了糖尿病患者的生存质量。有关2型糖尿病的病因与发病机制的探讨中,糖尿病炎症发病学说备受关注并得到认同,认为糖尿病是一种自然免疫和低度炎症性疾病,炎症因子引起的血管内皮炎症反应在糖尿病尤其是血管病变的发生、发展中具有重要作用,多种炎症因子参与了糖尿病视网膜的微血管病变[3]。其中肿瘤坏死因子(tumor necrosis factorα,TNF-α)是糖尿病微血管病变发展过程中起着重要作用的炎症因子[4-5]。本试验采用酶联免疫吸附试验(ELISA试验)对泪液、血清TNF-α 的浓度进行了测定,探讨其与糖尿病及不同分期糖尿病性视网膜病变发生的关系,为临床糖尿病病情监测提供可能的新方法。
1 资料与方法
1.1 仪器与试剂
LXJ-11型离心机(上海医用仪器厂);酶标仪(法国Jouan公司);超低温冰箱(法国Jouan公司);TNF-α ELISA试剂盒(美国TBE公司),灵敏度>0.5 pg/ml。
1.2 试验方法
1.2.1 病例选择 正常对照组(NC组)50例,男25例,女25例,平均年龄63.1岁。均为健康志愿者,无眼病史,无糖尿病家族史,无药物过敏史、服用糖皮质激素及类似药物史;2型糖尿病无糖尿病视网膜病变组(NDR组)50例,男25例,女25例,平均年龄65.4岁。经检眼镜和眼底血管荧光造影排除糖尿病视网膜病变;单纯性糖尿病视网膜病变组(DR组)50例,男27例,女23例,平均年龄65.7岁,经检眼镜和眼底血管荧光造影确诊为单纯性糖尿病视网膜病变;增殖性糖尿病视网膜病变组(PDR组)50例,男24例,女26例,平均年龄66.8岁,经检眼镜和眼底血管荧光造影确诊为增生性糖尿病视网膜病变。NDR组、DR组、PDR组均符合1999年WHO《2型糖尿病诊断标准》,患者起病年龄均>30岁,无酮症发生,口服降糖药有效,胰岛自身抗体阴性,均无心、肺、肾、肝脏疾病,
以上四组人群的年龄、性别比例均相匹配。
1.2.2 标本采集 征求以上四组研究对象知情同意后分别采集其泪液和血液,采集过程均由同一人在相同条件下完成:受试者禁食、停药8~10 h,检查者动作轻柔,轻拉被检者下睑结膜并微后压,以毛细玻璃管轻置于穹窿结膜与球结膜交界处,使泪液引流入毛细玻璃管,分别收集左、右眼泪液,每例受试者所取泪液样本量为20μl,转移至同一微量离心管,于超低温冰箱-20℃保存备用;完成泪液采集后抽取研究对象静脉血3ml,采用离心机分离血清,超低温冰箱-20℃冻存以备集中检测。
1.2.3 泪液、血清TNF-α 浓度测定 采用酶联免疫吸附试验(ELISA)测定人泪液、血清中TNF-α 的含量,严格按试剂盒说明进行操作。在ELISA检测仪上,于450 nm处,以空白对照孔调零后测各孔OD值。以标准品浓度为横坐标,以OD值为纵坐标,用平滑线连接各标准品的坐标点,绘制标准曲线,通过标本的OD值在标准曲线上查出其浓度。
1.3 统计学分析
所有数据采用SPSS 17.0统计软件进行统计分析。计量资料以均数±标准差(±s)表示,分别对泪液、血清TNF-α 浓度进行单因素方差分析,若组间不同或不完全相同,再进一步做SNK-q检验比较各组间差别。并对泪液、血清TNF-α 水平作相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α在泪液中的含量
对NC组、NDR组、DR组、PDR组的各组数据进行单因素方差分析,其F=129.636,表明各组间不同或不完全相同,再进一步做SNK-q检验比较各组间差别,结果表明:NDR组、DR组、PDR组泪液TNF-α 含量均较NC组高,差异有统计学意义(P<0.01);DR组、PDR组泪液TNF-α 含量较NDR组高,差异有统计学意义(P<0.01);PDR组泪液TNF-α 含量较DR组高,差异有统计学意义(P<0.05)。如附表所示。
2.2 TNF-α 在血清中的含量
对NC组、NDR组、DR组、PDR组的各组数据进行单因素方差分析,其F=59.067,表明各组间不同或不完全相同,再进一步做SNK-q检验比较各组间差异,结果表明:NDR组、DR组、PDR组血清TNF-α 含量均较NC组高,差异有统计学意义(P<0.01);DR组、PDR组血清TNF-α 含量较NDR组高,差异有统计学意义(P<0.01);PDR组血清TNFα 含量较DR组高,差异有统计学意义(P<0.01)。如附表所示。
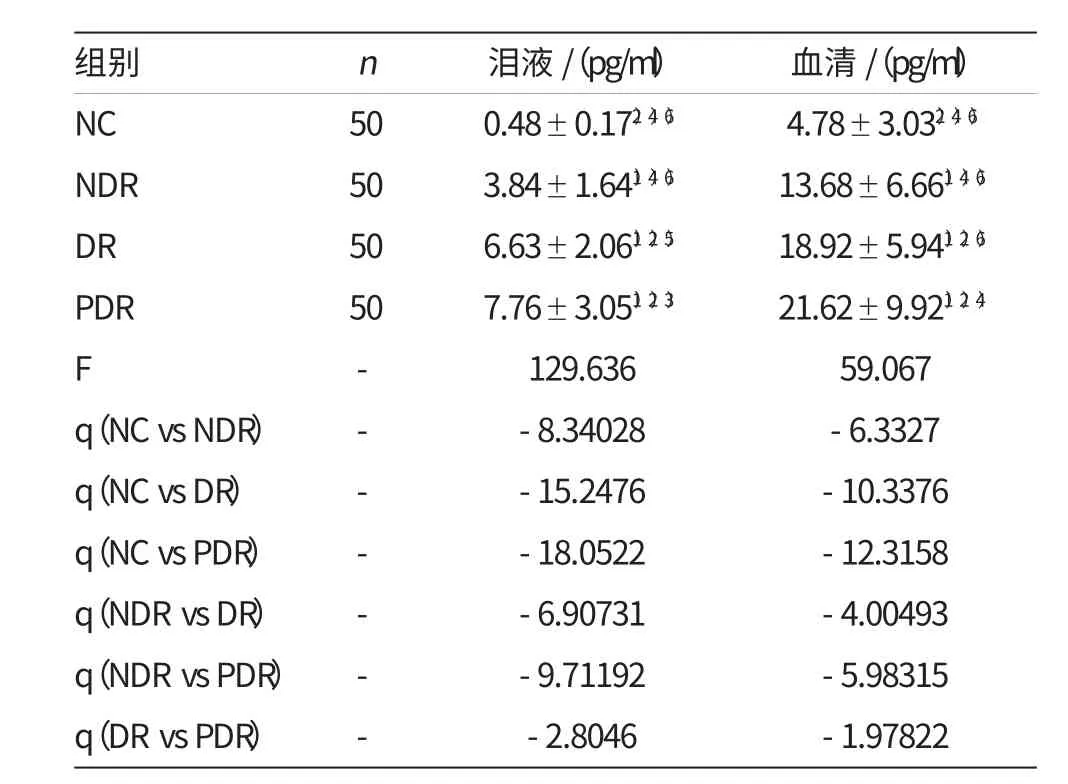
附表 泪液、血清中TNF-α 的含量
2.3 泪液TNF-α 与血清TNF-α 的相关分析
泪液与血液中的TNF-α 相关性关系为:r=0.751,P<0.05,95%可信区间为(0.31123,0.92586)。
3 讨论
糖尿病可以引起多种并发症,做为微血管并发症之一的视网膜病变在发展中国家是导致成年人致盲的首要原因,其中黄斑水肿和增殖性视网膜病变是引起视力降低的主要原因,影响了12%的1型糖尿病患者和28%的2型糖尿病患者[6]。糖尿病炎症发病学说认为,在糖尿病尤其是血管病变的发生、发展过程中,炎症因子引起的血管内皮炎症反应起到重要作用。这一学说备受关注并得到普遍认同,而其中的炎症细胞因子TNF-α,在参与2型糖尿病及其血管并发症的发生、发展过程中的作用不容忽视。
TNF-α 主要由激活的单核细胞、巨噬细胞分泌,血管内皮细胞、肾小管上皮细胞也可合成,参与多种生理免疫过程,是具有多种生物活性的细胞因子[7],有抗肿瘤、促进细胞生长、诱导细胞分化凋亡、影响糖脂代谢、诱导多种细胞因子产生等生物功能。TNF-α 基因启动子多态性和糖尿病的发生密切相关,大量证据表明TNF-α 参与胰岛素抵抗的形成,与β 细胞分泌胰岛素的关系密切[8],在胰岛素抵抗发病机制中起着重要作用,并且与糖尿病微血管病变关系密切。TNF-α 可抑制胰岛素信号转导通路中胰岛素受体底物-1酪氨酸磷酸化,促进脂肪分解,使游离脂肪酸增多,诱导并加重了胰岛素抵抗,促进糖尿病及其并发症的发生发展。TNF-α 水平增高引起胰岛素抵抗可引起视网膜微血管内皮细胞的病理性增生,与亚临床炎症共同作用,引起糖尿病视网膜病变。有研究显示[9-10],血清TNF-α 水平与糖尿病视网膜病变严重程度有显著关联。TNF-α可直接损伤血-视网膜屏障,通过核因子途径的激活刺激人视网膜血管内皮细胞引起明显的细胞间黏附分子和血管细胞黏附分子的表达,提高视网膜血管通透性;可刺激巨噬细胞及其他细胞产生IL-8等,增强视网膜局部炎症反应,JOUSSEN等[11]认为TNF-α 在糖尿病视网膜病变早期的发生机制中发挥了重要的作用,其中部分归功于其促炎活性。有研究发现糖尿病可以诱发小鼠泪腺结构和分泌发生显著改变,糖尿病小鼠的泪腺重量和泪膜容量均较对照组低,而泪液中白介素1b和肿瘤坏死因子的浓度均较对照组高。TNF-α 可以提高视网膜血管通透性,从而刺激血管外基质过量产生和血管细胞的增殖,最终导致眼内新生血管形成。RIFAT等[12]通过对糖尿病性视网膜病变行玻璃体切除术的患者的研究,检测其玻璃体样品中TNF-α 的水平,研究结果显示糖尿病性视网膜病变患者玻璃体样本中TNF-α 水平明显高于对照组患者,由此他们推断:在视网膜新生血管形成中起重要作用的TNF-α 其浓度在糖尿病性视网膜病变患者玻璃体样本中明显升高。
通过对国内外相关研究的调查表明,有关对糖尿病、糖尿病微血管病变患者血清中的TNF-α 水平研究较多,其研究发现血清TNF-α 作为重要的炎症介质,在糖尿病及其微血管并发症患者中明显升高。本研究对正常人(NC组)、2型糖尿病尚无视网膜病变患者(NDR组)、单纯性糖尿病视网膜病变患者(DR组)及增生性糖尿病视网膜病变患者(PDR组)血清TNF-α 进行测定,结果表明TNF-α 含量:PDR组>DR组>NDR组>NC组,且差异有统计学意义,表明糖尿病患者血清TNF-α 水平较正常人增高,随着糖尿病视网膜病变程度的加重,血清TNF-α 水平进一步升高,此结果与以往研究结论一致。
虽然泪液与血清同属体液范畴,但关于泪液TNF-α 在糖尿病及其视网膜病变患者中的表达,国内外很少有研究报道。泪液收集过程无创,易于被患者接受,可以用来进行临床病情监测。本研究又通过对糖尿病患者泪液TNF-α 的检测,探讨了泪液TNF-α 的水平与糖尿病及不同分期糖尿病视网膜病变的关系,并进一步对泪液TNF-α 和血清TNF-α 做了相关性分析。本研究对NC组、NDR组、DR组、PDR组泪液TNF-α 分别进行了测定,结果表明TNF-α 含量:PDR组>DR组>NDR组>NC组,差异均有统计学意义,提示随着糖尿病视网膜病变程度的加重,泪液TNF-α 水平进一步升高。相关分析表明:泪液TNF-α 与血清TNF-α 变化趋势一致,呈直线正相关关系。
总之,本试验研究表明2型糖尿病患者泪液TNF-α 水平明显升高,且随糖尿病视网膜病变程度的加重而升高,泪液TNF-α 与2型糖尿病及不同分期糖尿病视网膜病变的发生有关。血清TNF-α 与泪液TNF-α 的变化呈直线正相关关系,所以泪液TNF-α 的测定有望成为继血清监测之后的糖尿病病情监测和评估的一种新方法。
[1]HABFFB NM,YOUSSFF OI,SAAB AA,et al.A diponectin as a marker of complications in typeⅠdiabetes[J].Indian Pediatr,2012,49(4):277-280.
[2]ZHANG X,SAADDINE JB,CHOU CF,et al.Prevalence of diabetic retinopathy in the United States,2005-2008[J].JAMA,2010,304(6):649-656.
[3]ANTONETTI DA,KLEIN K,GARDNER TW.Diabetic retinopathy[J].N Engl JMed,2012,366(13):1227-1239.
[4]NAVARRO JF,MORA-FERN?NDEZ C.The role of TNF-alpha in diabetic nephropathy:pathogenic and therapeutic implications[J].Cytokine Growth Factor Rev,2006,17(6):441-450.
[5]ICHINOSE K,KAWASAKI E,EGUCHI K.Recent advancement of understanding patho-genesis of type 1 diabetes and potential relevance to diabetic nephropathy[J].Am J Nephrol,2007,27(6):554-564.
[6]ROMERO-AROCA P.Current status in diabetic macular edema treatments[J].World J Diabetes,2013,4(5):165-169.
[7]FORNONI A,IJAZ A,TEJADA T,et al.Role of inflammation in diabetic nephropathy[J].Curr Diabetes Rev,2008,4(1):10-17.
[8]NAVARRO JF,MORA C,GOMEZ M,et al.Influence of renal involvement on peripheral blood mononuclear cell expression behaviour of tumour necrosis factor-alpha and interleukin-6 in type 2 diabetic patients[J].Nephrol Dial Transplant,2008,23(3):919-926.
[9]KOLEVA-GEORGIEVA DN,SIVKOVA NP,TERZIEVA D.Serum inflammatory cytokines IL-1beta,IL-6,TNF-alpha and VEGF have influence on the development of diabetic retinopathy[J].Folia Med(Plovdiv),2011,53(2):44-50.
[10]KAUL K,HODGKINSON A,TARR J,et al.Is inflammation a common retinal-renal-nerve pathogenic link in diabetes[J].Curr Diabetes Rev,2010,6(5):294-303.
[11]JOUSSEN AM,DOEHMEN S,LE ML,et al.TNF-α mediated apoptosis plays an important role in the development of early diabetic retinopathy and long-term histopathological alterations[J].Mol Vis,2009,15(8):1418-1428.
[12]RIFAT R,OZGUR A,UZAY G,et al.Interleukin-8 and tumor necrosis factor-a levels in vitreous samples from patients with diabetic retinopathy[J].Int Eye Sci,2013,13(12):2365-2369.

