肝癌患者外周血CD25及其m RNA表达*
胡万发,刘晓蕊,王健
(安徽理工大学1.附属肿瘤医院检验科;2.医学院病原学与免疫学教研室,安徽 淮南232001)
肝细胞癌是一种常见的恶性肿瘤,其发生和转归与宿主的细胞免疫功能有关。外周血富含各类免疫活性细胞,主要为T淋巴细胞,可表达IL-2R等多种受体,在抗肿瘤免疫应答中起重要作用[1]。CD25是IL-2R的α 亚单位,亦称膜白细胞介素-2受体(membrane interleukin-2 receptor,m IL-2R),是T细胞活化的重要标志,在介导IL-2发挥生物学效应上起关键作用[2]。为探讨其在肝细胞癌的表达水平,本研究选择59例原发性肝癌患者进行外周血CD25及其mRNA检测。报道如下:
1 对象与方法
1.1 临床资料
2010年1月-2011年5月住院的原发性肝癌患者59例,其中依病理分型,巨块型肝癌14例,结节型肝癌26例,弥漫型肝癌19例。患者男41例,女18例,平均年龄49.7岁,其中有18患者接受CIK(cytokine-induced killer)细胞治疗。另随机选取体检正常人群20例为对照组,男12例,女8例,平均年龄38岁。
1.2 试剂与仪器
乙肝病毒标志物(hepatitis B virus marker,HBVM)HBsAg、anti-HBs、HBeAg、anti-HBe、anti-HBc诊断试剂购自上海科华生物工程公司;淋巴细胞分离液(上海生化试剂二厂,批号100111);生物素-链霉亲和素(biotin-streptavidin,BSA)系统m IL-2R诊断试剂购自上海思创生化电子有限公司;AFP放射免疫分析药盒(北京北方生物技术研究所,批号:SI0912022);Trizol试剂盒(美国Gaithersburg公司);EXL-808全自动酶标分析仪(美国Bio-Teck公司);TaKaRa梯度PCR仪TP600(日本TaKaRa公司);Hema-2000凝胶扫描分析系统(珠海Hema公司);iCycle荧光实时定量PCR仪(美国Bio-Rad公司);MDF-135型CO2培养箱(日本Syno公司)。
1.3 方法
1.3.1 CD25检测 静息态CD25检测:取肝素抗凝血2ml,以等量无Ca2+、Mg2+的Hanks'液稀释后,用淋巴细胞分离液常规分离PBMC,用Hanks'液洗涤3次,用含1640完全培养液调整细胞数至(1~3)×109/L,取上述细胞悬液10μl,分别涂布于印有防酸漆圈的玻片孔内,自然干燥后用新鲜丙酮固定15~20min,干后于每一标本印圈内加抗Tac的单克隆抗体10μl,放入湿盒37℃、5%CO2环境孵育30min,然后用TBS漂洗,稍干后加生物素化羊抗鼠IgG 10μl于各孔中,同法孵育、漂洗,最终加新鲜配制的显色液,待显色明显时用TBS漂洗,终止显色,高倍镜下镜检,细胞膜呈棕色者为阳性,不着色者为阴性,共计数200个细胞,分别计算阳性细胞百分率。诱导态CD25检测:取上述细胞悬液0.5ml,加入最终浓度为200μg/ml植物血凝素(phytohemagglutinin,PHA)的1640完全培养液0.5ml,置37℃、5%CO2环境孵育72 h。取沉淀细胞用1640完全培养液稀释至(1~3)×109/L,同法涂片、孵育、漂洗、镜检,行诱导期m IL-2R检测。
1.3.2 CD25 mRNA检测 取PHA孵育前后患者的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),以RPMI 1640完全培养液调整细胞数至(1~2)×106/ml。用Trizol试剂抽提总RNA,逆转录成cDNA置-86℃冰箱备检。用SYBR Green I荧光标记法检测PCR产物,总反应体系为25μl,2μl标准品或模板cDNA,模板cDNA以1∶4稀释。CD25 mRNA引物设计参照HIRATA等[3]方法,引物序列:sense(5'→3')为CAAAGTCCAATGCAG CCAGT,Anti-sense(5'→3')为TCACCTGTGCATAT GAGCTG,扩增片段长度232 bp。以GAPDH为内参标准,每次检测标准品以10倍梯度稀释6个梯度(106、105、104、103、102和10 copies/ml) 绘制标准曲线。3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物sense(5'→3'):AGAAGGCTGGGGCTCATTTA,anti-sense(5'→3'):为AGGGGCCATCCACAGTCTTC,扩增片段长度为258 bp。扩增参数:95℃预变性300 s,95℃ 10 s,65℃10 s,40个循环,最后72℃保温300 s,4℃保存。为克服系统误差,设GAPDH为参照,以lgcDNA/lgGAPDH比值代表其最终mRNA水平。
1.4 CIK细胞制备
参照BONANNO等[4]方法,台盼蓝拒染试验检测CIK细胞活度>95%,流式细胞术检测CIK细胞中CD3+CD8+CD56+含量>80%以确定靶细胞。CIK细胞治疗方法:取新鲜制备CIK细胞,每次以2.0×1010浓度细胞悬液输注100ml,每天1次,连续5 d,其他参照郝一文等[5]方法。
1.5 统计学处理
2 结果
与正常对照相比,肝细胞癌患者外周血单个核细胞PHA诱导前后CD25及其mRNA水平均显著下降,差异有统计学意义(P<0.01)。具体见图1~2。CIK细胞治疗后,静息期和诱导期CD25及其mRNA水平明显升高,差异有统计学意义,见图3~4。
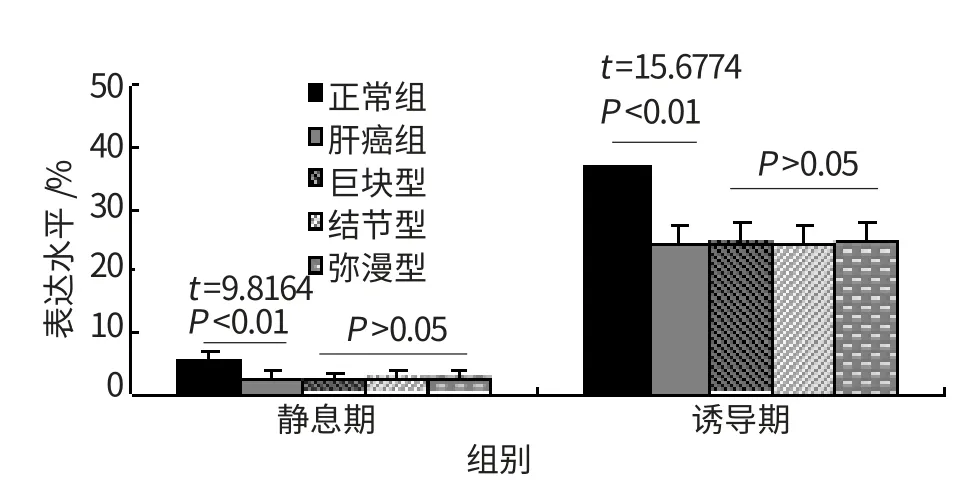
图1 肝癌患者外周血CD25表达
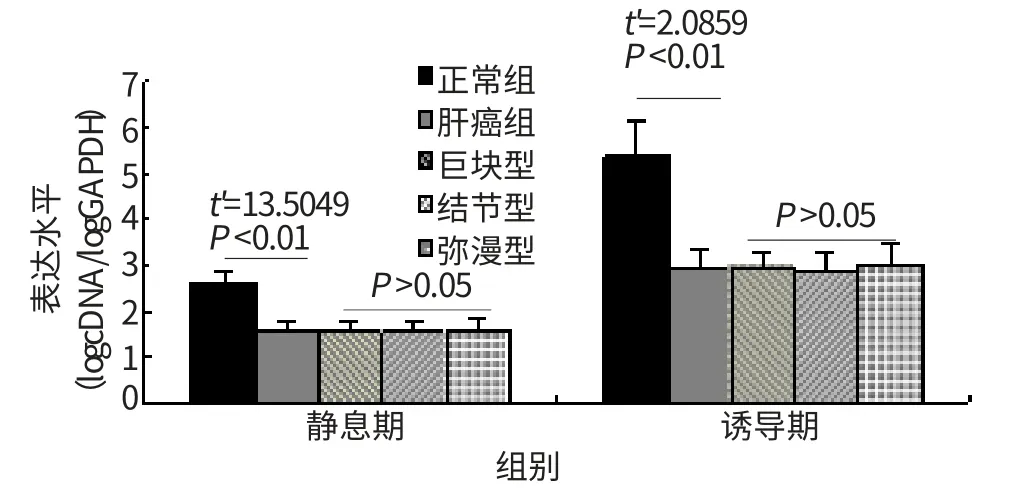
图2 肝癌患者外周血CD25 m RNA表达

图3 肝癌患者CIK细胞治疗前后CD25表达
3 讨论
肝细胞癌是目前公认的恶性肿瘤,其确切的发生机制尚未完全阐明,一般认为与宿主的细胞免疫功能有关。PBMCs是多种免疫活性细胞的集合体,主要是T淋巴细胞,可表达IL-2R,在抗肿瘤免疫反应中起重要作用。
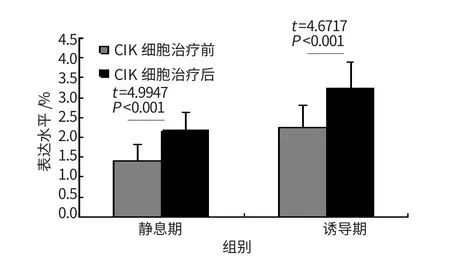
图4 肝癌患者CIK细胞治疗前后CD25mRNA表达
IL-2R是IL-2的特异性受体,包括α、β、γ三个亚单位,分别称为CD25、CD122、CD132,其中以CD25较重要,是T细胞活化的标志,在IL-2发挥生物学效应上起关健作用,其表达水平可反映T细胞的激活过程和机体的免疫状态[6]。本研究结果显示,肝癌患者外周血PHA诱导前后CD25表达水平均较正常对照组显著降低,差异均有统计学意义(P<0.01),提示肝癌患者存在明显的细胞免疫功能低下,T细胞处于抑制状态,不能表达足够的CD25,限制宿主抗肿瘤免疫应答。T细胞表面除表达CD25外,还含有PHA受体。以PHA诱导后,CD25表达水平虽较静息期明显提高,提示患者对PHA刺激仍有相当的反应性,但与正常对照相比表达水平仍较低,差异性仍有统计学意义,提示肝癌患者T细胞对PHA的诱导反应弱,活化的T细胞减少或不足[7]。进一步观察不同病理分型患者外周血CD25表达情况,结果显示巨块型、结节型、弥漫型肝癌患者外周血CD25及其mRNA表达水平类似,差异无统计学意义(P>0.05),提示肝癌患者的细胞免疫功能低下与病理分型无关。
CD25 mRNA是反映编码或调控CD25表达和分泌的新型指标,在活化性T细胞高表达。本研究结果显示肝癌患者PBMCs在静息状态下CD25mRNA水平较低,提示患者外周血中T细胞合成分泌CD25的能力较弱。当PBMCs与PHA共孵育后,CD25mRNA水平显著升高,但与对照组相比仍有较大差异(P<0.05),提示PHA能非特异性刺激T细胞活化增殖,但其活化能力仍较正常者低,这种低活性T细胞限制宿主抗肿瘤免疫应答。近年来,多项研究表明,肝细胞癌与HBV、HCV感染密切相关,HBV不仅对肝细胞具有高度的亲和性,还可侵犯PBMCs、淋巴结、肾脏等,形成肝外感染。当HBV侵入PBMCs,一方面在其中复制增殖[8],甚至通过整合酶形成cccDNA,与宿主细胞基因整合;另一方面促使T细胞产生并释放大量血清可溶性白细胞介素-2受体(soluble interleukin-receptor,sIL-2R),此与CD25产生竞争抑制,限制CD25的表达[9-10]。进一步观察发现,不同病理类型的肝癌患者PHA诱导前后CD25 mRNA水平相似,差异无统计学意义(P>0.05),提示肝癌患者的CD25 mRNA表达与病理分型无关[11]。
CIK细胞是PBMCs在体外多种细胞因子(如抗-CD3单抗、IL-2、IFN-γ、IL-1α)共同作用下,获得的一群以CD3+CD56+T细胞和CD3+CD8+T细胞为主要效应细胞的异质细胞群,具有高增殖潜能的免疫细胞[12]。肝癌患者采用CIK细胞治疗后,发现外周血静息期和诱导期CD25及其mRNA表达均明显升高,提示由于IL-2等刺激,诱导患者T细胞活化,促进细胞表面表达IL-2R,活化的T细胞通过自分泌和旁分泌效应诱导周边的T细胞活化,形成级联放大效应,从而暂时纠正患者细胞免疫功能低下的表现,患者病情得以控制和缓解[13]。有条件的医院可定期为患者输注CIK细胞,使体内活化的T细胞维持在一个相对稳定的水平,以纠正细胞免疫功能紊乱,改善患者生存质量。
综上所述,肝癌患者细胞免疫功能明显低下,主要表现为外周血CD25及其mRNA水平降低,其降低程度与病理分型无关。PHA可体外诱导患者PBMCs表达CD25。CD25可作为观察患者细胞免疫功能和评估疗效的辅助指标。
[1]KORANGY F,HÖCHST B,MANNSMP,et al.Immune responses in hepatocellular carcinoma[J].Dig Dis,2010,28(1):150-154.
[2]LU ZH,CHEN W,JU CX,et al.CD25 is a novel marker of hepatic bile canaliculus[J].Int J Surg Pathol,2012,20(5):455-461.
[3]HIRATA H,ARIMA M,CHENG G,et al.Production of TARC and MDC by naive T cells in asthmatic patients[J].J Clin Immunol,2003,23(1):34-35.
[4]BONANNO G,IUDICONE P,MARIOTTI A,et al.Thymoglobulin,interferon-γ and interleukin-2 efficiently expand cytokine-induced killer(CIK)cells in clinical-grade cultures[J].J Transl Med,2010,8:129.
[5]郝一文,和予馨,周文玲.自体外周血单个核细胞制备CIK细胞治疗恶性实体肿瘤应用价值研究[J].中国输血杂志,2011,24(9):746-749.
[6]MALEK TR,CASTRO I.Interleukin-2 receptor signaling:at the interface between tolerance and immunity[J].Immunity,2010,33(2):153-165.
[7]WANG J,JIANG SQ,XIANG GJ.Relationship between expression of HBVx-DNA in peripheral blood of the patients with chronic hepatitis B[J].Chin J Public Health,2006,22(10):1187-1189.
[8]WANG KX,ZHANG LH,PENG JL,et al.Effect of liniment levamisole on cellular immune functions of patients with chronic hepatitis B[J].World J Gastroenterol,2005,11(45):7208-7210.
[9]CABRERA R,ARARAT M,EKSIOGLU EA,et al.Influence of serum and soluble CD25 (sCD25)on regulatory and effector T-cell function in hepatocellular carcinoma[J].Scand J Immunol,2010,72(4):293-301.
[10]WANG J,WANG Y,XIANG GJ.The influence of PBMC infected by HBV on the expression of CD25 mRNA in immune cells of the patients[J].Chin J Microbiol Immunol,2007,27(6):523-524.
[11]OHIRA M,NISHIDA S,TRYPHONOPOULOS P,et al.Clinical-scale isolation of interleukin-2-stimulated liver natural killer cells for treatment of liver transplantation with hepatocellular carcinoma[J].Cell Transplant,2012,21(7):1397-1406.
[12]PAN K,LI YQ,WANG W,et al.The efficacy of cytokine-induced killer cell infusion as an adjuvant therapy for postoperative hepatocellular carcinoma patients[J].Ann Surg Oncol,2013,20(13):4305-4311.
[13]MORISAKI T,ONISHI H,KOYA N,et al.Combinatorial cytotoxicity of gemcitabine and cytokine-activated killer cells in hepatocellular carcinoma via the NKG2D-MICA/B system[J].Anticancer Res,2011,31(7):2505-2510.

