利拉鲁肽联合二甲双胍治疗2型糖尿病伴肥胖患者疗效及对微炎症状态的影响
赵富利,亓民,刘辉
(郑州大学附属洛阳中心医院1.老年病科;2.内分泌科,河南 洛阳471000)
2型糖尿病患者由于胰岛素功能降低,除了引起高血糖外还可导致患者脂质代谢紊乱,伴发肥胖的患者占据很大比例。单纯依靠增加降糖药物剂量治疗效果不佳。利拉鲁肽是人类胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)的受体激动剂,半衰期长、降糖效果持久,具有改善胰岛细胞功能、抑制餐后胰高血糖素分泌、降低食欲等作用,是目前广受关注的新型降糖药[1-2]。本研究主要分析利拉鲁肽联合二甲双胍治疗2型糖尿病伴肥胖患者疗效及对患者微炎症状态的影响。报道如下:
1 资料与方法
1.1 一般资料
选择于2013年1月-2014年1月期间郑州大学附属洛阳中心医院收治的2型糖尿病伴肥胖患者88例作为研究对象。按照随机数表法将所有入组患者分为对照组和观察组,各44例。对照组接受单纯二甲双胍治疗,观察组接受利拉鲁肽联合二甲双胍治疗。对照组男23例、女21例,年龄41~72岁,平均(53.76±6.76)岁;观察组男24例、女20例,年龄49~73岁,平均(55.08±8.21)岁。两组患者年龄、性别等一般资料的比较差异不具有统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组患者接受单纯二甲双胍降糖治疗,口服二甲双胍片(中美上海施贵宝制药有限公司,国药准字H20023371)1.0 g/次,2次/天,连续治疗16周。观察组患者接受利拉鲁肽联合二甲双胍治疗,具体如下:二甲双胍用法用量同对照组,利拉鲁肽(丹麦诺和诺德公司,国药准字J20110026)0.6mg皮下注射,1次/天,连续治疗16周。
1.3 观察指标
1.3.1 体质指数与血糖水平 接受不同治疗前及治疗两个疗程后,测定患者身高体重并测定体质指数(body mass index,BMI),抽取外周静脉血测定空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(hemoglobin A1c,HbA1c)水平。
1.3.2 微炎症水平 接受不同治疗前及治疗两个疗程后均抽取患者外周静脉血,采用酶联免疫吸附法测定人急性时相血清淀粉样蛋白A(acute-phase serum amyloid,ASAA)、肿瘤坏死因子(tumor necro sis factor,TNF-α)、白介素6(interleukin-6,IL-6)水平。
1.3.3 脂质水平 接受不同治疗前及治疗两个疗程后均抽取患者外周静脉血,采用电化学发光法测定脂质水平包括甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipid-cholesterol,HDL-C)、低密度脂蛋白(low density lipid-cholesterol,LDL-C)等水平差异。
1.4 统计学方法
所有数据均采用SPSS 18.0统计软件包进行数据分析处理,计量资料采用均数±标准差(±s)表示,两两比较采用t检验,计数资料的比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 体质指数与血糖水平
治疗前两组患者的体质指数与血糖水平比较差异无统计学意义(P>0.05),观察组患者接受治疗后的BMI、FBG、HbA1c水平均明显低于对照组患者(P<0.05),见表1。
2.2 微炎症水平
治疗前两组患者的微炎症水平比较差异无统计学意义(P>0.05),观察组患者接受治疗后的ASAA、TNF-α、IL-6水平均明显低于对照组患者,差异有统计学意义(P<0.05),见表2。
表1 两组患者接受不同治疗前后的体质指数与血糖水平比较 (±s)
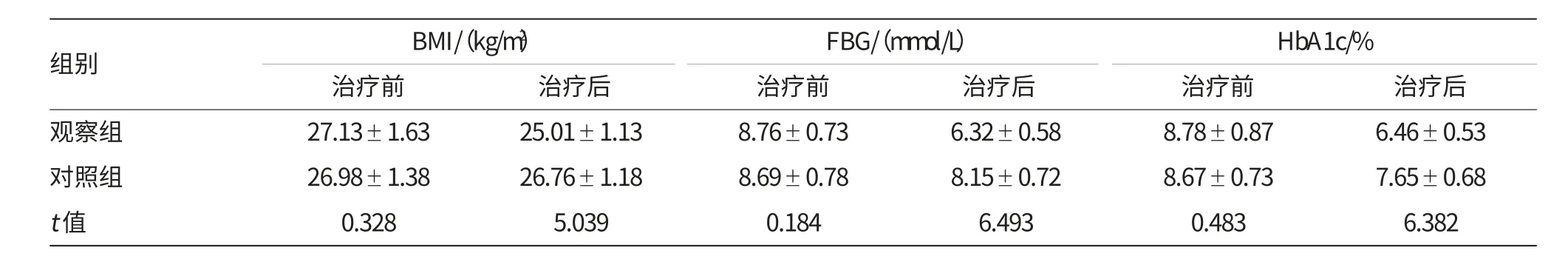
表1 两组患者接受不同治疗前后的体质指数与血糖水平比较 (±s)
组别 BMI/(kg/m2) FBG/(mmol/L) HbA1c/%治疗前 治疗前 治疗前 治疗后观察组 27.13±1.63 25.01±1.13 8.76±0.73 6.32±0.58 8.78±0.87 6.46±0.53对照组t值治疗后 治疗后26.98±1.38 0.328 26.76±1.18 5.039 8.69±0.78 0.184 8.15±0.72 6.493 8.67±0.73 0.483 7.65±0.68 6.382
表2 两组患者接受不同治疗前后的微炎症水平比较 (±s)
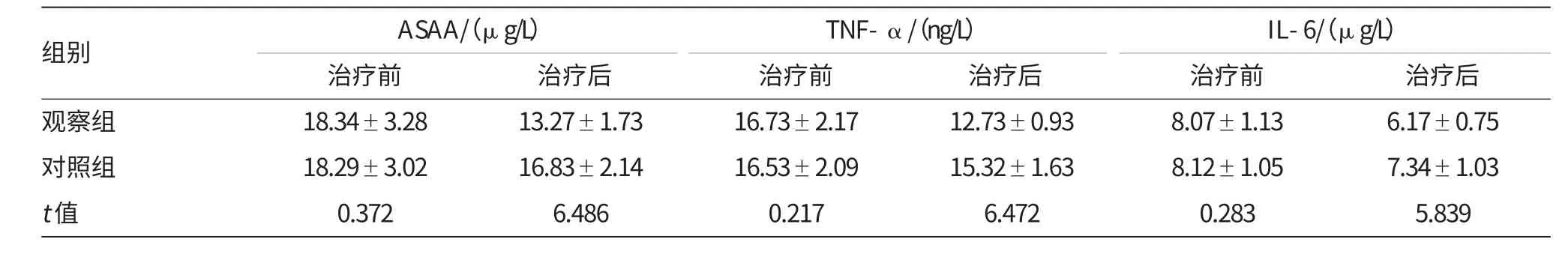
表2 两组患者接受不同治疗前后的微炎症水平比较 (±s)
组别 ASAA/(μg/L) TNF-α/(ng/L) IL-6/(μg/L)治疗前 治疗前 治疗前 治疗后观察组 18.34±3.28 13.27±1.73 16.73±2.17 12.73±0.93 8.07±1.13 6.17±0.75对照组t值治疗后 治疗后18.29±3.02 0.372 16.83±2.14 6.486 16.53±2.09 0.217 15.32±1.63 6.472 8.12±1.05 0.283 7.34±1.03 5.839
2.3 脂质水平
治疗前两组患者的脂质水平比较,差异无统计学意义(P>0.05),观察组患者接受治疗后的TG、LDLC水平低于对照组,HDL-C水平高于对照组患者(P<0.05),见表3。
表3 两组患者接受不同治疗前后的脂质水平比较 (±s)
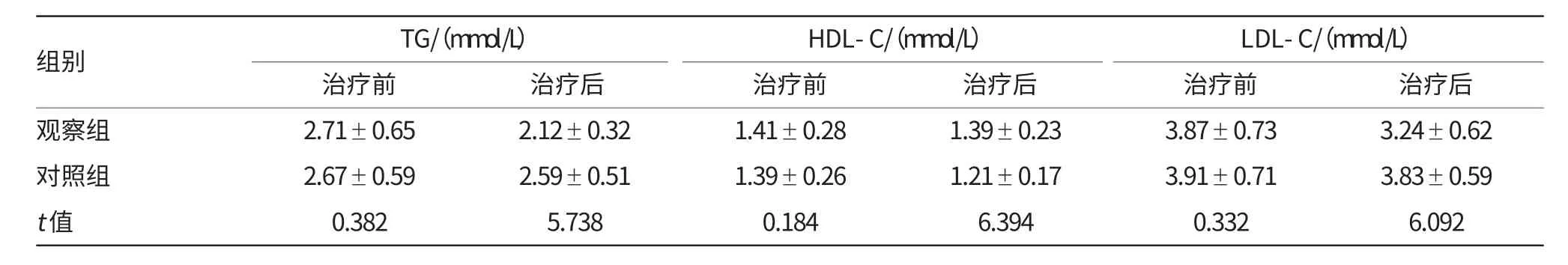
表3 两组患者接受不同治疗前后的脂质水平比较 (±s)
组别 TG/(mmol/L) HDL-C/(mmol/L) LDL-C/(mmol/L)治疗前 治疗前 治疗前 治疗后观察组 2.71±0.65 2.12±0.32 1.41±0.28 1.39±0.23 3.87±0.73 3.24±0.62对照组t值治疗后 治疗后2.67±0.59 0.382 2.59±0.51 5.738 1.39±0.26 0.184 1.21±0.17 6.394 3.91±0.71 0.332 3.83±0.59 6.092
3 讨论
糖尿病在我国20岁以上人群中的发病率为9.7%,其中超重或者肥胖人群的发病率尤高。肥胖可以进一步导致胰岛素抵抗,要控制血糖就必须增加降糖药用量,这反过来导致体重增加,形成恶性循环[3]。二甲双胍是治疗2型糖尿病最常用药物,应用后有助于降低胰岛素抵抗并减轻体重,但是单纯通过加大二甲双胍剂量来控制血糖上升趋势,将给患者带来一系列并发症同时降糖效果降低[4]。肠促胰岛素为人类进食后分泌的主要肠道激素,包括葡萄糖依赖性促胰岛素激素(gastric inhibitory peptide,GIP)、胰高血糖素样肽1(GLP-1)。有研究显示2型糖尿病患者肠促胰岛素效应减弱甚至消失,另有研究发现2型糖尿病患者存在GLP-1受体氨基酸序列变异,使其与GLP-1结合亲和力大幅下降,更加导致其启动下游信号的能力明显降低,最终造成胰岛素分泌及敏感性降低[5]。利拉鲁肽是人类胰高血糖样肽-1(GLP-1)的受体激动剂,与人体GLP-1具有97%相似性,其结合并缓释活性GLP-1,同时抑制二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)降解以延长药物半衰期,克服天然GLP-1易被水解的缺陷[6]。利拉鲁肽具有抑制胰高血糖素分泌、促进胰岛β 细胞增生、改善胰岛功能等作用,在控制2型糖尿病伴肥胖患者的血糖及整体状态方面均有积极意义。
将利拉鲁肽与降糖药物联合应用可以在不增加降糖药物用量的基础上进一步控制患者血糖,从根本上改善胰岛细胞功能[7]。本研究发现观察组患者接受治疗后的BMI、FBG、HbA1c水平均明显低于对照组患者。提示利拉鲁肽具有高效的降糖作用,同时有助于降低患者食欲、延缓胃排空,对于改善患者的体质指数具有积极意义。利拉鲁肽除了降糖作用外,还具有降脂及改善内皮功能的作用,对于减少缺血再灌注及心功能均有益。KAMALANATHAN[8]的研究显示糖尿病患者存在一定程度的炎症指标值上升,伴有此微炎症状态的患者远期并发外周及中心血管并发症的概率上升。可见2型糖尿病患者可能存在隐匿性炎症指标水平上升,长此以往将导致血管并发症的发生。本研究对比了两组患者的相关炎症指标水平,结果显示两组患者治疗前ASAA、TNF-α、IL-6水平较正常人上升,但是组间差异无统计学意义(P>0.05),观察组患者接受治疗后的ASAA、TNF-α、IL-6水平明显低于对照组患者(P<0.05)。提示利拉鲁肽在降糖减重之外还具有改善糖尿病患者微炎症状态的作用,对于延缓甚至减少患者的远期并发症发生具有积极的作用[9]。
糖尿病合并高脂血症占糖尿病人群的1/2,胰岛素在降糖作用之外,对蛋白质及脂肪代谢也具有调控作用,2型糖尿病患者的胰岛素生物调节功能发生紊乱,常伴有脂质代谢的变化,易发生脂肪代谢障碍、脂质沉积,增加糖尿病并发大血管并发症的风险[10]。利拉鲁肽具有调节胰岛功能的作用,对脂肪代谢也具有积极作用。本研究发现观察组患者接受治疗后的TG、LDL-C水平低于对照组患者,HDL-C水平高于对照组患者。提示利拉鲁肽可以促进2型糖尿病伴肥胖患者的脂质代谢,减少循环系统的脂质沉积,进一步促进血糖稳定且对减少远期大血管并发症也有帮助。
综上所述,本研究认为利拉鲁肽联合二甲双胍治疗可以降低2型糖尿病伴肥胖患者的体质指数及血糖水平,优化全身炎症状态及脂质水平。
[1]JONES DA,PRIOR SL,BARRY JD,et al.Changes in markers of oxidative stress and DNA damage in human visceral adipose tissue from subjects with obesity and type 2 diabetes[J].Diabetes Res Clin Pract,2014,106(3):627-633.
[2]张艳,李伟.利拉鲁肽对人脐静脉内皮细胞中核转录因子κB和单核细胞趋化蛋白1表达的影响[J].中国现代医学杂志,2013,23(6):29-33.
[3]LIM ET,LIU YP,CHAN Y,et al.A novel test for recessive contributions to complex diseases implicates bardet-biedl syndrome gene BBS10 in idiopathic type 2 diabetes and obesity[J].Am J Hum Genet,2014,95(5):509-520.
[4]SUGITA Y,HONDA Y,KATO I,et al.Role of photofunctionalization in mitigating impaired osseointegration associated with type 2 diabetes in rats[J].Int J Oral Maxillofac Implants,2014,29(6):1293-1300.
[5]奚悦.利拉鲁肽对初发2型糖尿病伴肥胖患者疗效及微炎症状态的影响研究[J].中国全科医学,2013,16(10):3339-3341.
[6]HENSTRIDGE DC,WHITHAM M,FEBBRAIO MA.Chaperoning to the metabolic party: the emerging therapeutic role of heat-shock proteins inobesity and type 2 diabetes[J].Mol Metab,2014,3(8):781-793.
[7]TAYLOR EM,JONES AD,HENAGAN TM.A review of mitochondrial-derived fatty acids in epigenetic regulation of obesity and type 2 diabetes[J].J Nutrit Health Food Sci,2014,2(3):1-4.
[8]KAMALANATHAN S,NAMBIAR V,SHIVANE V,et al.Bone mineral density and factors influencing it in Asian Indian population with type 2 diabetesmellitus[J].Indian J Endocrinol Metab,2014,18(6):831-837.
[9]KHEMAYANTO H,SHI B.Role of Mediterranean diet in prevention and management of type 2 diabetes[J].Chin Med J(Engl),2014,127(20):3651-3656.
[10]GALLAGHER D,HESHKA S,KELLEY DE,et al.Changes in adipose tissue depots and metabolic markers following a 1-year diet and exercise intervention in overweight and obese patients with type 2 diabetes[J].Diabetes Care,2014,37(12):3325-3332.

