谷胱甘肽S转移酶基因多态性与中国人群骨肉瘤化疗敏感性的meta分析
全 忠,王 帅,刘 毅
(1.老河口市第一人民医院骨科病区,湖北 老河口 441800;2.襄阳市解放军477医院骨科病区,湖北 襄阳 441800)
·循证医学·
谷胱甘肽S转移酶基因多态性与中国人群骨肉瘤化疗敏感性的meta分析
全 忠1,王 帅2,刘 毅1
(1.老河口市第一人民医院骨科病区,湖北 老河口 441800;2.襄阳市解放军477医院骨科病区,湖北 襄阳 441800)
目的系统评估谷胱甘肽S转移酶GSTT1、SGTM1、GSTP1基因多态性与中国人群骨肉瘤化疗敏感性。方法计算机检索PubMed、Embase、Web of Science、Cochrane Library、中国知网(CNKI)、维普(VIP)、万方数据库及中国生物医药文献数据库(CBD),收集有关GSTM1、GSTT1、GSTP1与中国人群骨肉瘤化疗敏感性的研究,按照纳入和排除标准筛选文献,对符合标准的文献进行质量评价并提取数据,采用RevMan5.3、Stata12.0软件进行meta分析,计算合并OR值和95%CI,进行发表偏倚评价和敏感性分析。结果共纳入4篇文献由12个独立的研究组成,累计病例681例。Meta分析结果显示中国人群GSTT1(OR=0.92,95%CI=0.68~1.25,P=0.59)、GSTM1(OR=0.93,95%CI=0.68~1.26,P=0.63)缺失型与正常型及GSTP1各遗传模型(GG vs AA+AG,OR=0.61,95%CI=0.34~1.11,P=0.11)对化疗的敏感性差异均无统计学意义,但GSTP1 Meta分析稳健性欠佳。结论GSTT1、GSTM1基因多态性与中国人群骨肉瘤患者化疗敏感性无关。GSTP1基因多态性与中国人群骨肉瘤患者化疗敏感性可能无关,更进一步大样本研究是必要的。
骨肉瘤;谷胱甘肽酶转移酶;基因多态性;Meta分析
骨肉瘤(Osteosarcoma)又称为“成骨肉瘤”,是一种好发于青少年和儿童的危及生命的恶性肿瘤[1],其病因尚不明确,但研究证实其发病受遗传因素的影响[2]。规范化的治疗包括新辅助化疗和术后进一步化疗[3],然而肿瘤的多重耐药性导致约50%的骨肉瘤患者对化疗不敏感[4],加之基因多态性对骨肉瘤患者化疗敏感性影响[5],使得骨肉瘤患者的预后欠佳。
谷胱甘肽S转移酶(GSTs)是一种可以缓解氧化应激作用的解毒酶家族,能增加毒物的水溶性,使其排除体外[6]。到目前为止,在人和哺乳动物体内已经发现8种不同类的谷胱甘肽S转移酶[7],他们分别是GSTα、GSTκ、GSTδ、GSTω、GSTμ、GSTπ、GSTξ、GSTθ。GSTM1和GSTT1属于GSTμ家族,GSTP1属于GSTπ家族中的一员,他们是目前在骨肉瘤中研究最多的GSTs成员之一,他们可以影响化疗药物在体内的吸收与代谢,作用于肿瘤的耐药机制[8]。目前有关GSTM1、GSTT1、GSTP1基因多态性与化疗敏感性研究国内报道较多,但都存在样本量偏小,统计效力较低,因此研究结论也不太一致。为此,我们采用Meta分析的方法进行综合定量分析,明确GSTM1、GSTT1、GSTP1基因多态性与化疗敏感性的关系。
1 资料与方法
1.1 文献检索 全面检索PubMed、Embase、Web of Science、Cochrane Library、中国知网(CNKI)、维普(VIP)、万方数据库及中国生物医药文献数据库,收集有关GSTM1、GSTT1、GSTP1与中国人群骨肉瘤化疗敏感性的文章。检索策略:基于PICOS原则,中文检索词式:“谷胱甘肽S转移酶”或“GSTM1”或“GSTT1”或“GSTP1”并“基因多态性”并“骨肉瘤”或“骨肿瘤”;英文检索式:”Glutathione S-Transferase”OR“GSTs”OR”GSTT1”OR”GSTM1”OR”GSTP1”AND“Polymorphisms”OR“Variation”OR“SNP”AND“Osteosarcoma”。所有文献检索至2015年3月15日,同时追溯所获文献的参考文献,进一步从中筛选符合要求的相关文献。文献出版语言限于中文和英文。
1.2 文献筛选 ①阅读所检索出文献的标题和摘要,初步纳入符合要求的文献;②获取初步纳入文献全文,仔细阅读全文,排除不合格文献;③在阅读的过程中,追溯参考文献以补充符合纳入标准的文献。
1.3 纳入与排除标准
1.3.1 纳入标准 ①2015年3月15日以前公开发表的有关谷胱甘肽S转移酶基因多态性与骨肉瘤化疗敏感性的文献;②所纳入文献研究对象是中国人,且均行组织病理学证实,确诊为骨肉瘤;③文中报告数据完整,能直接或间接的计算出OR值及95% CI;④所有纳入病例均为首次诊断骨肉瘤,且之前未接受过化疗,在治疗过程中未接受过放疗;⑤所有病例均接受以多柔比星、氨甲喋呤、顺铂、环磷酰胺等化疗药组成的标准化化疗方案;⑥如果两个研究中有重叠人群,纳入样本量较大的研究;⑦疗效评判依据根据WHO标准或者RECIST标准。
1.3.2 排除标准 ①重复发表的文献;②数据不完整文献;③会议、摘要、述评、个案报道、综述类文献。
1.4 文献质量评价及数据的提取 由两个独立的研究员依据纽卡斯尔-渥太华标准(NOS)(http://www.ohri.ca/programs/clinical_epidemiology/oxford. asp)从选择、可比性和结局三个方面对文献进行质量评价(满分9分),并按照标准化数据收集方案从原文中提取数据,然后交叉核对。在质量评价及数据提取过程中,如有分歧,则由两名研究员协商解决。资料提取的内容包括第一作者、发表时间、基因型检测方法、病例总数及各基因型化疗敏感的例数。
1.5 统计学方法 应用RevMan5.3软件及Stata12.0软件进行统计学分析。合并效应量采用OR及95%CI表示。首先采用Q检验对最终纳入的文献进行异质性检验,当各研究间无明显异质性(Ph>0.1)时,采用固定效益模型,否则,使用随机效应模型进行数据分析,用I2衡量异质性大小[9-10]。应用Stata12.0软件采用Begg法和Egger法检验评价发表偏倚,采用逐一排除法进行敏感性分析。
2 结 果
2.1 文献检索及质量评价结果 最终共有4篇文献纳入本研究[11-14],均为英文文献,累计病例681例,由12个独立的研究组成,GSTP1基因型分布均经检验均符合哈温(Hardy-Weinberg)平衡(P>0.05)。纳入病例的基本特征如表1,纳入文献质量评分平均7分,质量均较高。
2.2 Meta分析结果 各基因不同遗传模型meta分析结果如表2。其中GSTT1、GSTM1均无明显异质性(I2=0,P>0.1),故采用固定效应模型(图1)。结果显示:中国人群骨肉瘤患者GSTT1、GSTM1缺失型与正常型对化疗的敏感性差异均无统计学意义(P>0.05)。GSTP1基因除了共显性模型AG vs AA和超显性模型GG+AAvsAA无明显异质性(I2=0,P>0.1)采用固定效益模型外,其余遗传模型均采用随机效应模型(I2>50%,P<0.1)进行分析(图1),结果显示中国人群骨肉瘤患者GSTP1基因各遗传模型对化疗敏感性差异均无统计学意义(P>0.05)。
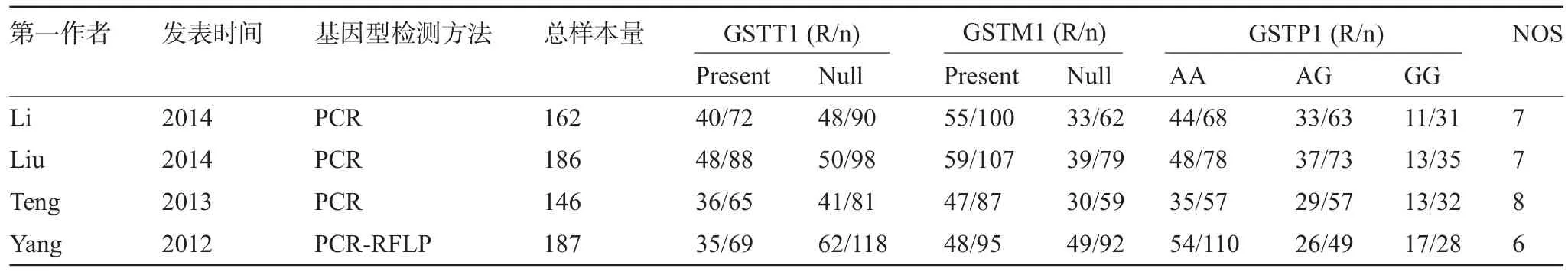
表1 纳入病例的基本特征
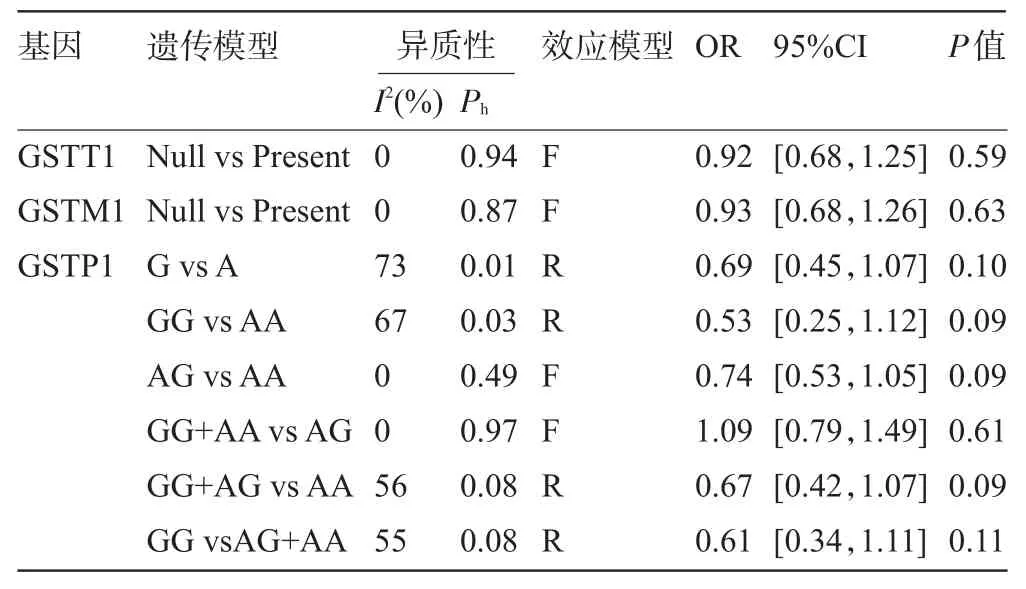
表2 GSTT1、GSTM1、GSTP1基因多态性与中国人骨肉瘤化疗敏感性Meta分析结果
2.3 发表偏倚 利用Stata12.0软件,Beeg检验法绘制各基因各遗传模型漏斗图,纳入文献均出现在漏斗图上,对称散开分布(图2)。行Beeg检验和Egger检验结果显示GSTT1、GSTM1、GSTP1各遗传模型无发表偏倚(P>0.05),如图1。
2.4 敏感性分析 采用逐一排除法对纳入研究进行敏感性分析,其中GSTT1、GSTM1基因排除其中任何一项研究后,Meta分析合并P值未发生明显变化(P>0.05),提示结果稳健。但GSTP1基因在剔除Yang等[11]研究后,各遗传模型Meta分析合并P值变化明显(P<0.05),因此,GSTP1基因Meta分析结果稳健性较差。

图1 各基因遗传模型森林图
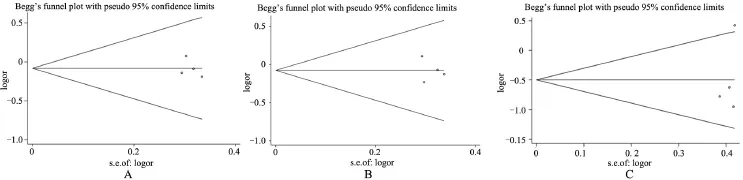
图2 各基因遗传模型漏斗图
3 讨论
谷胱甘肽S转移酶是一种重要的II相代谢酶,在药物代谢的过程中发挥重要的作用[15],尤其是GSTT1、GSTM1、GSTP1,其基因多态性已被证实与多种肿瘤化疗敏感性有关[16-18],他们通过改变酶的活性来影响化疗的敏感性[19]。从国内外报道来看,目前大部分有关GSTT1、GSTM1、GSTP1基因多态性与骨肉瘤化疗敏感性的研究均局限于国内,但由于单个研究样本量较小,检验效能较低,故研究结论不尽相同。Yang等[11]研究发现,GSTP1 GG基因型对化疗应答率略高于AA基因型,但差异无统计学意义(OR= 1.60,95%CI=0.84~4.15),但在平衡了性别、年龄等混杂因素后,他认为GG基因型对化疗敏感(OR=2.19,95%CI=1.15~6.21)。但Liu等[12]的研究认为GSTP1基因GG(OR=0.82,95%CI=0.35~1.91)基因型和等位基因G(OR=0.57,95%CI=0.36~0.88)对化疗不敏感。类似的分歧在另外两项研究中也存在[13-14]。
本研究显示GSTT1、GSTM1缺失型与正常型相比,对化疗的敏感性没有显著差异,采用逐步排除法进行敏感性检验时候,并没有改变Meta分析结果,采用Beeg法和Egger法检测也未发现发表偏倚。这表明GSTT1、GSTM1基因多态性与中国人群骨肉瘤患者化疗敏感性无关。研究认为GSTM1缺失型可以减少化疗药对化疗更加敏感[20-21]。这与本研究结论不一致,这可能与样本量及种族有关。
在研究GSTP1基因型对中国人群骨肉瘤患者化疗敏感性影响时,我们分别采用等位基因(G vsA)、显性模型(GG+AG vs AA)、隐性模型(GG vs AA+AG)、超显性模型(GG+AA vs AG)、共显性模型(GG vs AA和AG vs AA)逐步进行分析,结果显示,所有遗传模型对化疗的敏感性均无统计学意义(均P>0.05),Beeg法和Egger法检验也未发现发表偏倚。但采用逐步排除法在排除Yang等[11]研究后,GG vs AA,G vs A,GG+AG vs AA,AG vs AA,GG vs AG+AA遗传模型与化疗敏感性有关(P<0.05),提示该Meta分析的结果不稳健。因此,更进一步大样本量的研究是必要的。
本研究虽然系统科学的设计了研究方案,但仍然存在一定的缺陷:(1)骨肉瘤发病是多因素共同作用的结果,其中难免存在基因-基因,基因-环境间的交互作用,由于原始数据缺失,故未能对此进行分析;(2)骨肉瘤患者化疗方案、化疗药物生成厂家不尽相同,也可能对化疗效果有一定的影响;(3)基因型检测方法不完全相同型,这也可能对研究结果有一定的影响。
总之,本研究显示,GSTT1、GSTM1、GSTP1基因多态性可能与中国人群骨肉瘤化疗敏感性无关。但由于遗传异质性的存在,我们期待今后开展更多大样本量、更高质量的研究,以更准确评估GSTT1、GSTM1、GSTP1基因多态性与骨肉瘤化疗敏感性的关系,为临床治疗提供更好的方案。
[1]Bertucci F,Araujo J,Giovannini M.Pancreatic metastasis from osteosarcoma and Ewing sarcoma:literature review[J].Scand J Gastroenterol,2013,48(1):4-8.
[2]Fuchs B,Zhang K,Schabel A,et al.Identification of twenty-two candidate markers for human osteogenic sarcoma[J].Gene,2001, 278(1-2):245-252.
[3]Longhi A,Errani C,De Paolis M,et al.Primary bone osteosarcoma in the pediatric age:state of the art[J].Cancer Treat Rev,2006,32 (6):423-436.
[4]Scotlandi K,Serra M,Nicoletti G,et al.Multidrug resistance and malignancy in human osteosarcoma[J].Cancer Res,1996,56(10):2434-2439.
[5]Windsor RE,Strauss SJ,Kallis C,et al.Germline genetic polymorphisms may influence chemotherapy response and disease outcome in osteosarcoma:a pilot study[J].Cancer,2012,118(7):1856-1867.
[6]Sharma R,Yang Y,Sharma A,et al.Antioxidant role of glutathione S-transferases:protection against oxidant toxicity and regulation of stress-mediated apoptosis[J].Antioxid Redox Signal,2004,6(2):289-300.
[7]Board PG,Menon D.Glutathione transferases,regulators of cellular metabolism and physiology[J].Biochim Biophys Acta,2013,1830 (5):3267-3288.
[8]Wang X,Zuckerman B,Pearson C,et al.Maternal cigarette smoking,metabolic gene polymorphism,and infant birth weight[J].JAMA,2002,287(2):195-202.
[9]Higgins JP,Thompson SG.Quantifying heterogeneity in a meta-analysis[J].Stat Med,2002,21(11):1539-1558.
[10]Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[11]Yang LM,Li XH,Bao CF.Glutathione S-transferase P1 and DNA polymorphisms influence response to chemotherapy and prognosis of bone tumors[J].Asian Pac J Cancer Prev,2012,13(11):5883-5886.
[12]Liu S,Yi Z,Ling M,et al.Predictive potential of ABCB1,ABCC3, and GSTP1 gene polymorphisms on osteosarcoma survival after chemotherapy[J].Tumour Biol,2014,35(10):9897-9904.
[13]Li JZ,Tian ZQ,Jiang SN,et al.Effect of variation of ABCB1 and GSTP1 on osteosarcoma survival after chemotherapy[J].Genet Mol Res,2014,13(2):3186-3192.
[14]Teng JW,Yang ZM,Li J,et al.Predictive role of glutathione S-transferases(GSTs)on the prognosis of osteosarcoma patients treated with chemotherapy[J].Pak J Med Sci,2013,29(5):1182-1186.
[15]Barnette P,Scholl R,Blandford M,et al.High-throughput detection of glutathione s-transferase polymorphic alleles in a pediatric cancer population[J].Cancer Epidemiol Biomarkers Prev,2004,13(2):304-313.
[16]Islam MS,Islam MS,Parvin S,et al.Effect of GSTP1 and ABCC4 gene polymorphisms on response and toxicity of cyclophosphamide-epirubicin-5-fluorouracil-based chemotherapy in Bangladeshi breast cancer patients[J].Tumour Biol,2015,DOI 10.1007/s13277-015-3211-y
[17]Rudolph A,Hein R,Hoffmeister M,et al.Copy number variations of GSTT1 and GSTM1,colorectal cancer risk and possible effect modification of cigarette smoking and menopausal hormone therapy[J].Int J Cancer,2012,131(5):E841-848.
[18]Wang Z,Chen JQ,Liu JL,et al.Polymorphisms in ERCC1,GSTs, TS and MTHFR predict clinical outcomes of gastric cancer patients treated with platinum/5-Fu-based chemotherapy:a systematic review[J].BMC Gastroenterol,2012,137(12):1-13.
[19]Goricar K,Kovac V,Jazbec J,et al.Genetic variability of DNA repair mechanisms and glutathione-S-transferase genes influences treatment outcome in osteosarcoma[J].Cancer Epidemiol,2015,39 (2):182-188.
[20]Salinas-Souza C,Petrilli AS,de Toledo SR.Glutathione S-transferase polymorphisms in osteosarcoma patients[J].Pharmacogenet Genomics,2010,20(8):507-515.
[21]Ekhart C,Rodenhuis S,Smits PH,et al.An overview of the relations between polymorphisms in drug metabolising enzymes and drug transporters and survival after cancer drug treatment[J].Cancer Treat Rev,2009,35(1):18-31.
Gene polymorphism of glutathion S-transferase and chemosensitivity of osteosarcoma in Chinese population:a meta-analysis.
QUAN Zhong1,WANG Shuai2,LIU Yi1.1.Department of Orthopedics,the First Hospital of Laohekou, Laohekou 441800,Hubei,CHINA;2.Department of Orthopedics,the 477 Hospital of Chinese People's Liberation Army, Xiangyang 441800,Hubei,CHINA
ObjectiveTo evaluate the gene polymorphism of glutathion S-transferase(GSTT1,SGTM1, GSTP1)and chemosensitivity of osteosarcoma in Chinese population in order to obtain a more precise and comprehensive estimation of the telationshion.MethodsAn independently comprehensive electronic online search was conducted in PubMed,Embase,the Cochrane Library,Web of Science,the China National Knowledge Infrastructure(CNKI), VIP,Wanfang Data,and the Chinese Biomedicine Database(CBD)to collect studies regarding glutathion S-transferase and chemosensitivity of osteosarcoma in Chinese population.The data were screened based on the inclusion and exclusion criteria,and the qualified studies were evaluated.The pooled odds ratios(OR)with 95%confidence intervals were calculated using RevMan 5.3 and Stata 12.0 software.Publication bias and sensitivity analysis were also performed.ResultsInitially,4 potentially relevant publications containing 12 separate studies involving 681 cases were included in the current meta-analysis.Resultsshowed that the GSTT1(Null vs Present,OR=0.92,95%CI=0.68~1.25,P=0.59),GSTM1(Null vs Present OR=0.93,95%CI=0.68~1.26,P=0.63),GSTP1(GG vsAA+AG,OR=0.61,95%CI= 0.34~1.11,P=0.11)polymorphism was not associated with chemosensitivity of osteosarcoma in Chinese population(P>0.05).However,the robustness of the meta-analysis results of GSTP1 polymorphism was poor.ConclusionThe current meta-analysis demonstrates that the GSTT1,GSTM1 GSTP1 polymorphism may be not related to chemosensitivity of osteosarcoma in Chinese population.Further studies with a larger sample size are needed to determine the association of GSTP1 polymorphism and the chemosensitivity of osteosarcoma.
Osteosarcoma;Glutathion S-transferase;Gene polymorphism;Meta-analysis
R738
A
1003—6350(2015)21—3229—05
2015-04-20)
10.3969/j.issn.1003-6350.2015.21.1175
全 忠。E-mail:Qzh_lhk@163.com

