自转向酸稠化剂两性双子表面活性剂的合成及酸岩反应动力学研究
陈馥,罗娇,吴柯颖
(西南石油大学 化学化工学院,四川 成都 610500)
自转向酸是基于粘弹性表面活性剂的酸液体系,随着酸岩反应的进行,自转向酸体系在地层中稠化,并形成胶束,使体系黏度增大,对高渗透地层起到暂堵作用,使酸液继续向低渗透地层流动,起到分流转向的作用,减少了酸液的滤失,增加了酸液的有效作用距离。而且,当酸液体系遇到原油等烃类物质时会自动破胶,易于返排[1-3]。目前,国内用于自转向酸的表面活性剂主要有VES-1、VDA-08、SDVA、SAP-BET、BNS、VDA-SL、VDA[4-10],主要为传统的两性表面活性剂。
双子表面活性剂因其有着比传统表面活性剂更加优异的性能而受到广泛地关注。然而,目前双子表面活性剂在我国还处于研究阶段,关于两性离子型双子表面活性剂的研究和报道都较少,更未进行大规模生产,若能探究其合成工艺使生产成本降低,将会在多个领域取代传统表面活性剂。
本文以乙二胺、溴代十四烷、氯乙酸钠和碘甲烷为原料,经烷基取代、羧基取代、季铵化三步反应,合成了两性离子型双子表面活性剂SCB-14,测定了SCB-14 在不同浓度酸液体系中的黏度、酸岩反应动力学参数,并与普通盐酸体系进行了对比,对将两性离子型双子表面活性剂应用到自转向酸领域和进行大规模生产都具有重要的学术价值和现实指导意义。
1 实验部分
1.1 试剂与仪器
溴代十四烷、氯乙酸钠均为化学纯;乙二胺、氢氧化钠、无水乙醇、盐酸、无水氯化钙、无水氯化镁、四苯硼钠、达旦黄、碘甲烷均为分析纯;缓蚀剂、铁离子稳定剂、粘土稳定剂均为工业品。
ZNN-D6B 电动六速粘度计;BZY-1 全自动界面张力仪;Paragon-1000 傅里叶红外光谱仪;Bruker AVANCE ⅢHD 400 MHz 核磁共振波谱仪。
1.2 SCB-14 合成
1.2.1 N,N'-二(正十四烷基)乙二胺(即二元仲胺)的合成 圆底烧瓶中加入乙二胺6 g(0.1 mol),乙醇50 mL,磁子搅拌,安装回流冷凝装置,缓慢滴加溴代十四烷55.4 g(0.2 mol),在70 ℃回流反应6 h。趁热将产物倒入分液漏斗中,加入氢氧化钠溶液洗涤,静置分层。收集有机层,旋蒸后再用无水乙醇重结晶,得到白色固体,产率83%。
1.2.2 N,N'-二(正十四烷基)-N,N'-二(乙酸基)乙二胺(即二元叔胺)的合成 圆底烧瓶中加入二元仲胺18 g(0.04 mol),去离子水-乙醇溶液作溶剂,磁子搅拌,安装回流冷凝装置,在65 ℃下,缓慢滴加17.7 g(0.15 mol)氯乙酸钠的高浓度氢氧化钠溶液,同时,缓慢滴加氢氧化钠水溶液,升温至90 ℃,回流反应10 h,溶液pH 保持在略偏碱范围内[11-16]。趁热将产物倒入分液漏斗中,静置分层。收集有机层,重结晶提纯,真空干燥,得淡黄色膏状物质,产率80%。
1.2.3 SCB-14 的合成 圆底烧瓶中加入二元叔胺12.24 g(0.02 mol),无水乙醇为溶剂,磁子搅拌,安装回流冷凝装置,缓慢滴加22.7 g(0.16 mol)碘甲烷,35 ℃下加热回流反应8 h。加入氢氧化钠溶液,60 ℃下反应3 h。趁热将产物倒入分液漏斗中,静置分层。收集有机层,旋蒸后重结晶,真空干燥,得淡黄色固体粉末,产率73%。
2 结果与讨论
2.1 合成条件的优选
2.1.1 二元仲胺的合成 通过单因素法和正交实验相结合的方法优选反应温度和反应时间,结果见表1。

表1 反应温度和反应时间对二元仲胺产率的影响Table 1 Reaction yield under different temperature and different reaction time
由表1 可知,最佳反应温度为70 ℃,反应时间为6 h,产率83%。
2.1.2 二元叔胺的合成 通过单因素法和正交实验相结合的方法优选反应温度、反应时间和反应物物料比,结果见表2。
由表2 可知,最佳反应温度90 ℃,反应时间10 h,反应物摩尔比为n(二元仲胺)∶n(氯乙酸钠)=1∶3.8,产率80%。
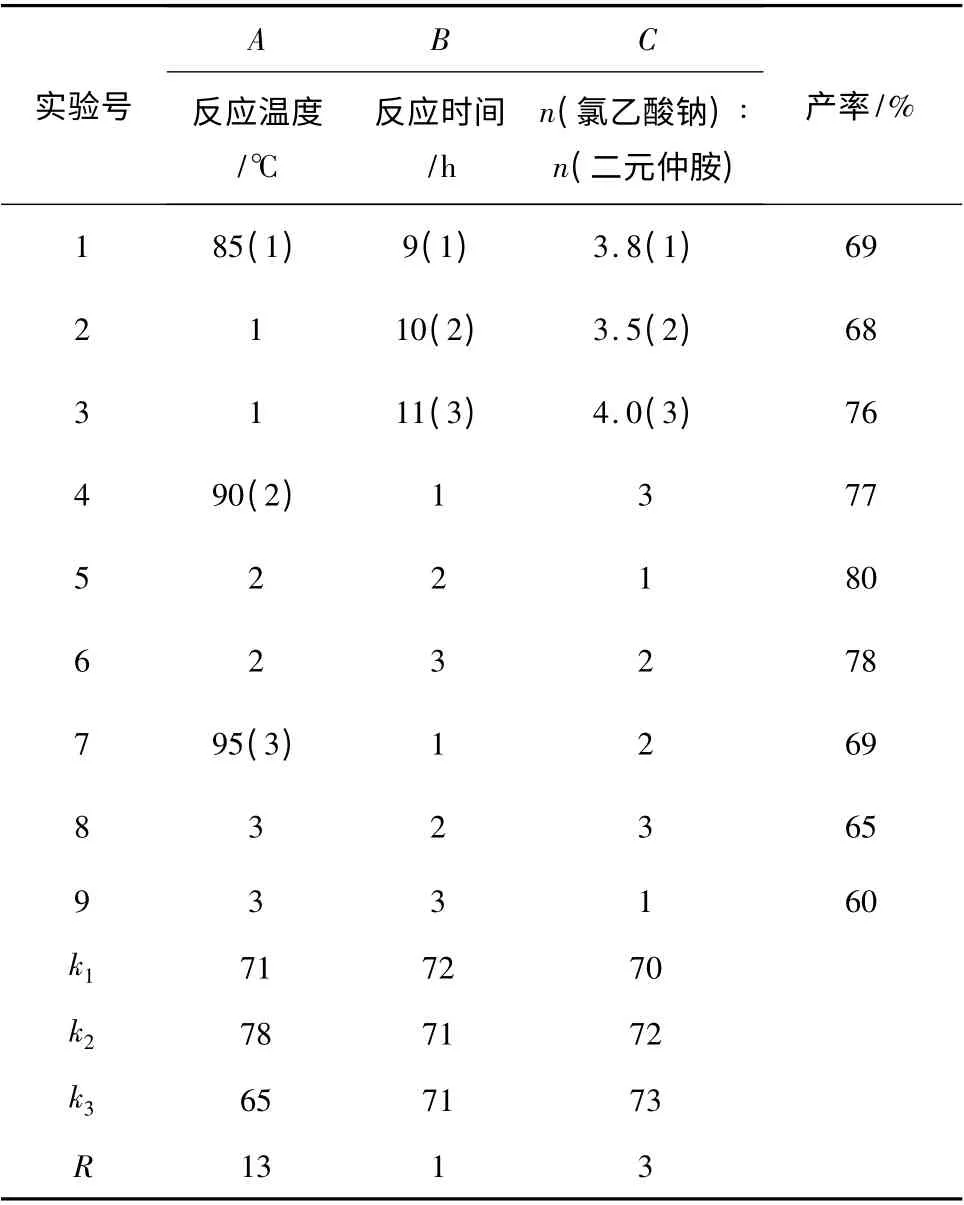
表2 反应温度、反应时间和反应物物料比对二元叔胺产率的影响Table 2 Reaction yield under different temperature,reaction time and different reactant molar ratio
2.1.3 季铵化反应 通过单因素法和正交实验相结合的方法优选反应温度、反应时间和反应物物料比,结果见表3。
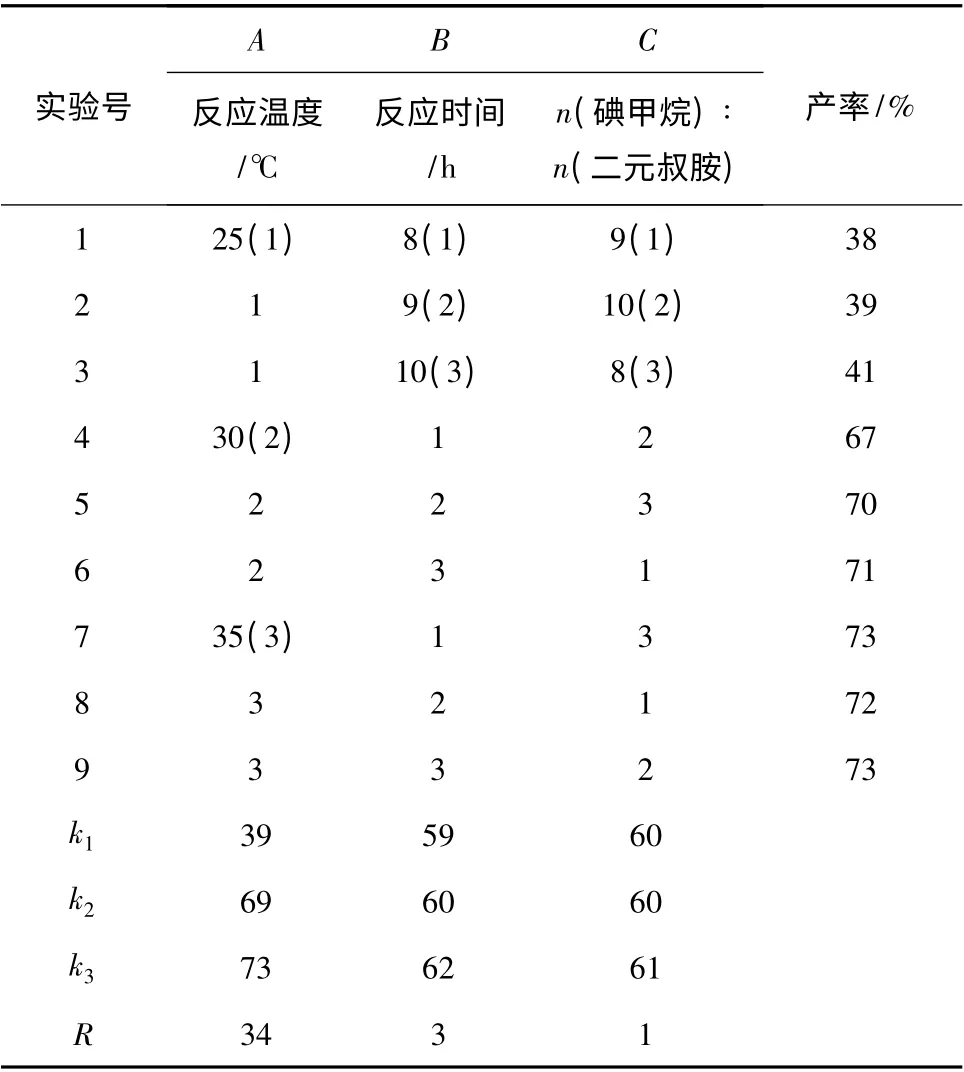
表3 反应温度、反应时间和反应物物料比对SCB-14 产率的影响Table 3 Reaction yield of SCB-14 under different temperature,reaction time and different reactant molar ratio
由表3 可知,最佳反应温度35 ℃,反应时间8 h,反应物摩尔比为n(二元叔胺)∶n(碘甲烷)=1∶8,产率73%。
2.2 产物的结构表征
2.2.1 红外表征 图1 为SCB-14 的红外谱图。
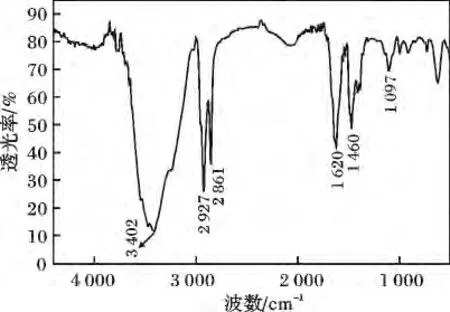
图1 SCB-14 红外光谱图Fig.1 IR spectra of SCB-14
由图1 可知,3 402 cm-1为─COOH 的O─H伸缩振动峰;2 861,2 927 cm-1为─CH2─的C─H伸缩振动吸收双峰;1 460,1 620 cm-1为 CO 伸缩振动峰;1 097 cm-1为C─N 伸缩振动峰。由以上吸收峰数据可知,合成的甜菜碱表面活性剂中含有相应的官能团。
2.2.21H NMR 谱图 图2 为SCB-14 的1H NMR谱图。
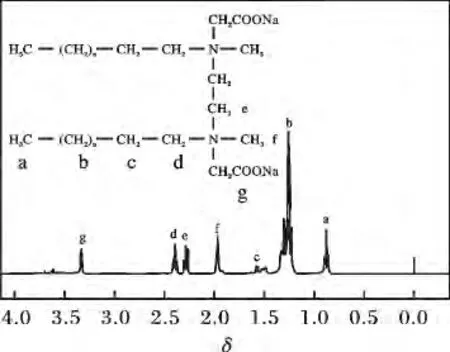
图2 SCB-14 的1H NMR 谱图Fig.2 1H NMR spectrum of SCB-14
由图2 可知,δ 0.88(t,6H,CH3─CH2─);1.17~1.44(m,46H,CH3─(CH2)11─);1. 5(m,4H,─(CH2)11─CH2─);2.39(t,4H,─CH2─CH2─N─);2.3(t,4H,─N─CH2─CH2─N─);3.34(s,4H,─N─CH2COONa);1.97(s,6H,─N─CH3)。
2.3 SCB-14 的表面性能
用纯水配制一系列不同浓度的SCB-14 溶液,在25 ℃下静置2 h,测定其表面张力,结果见图3。
由图3 可知,SCB-14 的CMC 为3.28×10-5mol/L,表面张力为29.46 mN/m,有较低的CMC 和γ 值,说明有较好的表面活性。

图3 SCB-14 的γ-logC 曲线图Fig.3 γ-logC curve of SCB-14
2.4 酸浓度对SCB-14 黏度的影响
在温度80 ℃、剪切速率170 s-1的条件下,测定了20 mL 不同质量分数盐酸中SCB-14 的增黏性能,结果见表4。
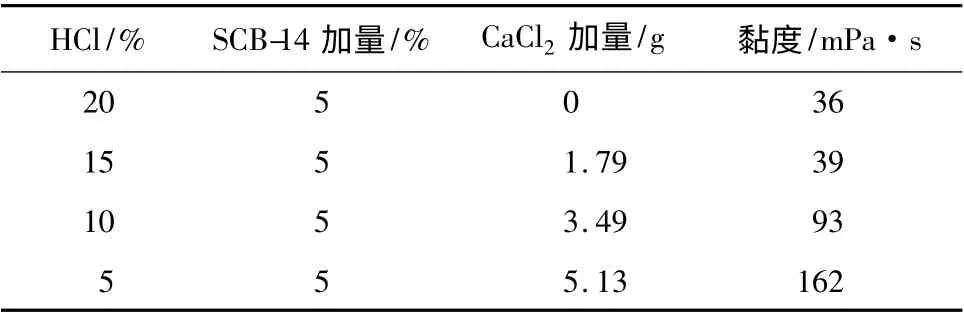
表4 SCB-14 在鲜酸中的黏度随体系盐酸质量分数的变化Table 4 The viscosity of SCB-14 under different mass fraction of hydrochloric acid
由表4 可知,随着酸岩反应的进行,盐酸质量分数降低,钙离子浓度增大,产生的二价阳离子和羧基阴离子基团相互交联,使得体系黏度增大,从而起到暂堵转向的作用。由此可见,SCB-14 具备作为粘弹性表面活性剂基自转向酸主剂的性能。
2.5 SCB-14 酸液体系酸岩反应动力学
2.5.1 酸岩反应动力学方程 酸岩反应是复相反应,在一定的温度和压力条件下,化学反应速率与反应物浓度的一定方次的乘积成正比,酸岩反应速率方程可表示为J=KCm
式中 J——反应速度,表示单位时间流到单位岩石面积上的物流量,mol/(s·cm2);
K——反应速度常数,(mol/L)-m·mol/(s·cm2);
C——酸液浓度,mol/L;
m——反应级数,无因次。
对方程两边取对数,得lgJ =lgK+mlgC。用lgJ和lgC 作图,得一直线,此直线的斜率为m,截距为lgK,即得酸岩反应动力学方程[16]。
在80 ℃、7.5 MPa、转速500 r/min 的条件下,通过旋转岩盘实验测定不同初始浓度的SCB-14 酸液体系与灰岩岩芯反应,用lgJ 和lgC 作图,得一直线(图4)。

图4 酸岩反应速率与SCB-14 酸液体系酸浓度关系图Fig.4 Relationship of concentration and reaction rate
由图4 可知,m =1.670 1,K =7.449 0 ×10-6。故反应速率方程为J=7.449 0 ×10-6C1.6701。
SCB-14 酸液体系和盐酸的酸岩反应动力学方程对比见表5。

表5 盐酸与SCB-14 酸液体系酸岩反应动力学方程对比Table 5 Comparison of acid rock reaction kinetics equation
由表5 可知,随着酸液体系黏度增大,反应速率常数K 明显降低。由于酸液体系黏度增大,导致酸液流动性变差,使得酸岩反应氢离子传质速率降低。

式中 J——反应速度,mol/(s·cm2);
De——氢离子有效传质系数,cm2/s;
ν——酸液平均运动黏度,cm2/s;
ω——旋转角速度,s-1;
Ct——时间为t 时酸液内部浓度,mol/L。
雷诺数与角速度有Re=ωR2/ν,其中Re 为旋转雷诺数,无因次;R 为岩盘半径,cm。为了应用方便,常作不同温度下的De-Re 曲线图。
在80 ℃、7.5 MPa、岩盘直径2.54 cm 的条件下,改变岩盘旋转角速度,分别测定初始浓度为5%的SCB-14 酸液体系和5%盐酸体系与灰岩岩芯反应的氢离子有效传质系数,结果见图5。
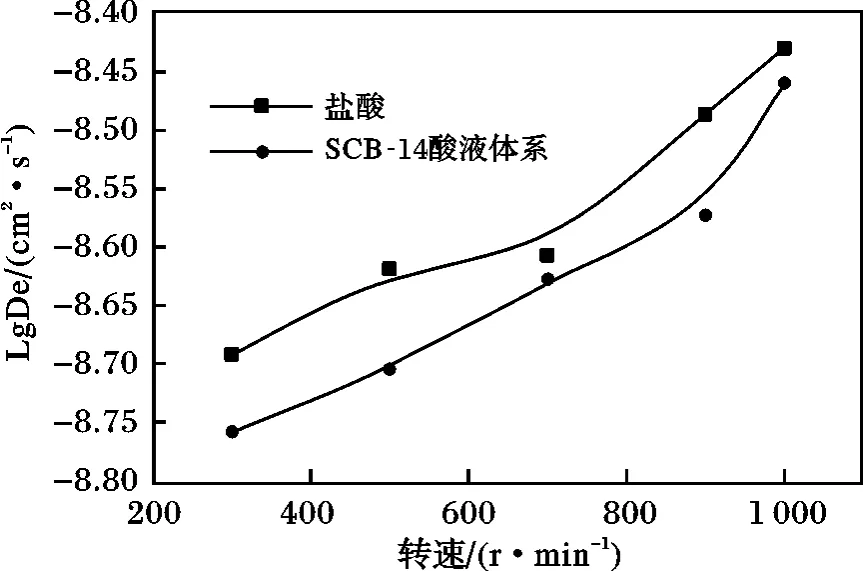
图5 盐酸与SCB-14 酸液体系氢离子传质系数与岩盘转速关系对比图Fig.5 Relationship of speed and mass transfer H + of different systems
由图5 可知,随着岩盘转速的增大,氢离子有效传质系数增大。在相同的转速下,随着酸液体系黏度的增大,氢离子传质系数减小。
2.5.3 酸岩反应活化能 酸岩反应过程中,温度对酸岩反应速率的影响较大,反应速率与温度存在的关系为:

将(3)式代入(1)式,并对方程两边取对数,得:
lgJ=lg(k0Cm)-(Ea/2.303R)(1/T)
式中 K——反应速度常数,(mol/L)-m·mol/(s·cm2);
K0——频率因子,(mol/L)-m·mol/(s·cm2);
Ea——酸岩反应活化能,J/mol;
R——摩尔气体常数,J/(mol·K);
T——绝对温度,K。
实验时,在酸液初始浓度不变的条件下,改变反应温度,作lgJ ~1/T 的关系图,由直线的截距和斜率可求出频率因子K0和反应活化能Ea。
在7.5 MPa、岩盘转速500 r/min 的条件下,改变反应温度,分别测定初始浓度为5%的SCB-14 酸液体系和5%盐酸体系与灰岩岩芯反应的酸岩反应活化能,结果见表6。

表6 盐酸与SCB-14 酸液体系酸岩反应活化能对比Table 6 Comparison of activation energy parameter of acid rock reaction
由表6 可知,在相同温度条件下,SCB-14 酸液体系因黏度更大,酸岩反应速率更低。
3 结论
(1)以乙二胺、溴代十四烷、氯乙酸钠和碘甲烷为原料,经烷基取代、羧基取代、季铵化三步反应,合成了十四烷基羧基甜菜碱型双子表面活性剂SCB-14,SCB-14 水 溶 液 在25 ℃时,CMC 为3. 28 ×10-5mol/L,表面张力为29.46 mN/m,具有较高的表面活性。
(2)在温度80 ℃,剪切速率170 s-1,盐酸质量分数5%,SCB-14 加量5%的条件下,SCB-14 的残酸黏度达162 mPa·s。
(3)SCB-14 酸液体系的酸岩反应动力学实验表明,酸液黏度的变化对酸岩反应速率影响较大。酸液体系黏度增大,酸岩反应速率降低。
[1] 李年银,赵立强,刘平礼.碳酸盐岩酸压过程中的酸液滤失研究[J].西部探矿工程,2006(3):109-111.
[2] Crowe C W,Hutchinson B H,Trittipo B L.Fluid-loss control:The key to successful acid fracturing[J]. SPE:16883,1989:215-220.
[3] 李侠清,齐宁,杨菲菲,等. VES 自转向酸体系研究进展[J].油田化学,2013,30(4):630-631.
[4] 赵增迎,杨贤友,连胜江,等. VES 自转向盐酸液变粘特性研究[J].油田化学,2005,22(4):307-309.
[5] 袁飞,张健强,王斌,等.VDA-08 表面活性剂盐酸体系变粘特性研究[J]. 新疆石油天然气,2008,4(3):79-83.
[6] 郑云川,赵立强,刘平礼,等. 两性表面活性剂酸液体系在基质酸化及酸压中的应用[J]. 天然气工业,2005,25(12):71-73.
[7] 郑云川,赵立强,刘平礼,等. 粘弹性表面活性剂胶束酸在砂岩储层分流酸化中的应用[J]. 石油学报,2006,27(6):93-95.
[8] 马代鑫,徐赋海,王增林,等. 变粘分流酸主剂油酸酰胺丙基甜菜碱的合成[J]. 特种油气藏,2009,16(3):89-91.
[9] 马利成,李爱山,张晓云,等. 新型粘弹性表面活性自转向酸的研制及性能评价[J]. 油气地质与采收率,2007,14(5):98-100.
[10]刘京,徐建华,乔煊威,等. 清洁自转向酸液的研制及性能评价[J].石油天然气学报,2009,31(3):302-305.
[11]黄智,李成海,梁宇宁,等.N,N'-双月桂酰基乙二胺二乙酸钠合成方法的改进[J]. 精细化工,2002,19(1):2-3.
[12]胡惠龄. 两性酰胺型表面活性剂的合成及性能研究[D].无锡:江南大学,2008:4-11.
[13]杨明,蒋惠亮,顾信鸽,等.十二烷基甘油醚羧酸盐阴离子表面活性剂的合成及性能研究[J].应用化工,2010,39(2):202-203.
[14]Zana,Raoul.Gemini Surfactants:Synthesis,Interfacial and Solution-Phase Behavior,and Applications[M]. New York:Marcel Dekker,2004:56-60.
[15] Dix L R. Sodium salts of bis(1-dodecenylsuccinamic acids):A simple route to anionic gemini surfactants[J].Journal of Colloid and Interface Science,2001,238(2):447-448.
[16]张智勇,丁云宏,赵常青,等.胶凝酸反应动力学试验研究[J].石油与天然气化工,2005(5):394-395.

