东海原甲藻抗体的制备及酶联免疫检测方法的建立
李成峰 , 甄 毓 刘材材, 秦 超, 冯 明, 王国善, 米铁柱
(1.中国海洋大学 环境科学与工程学院, 山东 青岛 266100; 2.海洋环境与生态教育部重点实验室, 山东青岛 266100; 3.国家海洋局 东海环境监测中心 , 上海 200137; 4.东华大学 化学化工与生物工程学院, 上海201620; 5.上海英基生物科技有限公司, 上海200137; 6.中国海洋大学 海洋生命学院, 山东 青岛 266100)
近年来, 面积超过1000 km2, 持续时间超过一个月的大规模赤潮时常在我国东海区域出现[1-3]。东海原甲藻(Prorocentrum donghaiense)属于甲藻纲(Dinophyceae)、原甲藻目(Prorocentrales)、原甲藻科(Prorocentraceae), 是引发东海赤潮暴发的优势藻种之一。在赤潮发生的早期,藻细胞密度相对较低且个体微小, 传统光学显微镜观察计数的方法主要用于对藻类的定性和分离, 但这种方法费时、费力、过程繁琐, 操作要求高, 不适合对赤潮暴发时大批量海水样品的检测。
近十几年来, 以抗体为基础的免疫检测方法逐渐发展成熟并应用于浮游藻类研究。Anderson等[4]制备了抑食金球藻(Aureococcus anophagefferens)的多克隆抗体, 利用免疫荧光技术研究该藻在美国东北海岸的分布。Nagasaki等、Vrieling等和 Adachi等陆续制备针对Gymnodinium nagasakiense[5]、Chattonella marina-[6]、Gyrodiniumcf.aureolum[7]和Alexandrium[8]甲藻的单克隆抗体, 实现了对相应海藻的定性鉴定和分类。Caron等[9]利用抗A.anophagefferens的特异性单克隆抗体, 建立了快速检测该藻的酶联免疫分析(enzyme-linked immunosorbent assay, ELISA)方法。Costas等[10]将针对微小亚历山大藻(A.minutum)的多克隆抗体与磁性微粒结合, 利用免疫磁性微粒技术对天然海水样品中的目的细胞进行分离。亓海刚等[11]建立了应用赤潮异弯藻(Heterosigma akashiwo)的特异性多克隆抗体检测该藻的间接ELISA方法。向军俭等[12]制备了针对赤潮异弯藻(H.akashiwo)、海洋卡盾藻(Chattonella ma-rina)、卵圆褐胞藻(Chattonelia ovata)和具齿原甲藻(Prorocentnmz dentatum)的抗血清, 用间接ELISA检测发现, 抗血清对各自藻体均有良好的特异性和亲和力, 与异种赤潮藻之间交叉反应较弱, 表明单种藻免疫获得的小鼠多克隆抗体可以特异性地与相应赤潮藻作用。这些研究表明, 抗体技术具有操作简单、精确度高的优点, 可以实现对赤潮藻的定性、定量分析, 对海洋环境监控具有重要意义。
目前, 国内外并未出现关于应用多克隆、单克隆抗体和酶联免疫检测方法定量检测东海原甲藻的报道。本研究首次采用针对东海原甲藻制备的单克隆和多克隆抗体, 利用双抗体 ELISA方法对东海原甲藻进行快速定量检测, 并且对实验方案进行了优化。
1 材料和方法
1.1 藻种培养
东海原甲藻(P.donghaiense)(分离于我国东海海域)、赤潮异弯藻(H.akashiwo)、柔弱角毛藻(Chaetoceros debilis)、纤细角毛藻 (C.gracilis)、裸甲藻(Gymnodiniumsp.)、米氏凯伦藻(Karenia mikimotoi)、血红哈卡藻(Akashiwo sanguinea)、中肋骨条藻(Skeletonema costatum)均由中国海洋大学提供,培养基为f/2培养基, 普通日光灯为光源, 光照/黑暗周期12h/12h, 光照强度4 000 lx, 培养温度20~25℃。
1.2 免疫原的制备
取适量东海原甲藻样品(100~500 mL)用 0.45 µm滤膜过滤, 记录体积。将得到的滤膜放入5 mL离心管, 加入2 mL磷酸盐缓冲液(PBS), 超声波破碎2 min,得到样品溶液。将样品溶液与等体积的弗氏完全佐剂充分乳化后作为免疫原备用。
1.3 抗体的制备
1.3.1 多克隆抗体的制备
实验用纯种新西兰白兔由中科院上海生物工程研究中心动物房提供并饲养。免疫前采血样作阴性对照, 每2只同种实验动物为一组, 共设两组。选取皮下多点和肌肉注射方式对家兔进行免疫。间隔两周加强免疫。三次免疫后耳动脉取血, ELISA检测抗体效价。最后一次免疫两周后颈动脉放血, 4 000 r/min离心5 min分离血清, 收集抗体保存于–20 ℃备用。
1.3.2 单克隆抗体的制备
在1.3.1获得的高效价多克隆抗体的基础上, 参照文献[13]的方法, 经过骨髓瘤细胞及饲养细胞的制备、细胞融合, 次黄嘌呤(H)、氨基蝶呤(A)、胸苷(T)和甘氨酸的完全培养液(HAT培养液)的选择培养,用间接ELISA方法特异性筛选细胞融合的阳性杂交瘤细胞, 接种到4只小鼠腹腔中, 进行抗体制备、纯化得到高纯度的单克隆抗体。
1.4 ELISA方法试验条件的优化
参照文献[14]的方法, 确定酶标二抗、单克隆抗体以及多克隆抗体的最佳工作浓度, 封闭液用2%的牛血清蛋白溶液, 选择37℃封闭2 h作为封闭时间。
双抗体ELISA方法如下: 将单抗包被于96孔板,4℃包被过夜, 次日洗板; 加入封闭液, 37℃封闭2 h后洗板; 加入待测抗原, 37℃, 1.5 h后洗板; 加入多克隆抗体, 37℃, 1.5 h后洗板; 加入酶标二抗温育45 min,添加TMB显色液(北京博奥森生物技术有限公司)和终止液后检测A450值。
1.5 标准曲线的制备
根据实验所得的最佳实验条件, 用制备的东海原甲藻的单克隆抗体、多克隆抗体和已知浓度藻细胞(密度分别为 32×103、16×103、8×103、4×103、2×103、0×103个/mL), 用双抗体ELISA实验方法进行测定。以藻细胞浓度为横坐标,A450为纵坐标, 绘制标准曲线, 确定最小检出限度。
1.6 模拟样品的双抗体ELISA定量检测
海藻样品分为两组: 第一组纯种样品: 将只含有东海原甲藻的培养液稀释至 104个/mL; 第二组混合样品: 在多种藻(不含测试的目标藻)混合浓度为 104个/mL的培养液中加入要检验的目标藻, 使目标藻浓度约为104个/mL。按1.4确定的最佳工作浓度和步骤进行双抗体 ELISA检验, 标准样品设置三个平行样, 选取曲线方程决定系数R2值大于0.995的作为检测标准曲线。检测样品设置 10个平行样,根据检测得到的吸光度值计算得到细胞浓度, 与显微镜直接计数进行比较。
1.7 现场样品的双抗体ELISA定量检测
2013年7月至10月, 采集现场样品(采样站位如图1)。图中 A点是东海赤潮监控海区采样点(122°36′48″E, 30°49′04″N), 间隔两周采样一次。B点是嵊泗海水浴场(南长涂海水浴场)采样点(122°27′55″E, 30°41′49″N), 每天采样。样品处理:取2 L左右样品, 用0.45 µm的醋酸纤维膜过滤, 得到滤膜, 记录体积。将得到的滤膜放入5 mL离心管中, 加入 2 mL 磷酸盐缓冲液, 超声波破碎 2 min,得到待检测的样品溶液, 4℃保存备用。

图1 现场样品采样站位Fig.1 Map of sampling station sites
将待测样品进行双抗体 ELISA检验, 方法和步骤同 1.4, 标准样品设置三个平行样, 根据检测得到的吸光度值由标准曲线计算细胞浓度。另取一份样品进行镜检, 两组结果进行比较以验证检测结果。
2 结果分析
2.1 抗体效价
图2和图3是东海原甲藻多克隆抗体和单克隆抗体的抗血清效价检测结果。图2中兔1、兔2血清中的多克隆抗体在稀释倍数<23 000时, 吸光度值均大于 1.0, 具有很高效价。阴性对照 1和阴性对照2的吸光度值均小于 0.4, 与抗体的试验结果存在明显差异, 影响不显著。所以, 可以得出由东海原甲藻制备的兔血清中多克隆抗体的效价是23 000。图3中结果显示, A、B、C、D四只小鼠在单克隆抗体稀释倍数低于16 000时, 吸光度值大于1.0, 可以得出小鼠血清中单克隆抗体的效价是16 000。

图2 东海原甲藻多克隆抗体效价Fig.2 Polyclonal antibody titers of P.donghaiense
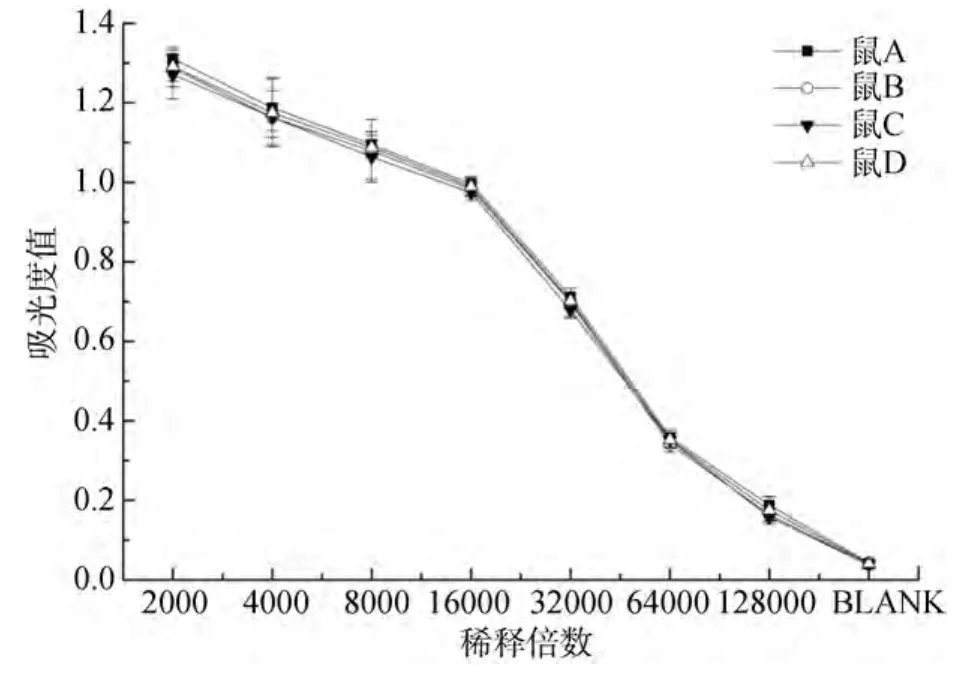
图3 东海原甲藻单克隆抗体效价Fig.3 Monoclonal antibody titer of P.donghaiense
2.2 ELISA试验条件的选择
酶标二抗的稀释倍数为5 000倍时, 检测得到的吸光度值为0.998, 最接近 1.0, 确定酶标二抗的最佳工作浓度为1∶5 000(表1)。当单抗浓度为1∶4 000, 多抗浓度为1∶2 000, 检测得到的吸光度值为0.996, 最接近于1.0, 同时阴性检测数值小于 0.1, 确定单抗和多抗的最佳工作浓度分别为1∶4 000和1∶2 000(表2)。

表1 不同浓度酶标二抗A450值Tab.1 The absorbance of secondary antibody labeled with different percentage of enzyme
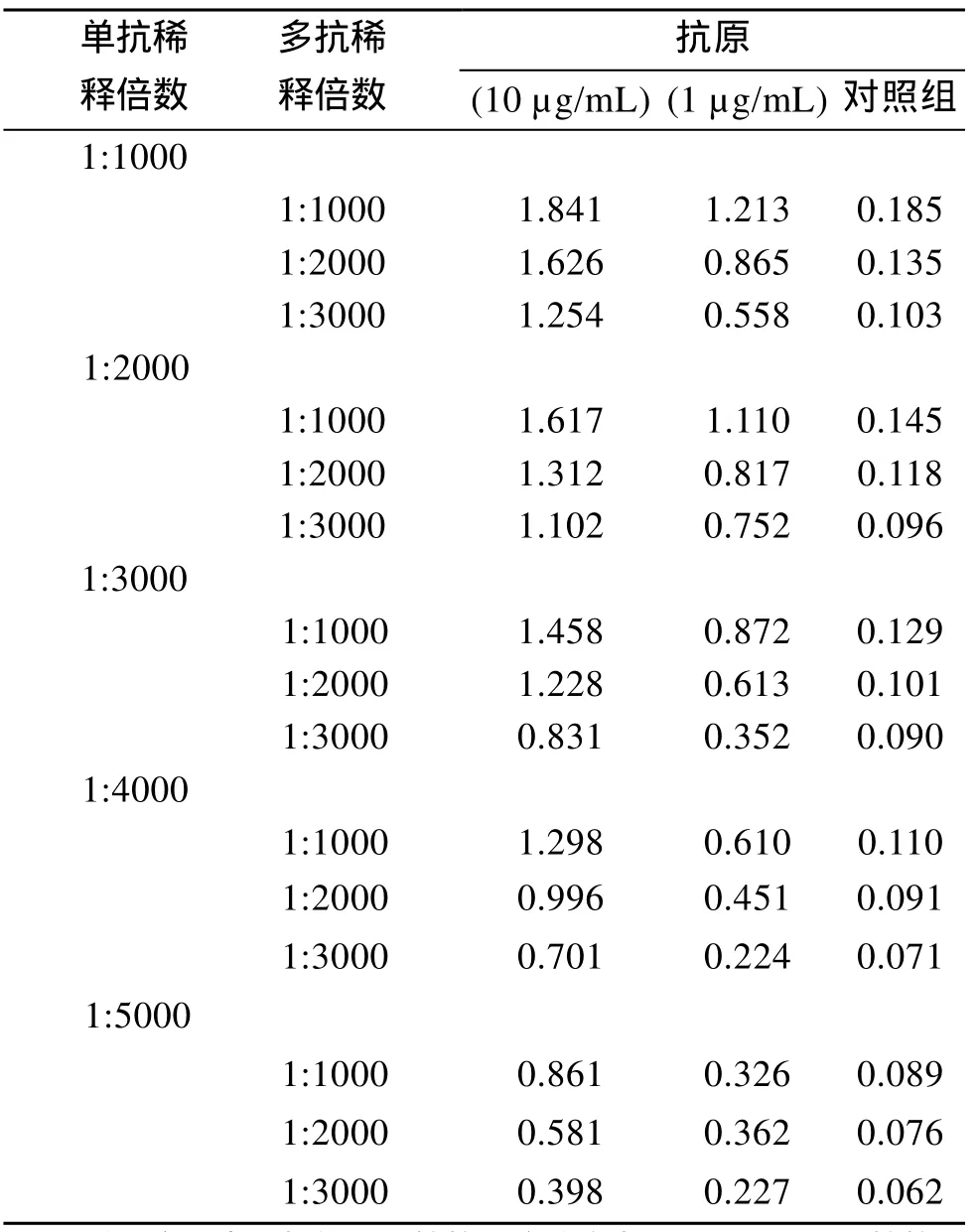
表2 棋盘法比色结果Tab.2 Results of checkerboard method
2.3 标准曲线
将标准样品进行双抗体 ELISA检测, 得到标准曲线方程为y=0.0521x+0.0536,R2=0.999, 大于0.995(图4)。浓度稀释到 1×103个/mL时, 检测得到的吸光度值已经小于0.1, 和标准曲线浓度为0时的数值很接近, 所以此方法的最低检出限为1×103个/mL。

图4 双抗体ELISA检测标准曲线Fig.4 Standard curve of double antibodies sandwich ELISA
2.4 模拟样品检测
试验证明, 本研究建立的双抗体 ELISA检测方法对单一藻种样品的检测结果与镜检得到的“真实”浓度基本一致, 相对误差小于 30%(平均值在(1±30%)μ范围内,µ为平均值)。经过t检验, sig 值小于 0.05, 没有显著性差异, 结果如表3, 达到了定量检测准确度的指标要求。并且该方法在对混合藻种样品的检测中表现出良好的特异性(表4), 不会受其他藻种的影响, 表明该方法可以实现对东海原甲藻的快速定性、定量检测。

表3 单一藻种样品检测结果Tab.3 The test results of pure strains
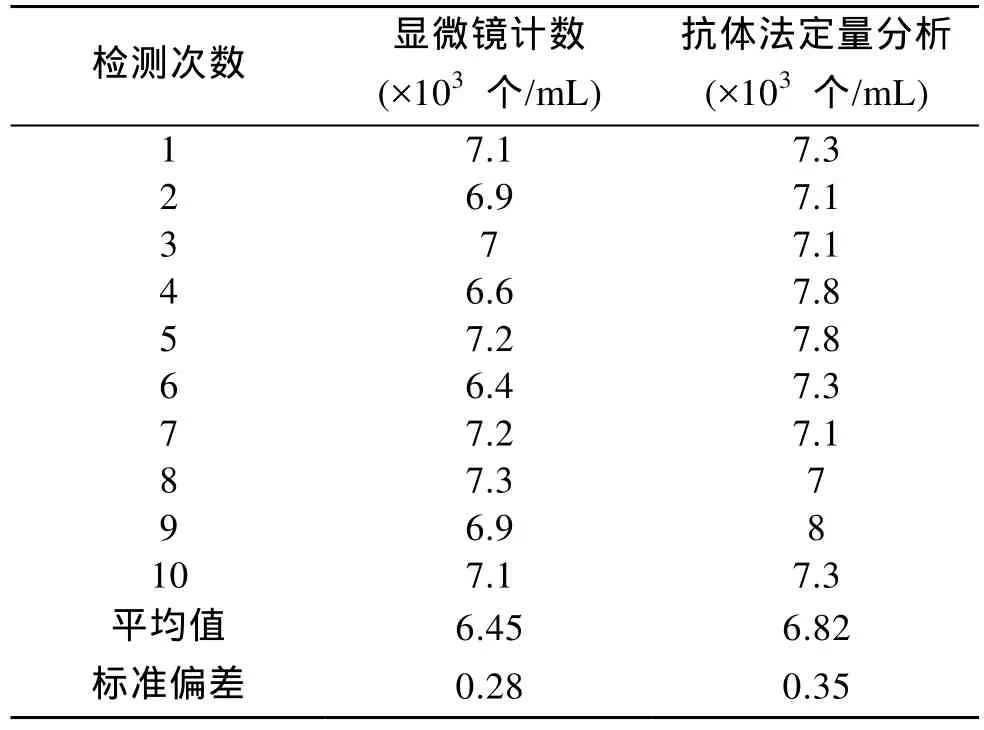
表4 在其他混合藻液中加入东海原甲藻的检测结果Tab.4 The test results of P.donghaiense in other microalgae solutions
2.5 现场试验结果
由于赤潮监控海区数据变化范围较大, 对抗体定量法计算和显微镜直接计数得到的数据进行对数处理后, 以显微镜观测数值为x轴, 抗体定量检测计数为y轴, 得到以下曲线(图5、图6)显微镜计数和抗体定量法检测得到藻细胞浓度数据具有高度的一致性, 相关系数分别为 0.998和 0.992, 具有良好的正相关关系。证明本实验建立的酶联免疫检测技术可以和显微镜计数一样, 较准确地检测样品中东海原甲藻的细胞浓度。
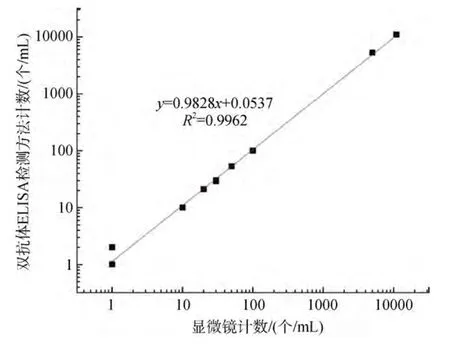
图5 赤潮监控海区东海原甲藻显微镜计数和抗体检测计数结果Fig.5 Microscope counting and antibody detection counting results of P.donghaiense in Red Tide Monitoring Sea
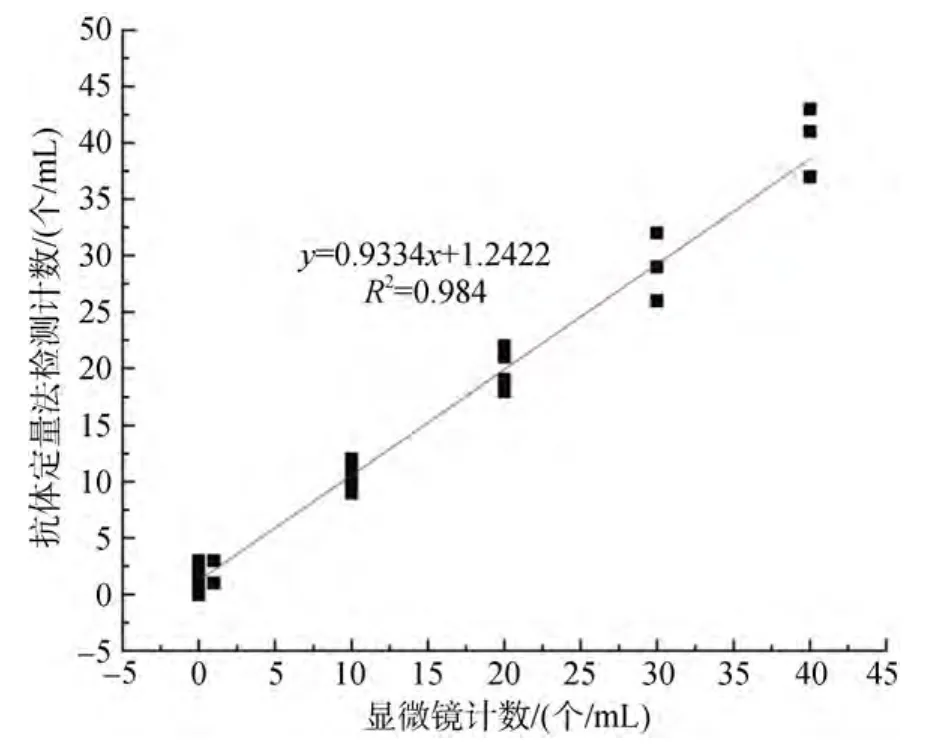
图6 嵊泗海水浴场东海原甲藻显微镜计数和抗体检测计数结果Fig.6 Microscope counting and antibody detection counting results of P.donghaiense in ShengSi Beach
利用双抗体ELISA对2013年5月至9月赤潮监控海区东海原甲藻的密度进行检测(图7)。由图可以看出显微镜检测计数和抗体定量检测计数得到的曲线基本一致。东海原甲藻暴发时间是5月底至6月初, 最高浓度为 1.1×104个/mL。7月底至 9月也会有一定增长, 最高浓度约为1×102个/mL, 但未达到赤潮暴发的程度(约为5×103个/mL)。

图7 赤潮监控海区2013年5月-9月东海原甲藻浓度变化曲线Fig.7 The concentration curve of P.donghaiense in Red Tide Monitoring Sea from May to September, 2013.
同样利用该方法检测嵊泗海水浴场7月至9月东海原甲藻细胞密度(图8~图10)。在 7月下旬、8月初、8月中旬和9月中旬东海原甲藻都保持了较高的细胞密度, 8月最高(约为40 个/mL), 远小于赤潮监控海区的细胞浓度, 并且暴发时间相对较晚。分析其原因可能在于: ①海水温度的影响, 近海地区温差变化大。②受潮汐作用的影响, 可将外海的浮游植物带到近海, 导致近海地区藻细胞浓度增加, 且时间延后。

图8 嵊泗海水浴场2013年7月东海原甲藻浓度变化曲线Fig.8 The concentration curve of P.donghaiense in Shengsi beach in July 2013
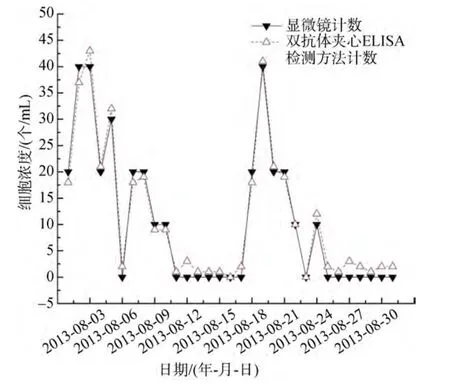
图9 嵊泗海水浴场2013年8月东海原甲藻浓度变化曲线Fig.9 The concentration curve of P.donghaiense in Shengsi beach in August 2013

图10 嵊泗海水浴场2013年9月东海原甲藻浓度变化曲线Fig.10 The concentration curve of P.donghaiense in Shengsi beach in September 2013
3 讨论
近年来, 赤潮的频繁出现[15]对经济及海洋生态系统造成了重大影响, 因此建立赤潮早期预报系统就显得尤为重要。目前, 除了抗体定量检测赤潮藻外,还有PCR技术和rRNA探针技术[16]。PCR技术需要高质量纯化的 DNA, 目前试验存在 DNA纯化效率低及效率不稳定的缺点, 在很大程度上影响了分析的准确性。Lin等[17]发现, 相对于PCR检测技术, 免疫学检测方法的灵敏性略低, 但对较高细胞密度的检测结果更为稳定, 不会受到样品中其他藻类和悬浮物质的影响, 可以实现小样本大批量的样品检测。Anderson 等[18]通过对比试验发现, 相对于 rRNA探针技术, 抗体检测方法操作要求低, 结果稳定性高,不易受外界条件影响。因此, 在免疫学基础上建立的针对东海原甲藻的双抗体 ELISA检测方法, 在理论和技术上都是可行的, 具有较大的发展潜力, 为赤潮检测和研究提供了新的技术方法。
免疫学方法的优势在于不需要对自然海水样品进行过多预处理就可以进行测定; 单抗的制备步骤相对简单、成本也较低廉; 单克隆抗体技术的发展使制备高特异性、高度均一的抗体成为可能; 封闭抗体技术则使多克隆抗体的应用价值得到极大提高[19]。利用抗体免疫检测方法对海藻细胞进行定性定量检测的一个障碍就是需要特异性的抗体。本实验成功制备了特异性的单克隆抗体和多克隆抗体。实验过程中, 免疫动物没有发生意外死亡情况, 在第四次免疫之后产生的抗体就表现出很高的亲和力。本研究建立的双抗体ELISA检测方法标准曲线的相关系数为0.999, 线性关系良好, 检测限为1×103个/mL。模拟样品和现场实验表明, 该方法可以对东海原甲藻进行定性、定量检测并且不会受到海水中其他海藻和悬浮颗粒物的影响, 检测结果与镜检结果相吻合, 检测过程只需要几个小时。
本研究建立的针对东海原甲藻的双抗体 ELISA检测方法可以实现对该藻的快速定量检测, 但是海洋中的海藻种类繁多, 目前的特异性验证对象只是针对常见藻种, 对于一些其他藻种的影响还有待进一步验证; 灵敏度不是很高, 方法还需要进一步完善。本实验室 Xin等[20]、亓海刚等[11]分别用竞争型ELISA方法和间接 ELISA方法实现了对裸甲藻(Gymnodiniumsp.)和赤潮异弯藻(H.akashiwo)的定量检测; Fabienne等[21]利用特异性单克隆抗体, 建立了微小亚历山大藻(Alexandrium minutum)全细胞快速检测的 ELISA方法。与其相比, 本研究建立的双抗体ELISA方法具有特异性好、不易受外界因素干扰、稳定性好的优点, 在一定程度上反应赤潮暴发的情况, 对中国近海赤潮暴发的实时监控具有重要意义。特别是可以据此研制出标准化的ELISA检测试剂盒, 可使东海原甲藻的检测更为简便。
[1] 王金辉, 黄秀清.具齿原甲藻的生态特征及赤潮成因浅析[J].应用生态学报, 2003, 14(7): 1065-1069.
[2] 陈翰林, 吕颂辉, 张传松, 等.2004 年东海原甲藻赤潮爆发的现场调查和分析[J].生态科学, 2006, 25(3):226-230.
[3] 龙华, 周燕, 余俊, 等.2001~2007年浙江海域赤潮分析[J].海洋环境科学, 2008, 27(增刊): 1-4.
[4] Anderson D M, Keafer B A, Kulis D M, et al.An immunofluorescent survey of the brown tide chrysophyteAureococcus anophagefferensalong the northeast coast of the United States[J].Journal of Plankton Research,1993, 15(5): 563-580.
[5] Nagasaki K, Uchida A, Ishida Y.A monoclonal antibody which recognize the cell surface of red tide algaGymnodinium nagasakiense[J].Nippon Suisan Gakkaishi, 1991, 57(6): 1211-1214.
[6] Nagasaki K, Uchida A, Hiroishi S, et al.An epitope recognized by the monoclonal antibody MR-21 which is reactive with the cell surface ofChattonella marinatype II[J].Nippon Suisan Gakkaishi, 1991, 57(5):885-890.
[7] Vrieling E G, Peperzak L, Gieskes W W C, et al.Detection of the icthyotoxic dinoglagellateGyrodiniumcf.aureolumand morphologically relatedGymnodiniumspecies using monoclonal antibodies: a specific immunological tool[J].Mar.Ecol.Prog.Ser., 1994, 103:165-174.
[8] Adachi M, Sako Y, Ishida Y, et al.Cross-reactivity of five monoclonal antibodies to various isolates ofAlexandriumas determined by an indirect immunofluorescence method[J].Nippon Suisan Gakkaishi, 1993,59: 1807.
[9] Caron D A, Dennett M R, Moran D M, et al.Development and Application of a Monoclonal-Antibody Technique for CountingAureococcus anophagefferens, an Alga Causing Recurrent Brown Tides in the mid-Atlantic United States[J].Applied and Environmental Microbiology, 2003, 69(9): 5492-5502.
[10] Costas E, Lopez-Rodas V.Enumeration and separation of the toxic dinoflagellateAlexandrium minutumfrom natural samples using immunological procedures with blocking antibodies[J].Journal of Experimental Marine Biology and Ecology, 1996, 198(1): 81-87.
[11] 亓海刚, 米铁柱, 辛泽毓, 等.赤潮异弯藻抗体的制备及酶联免疫检测方法的建立[J].海洋学报, 2006,28(5): 167-172.
[12] 向军俭, 凌钦婕, 吕颂辉, 等.四种赤潮藻多克隆抗体的制备及特异性分析[J].暨南大学学报: 自然科学与医学版, 2005, 26(5): 700-704.
[13] 吕闯, 朱远茂, 董秀梅, 等.牛副流感病毒3型NP单抗制备及固相阻断 ELISA 的建立和应用[J].中国农业科学院, 2012.
[14] 卢燕, 何绮霞, 蔡树云, 等.检测可溶性 TREM-1的ELISA法的建立及初步应用[J].中国免疫学杂志,2012, 28(9): 821-824.
[15] 佟蒙蒙.我国赤潮的分型分级及赤潮灾害评估体系[J].广州: 暨南大学, 2006.
[16] Scholin C A, Marin R III, Miller P E, et al.DNA probes and a receptor binding assay for detection ofPseudo-nitzschia(Bacillariophyceae) species and domoic acid activity in cultured and natural samples[J].Journal of Phycology, 1999, 35: 1356-1367.
[17] Lin S J, Feinstein T N, Zhang H, et al.Development of an immunofluorescence technique for detectingPfiesteria piscicida[J].Harmful Algae, 2003, 2(3): 223-231.
[18] Anderson D M, Kulis D M, Keafer B A, et al.Detection of the toxic dinoflagellateAlexandrium fundyense(Dinophyceae) with oligonucleotide and antibody probes: variability in labeling intensity with physiological condition[J].Journal of Phycology.1999, 35: 870-883.
[19] Mendoza H, Lopez-Rodas V, Gonztiez-Gil S, et al.The use of polyclonal antisera and blocking of antibodies in the identification of marine dinoflagellates: speciesspecific and clone-specific antisera againstGymnodiniumandAlexandrium[J].Journal of Experimental Marine Biology and Ecology, 1995, 186(1): 103-115.
[20] Xin Z Y, Yu Z G, Wang T C, et al.Identification and quantification of the toxic dinoflagellateGymnodiniumsp.with competitive enzyme-linked immunosorbent assay (cELISA) [J].Harmful Algae, 2005, 4(2):297-307.
[21] Fabienne Gas, Laetitia Pinto, Béatrice Baus, et al.Monoclonal antibody against the surface ofAlexandrium minutumused in a whole-cell ELISA[J].Harmful Algae, 2009, 8(3): 538-545.

