通络醒脑泡腾片对VD模型大鼠海马细胞色素C氧化酶表达的影响*
任香怡,胡 勇,魏江平,马云桐,徐世军△
(1.四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137; 2.成都中医药大学,成都 611137)
通络醒脑泡腾片对VD模型大鼠海马细胞色素C氧化酶表达的影响*
任香怡1,2,胡 勇1,2,魏江平1,2,马云桐1,2,徐世军1,2△
(1.四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137; 2.成都中医药大学,成都 611137)
目的:考察通络醒脑泡腾片对VD模型大鼠海马细胞色素C氧化酶表达的影响。方法:2-VO永久性结扎法制作VD大鼠模型,采用Morris水迷宫检测大鼠的学习记忆能力,采用免疫组织化学和图像分析技术测定海马细胞色素C氧化酶的表达。结果:通络醒脑泡腾片能显著缩短模型大鼠的逃避潜伏期,增加第一象限进入次数百分比,减少第三象限进入次数百分比,缩短总游泳路程,增强海马细胞色素C氧化酶阳性表达,显著增高其平均光密度值,与模型对照组比较差异有统计学意义。结论:通络醒脑泡腾片改善VD模型大鼠学习记忆能力与促进海马细胞色素C氧化酶的表达有关。
通络醒脑泡腾片;血管性痴呆;细胞色素C氧化酶
血管性痴呆(Vascular Dementia,VD)是由脑血管疾病导致的记忆、认知功能障碍的临床综合征,其病理和临床表现与阿尔茨海默病(AD)具有高度关联性,近年来引起研究者的广泛关注。研究发现,线粒体产能障碍是VD慢性脑缺血后产生的早期损伤级联反应,可通过下调代谢相关酶活性[1]、刺激氧化应激损伤加速VD的病理进程[2]。细胞色素C氧化酶(Cytochrome C Oxidase,CCO)作为线粒体跨膜整合蛋白,其活性是线粒体能量代谢障碍的内源性指标,也是神经元损伤程度的标志[3]。通络醒脑泡腾片是以古方芎归汤为基础创制的专利方药,由川芎、黄芩、当归组成,具有活血通络、醒脑通窍、解毒益智的作用。课题组前期研究发现,该制剂能改善小鼠痴呆模型的胆碱能神经功能[4],抑制AD大鼠海马Tau蛋白磷酸化关键调控蛋白CDK5和GSK-3表达[5],促进突触素重塑[6]和胰岛素降解酶[7]表达,改善神经病理损害和提高学习记忆能力。为进一步评价通络醒脑泡腾片抗痴呆的作用机制,本文探讨了其对2-VO双侧颈总动脉永久结扎痴呆模型大鼠海马CCO表达的影响。
1 实验材料
1.1 药物与试剂
通络醒脑泡腾片(4.5 g原生药/片)由本课题组自制(批号20100304),甲磺酸双氢麦角碱片(喜得镇)由天津华津制药有限公司生产(批号2C834T);CCO酶一抗:兔抗大鼠IgG,美国Santa cruz公司产品(批号SC-23984),二抗、三抗和显色剂均由北京中衫金桥生物有限公司提供。
1.2 实验动物
SD大鼠SPF级雌雄各半,体质量220~260 g,由成都达硕实验动物有限公司所提供(生产许可证号SCXK(川)2013-24);实验场地为国家中医药管理局成都中医药大学中药药理三级实验室(TCM2032043),大鼠均在室温22~24℃、明暗周期12 h/12 h条件下,自由饮水摄食。
1.3 实验仪器
Morris水迷宫(WMT-100),成都泰盟科技有限公司;Image-Pro6.0图像分析系统,美国 Media Cybernetics,Inc。
2 方法与结果
取健康SPF级SD大鼠,雌雄各半,适应性喂养3 d后,Morris水迷宫实验筛选学习记忆良好者用于造模。采用永久性结扎双侧颈总动脉法[8~9]制备VD模型,假手术组除不结扎外,其余造模步骤与模型组相同。手术后动物连续3 d肌肉注射硫酸庆大霉素注射液,每只0.3 ml。取术后1个月存活模型大鼠50只,按随机数字表法分为5组,即模型对照组、喜得镇组、通络醒脑泡腾片高、中、低剂量组,每组10只,另取10只假手术组大鼠为平行对照。表1显示,假手术组和模型对照组10 ml·kg-1生理盐水,其余各组灌胃10 ml·kg-1相应药物,每日1次,连续90 d。给药第86天开始水迷宫训练,每日1次,第90天进行定向航行和空间探索测定。行为学测定完成后处死大鼠,无菌条件下取脑组织,常规固定制片、切片,采用SP法进行免疫组织化学反应,具体方法参照说明书进行。采用 Image-Pro Plus 6.0图像分析系统进行分析,并测定平均光密度(IA)(结果见图1)。
表1 通络醒脑泡腾片对VD模型大鼠行为学的影响(±s)
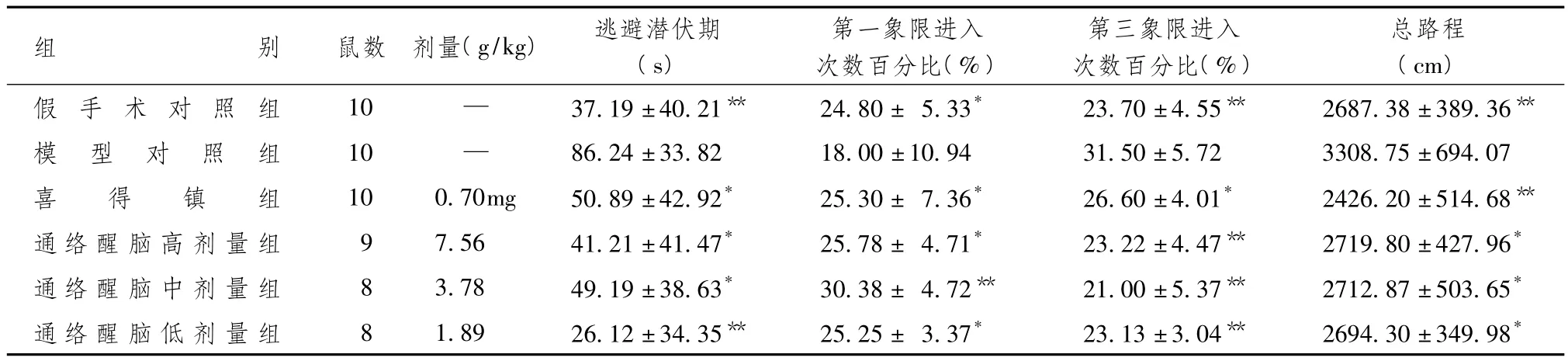
表1 通络醒脑泡腾片对VD模型大鼠行为学的影响(±s)
注:与模型对照组比较:*P<0.05,**P<0.01
组别 鼠数 剂量(g/kg) 逃避潜伏期(s)第一象限进入次数百分比(%)第三象限进入次数百分比(%)总路程(cm)假 手 术 对 照 组 10 — 37.19±40.21** 24.80± 5.33* 23.70±4.55** 2687.38±389.36**模 型 对 照 组 10 — 86.24±33.82 18.00±10.94 31.50±5.72 3308.75±694.07喜 得 镇 组 10 0.70mg 50.89±42.92* 25.30± 7.36* 26.60±4.01* 2426.20±514.68**通络醒脑高剂量组 9 7.56 41.21±41.47* 25.78± 4.71* 23.22±4.47** 2719.80±427.96*通络醒脑中剂量组 8 3.78 49.19±38.63* 30.38± 4.72** 21.00±5.37** 2712.87±503.65*通络醒脑低剂量组 8 1.89 26.12±34.35** 25.25± 3.37* 23.13±3.04** 2694.30±349.98*
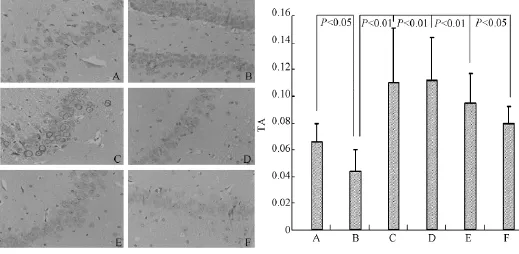
图1 各组大鼠海马CCO酶的表达(10×10)
表1显示,与假手术组比较,模型对照组的逃避潜伏期显著延长,第一象限进入次数百分比显著降低,第三象限进入次数百分比显著增高,游泳总路程显著增多,差异有统计学意义(P<0.05);与模型对照组比较,通络醒脑泡腾片高、中、低3个剂量组对上述指标均有显著回调作用(P<0.05)。
图1显示,CCO主要分布于海马、上颞叶,阳性呈棕黄色或黄色颗粒,表达于细胞浆,阴性细胞核为蓝色;模型组海马CCO显著低表达,平均光密度较假手术组明显降低,差异有统计学意义(P<0.05);通络醒脑各剂量组CCO均较模型对照组棕染颗粒显著增多,着色变深,平均光密度值显著增高(P<0.01)。
3 讨论
线粒体产能障碍是脑缺血后产生的早期损伤级联反应,与VD病理进程密切有关[10]。脑组织是机体内能量代谢最活跃的器官之一,但其储存的能量有限,血流中断后仅能持续数分钟的能量供应[11]。线粒体是物质氧化释放ATP的最终场所[12],也是氧自由基产生的主要部位[13]。缺血后大量氧自由基的聚集造成线粒体结构和功能受损,继发肿胀、炎症、抑制三羧酸循环中能量关键酶丙酮酸脱氢酶、α-酮戊二酮脱氢酶活性以及CCO mRNA的转录,破坏电子传递使葡萄糖氧化磷酸化受阻,ATP产生减少,进而引起脑神经细胞损伤[14]。CCO作为呼吸链集合体中电子传递系的关键酶,主导线粒体内90%的分子氧消耗,其活性的强弱决定了线粒体能量代谢的高低。正常情况下,CCO保证氧能量代谢与神经元活性之间的相互耦合[15],其活性与神经元活性呈正相关[16]。脑缺血时,海马区神经元需要更多的ATP修复胞内环境和失活的蛋白和脂质,ATP供应不足则干扰CCO的合成,导致氧自由基增加、线粒体内跨膜电位崩溃、钙泵和线粒体摄取活性降低,引起胞内Ca2+稳态失调和水钠贮留,并伴随谷氨酸神经毒性加重能量代谢障碍。另外CCO活性降低,也可反馈性激活Ras蛋白通路,抑制过氧化物酶活性,引起 H2O2大量蓄积中毒[17],导致神经细胞衰老,最终凋亡进而引起学习记忆功能的下降。
传统医学认为,缺血致脑损伤的主要病机是由气滞、血瘀、痰阻久滞脑之脉络,浊毒内生、败坏脑髓所致。通络醒脑泡腾片具有活血通络、醒脑通窍、解毒益智的作用,理论上能够改善缺血所造成的脑神经细胞损伤。
本次实验研究表明,通络醒脑泡腾片能明显缩短VD模型大鼠的逃避潜伏期,增加第一象限进入次数百分比,降低第三象限进入次数百分比,并能缩短游泳总路程,提示该制剂具有良好的改善VD模型学习记忆功能的作用;免疫组化检测结果显示,与假手术组比较,模型对照组海马CCO阳性表达颗粒减少,平均光密度值显著降低,具有统计学意义(P<0.05),同文献报道一致[18];通络醒脑泡腾片能使模型大鼠海马CCO阳性表达颗粒显著增多,平均光密度值较模型对照组显著增高,差异有统计学意义(P<0.01)。以上结果与传统医学理论相符,同时提示通络醒脑泡腾片改善VD模型大鼠学习记忆功能与促进海马区CCO表达有关。
[1]Nelson C,Silverstein F S.Acute disruption of cytochrome oxidase activity in brain in a perinatal rat stroke model[J].Pediatric research,1994,36:12-19.
[2]Cechetti F,Worm P V,Elsner V R,et al.Forced treadmill exercise prevents oxidative stress and memory deficits following chronic cerebral hypoperfusion in the rat[J].Neurobiology of learning and memory,2012,97(1):90-96.
[3]Nelson C,Silverstein F S.Acute disruption of cytochrome oxidase activity in brain in a perinatal rat stroke model[J].Pediatric research,1994,36:12-19.
[4]张荫杰,巨少华,胡勇,等.通络醒脑泡腾片对拟痴呆小鼠中枢胆碱能神经功能的影响[J].中药新药与临床药理,2014,25(3):272-276.
[5]徐世军,代渊,张荫杰,等.通络醒脑泡腾片对Aβ海马注射痴呆大鼠tau蛋白磷酸化关键调控蛋白 CDK5和 GSK-3表达的影响[J].华西药学杂志,2013,28(2):140-140.
[6]张荫杰,徐世军,代渊,等.通络醒脑泡腾片对痴呆大鼠突触素表达的影响[J].中药药理与临床,2012,28(3):84-87.
[7]张荫杰,代渊,胡勇,等.通络醒脑泡腾片对AD大鼠学习记忆和海马胰岛素降解酶表达的影响[J].中国中药杂志,2013,38(017):2863-2867.
[8]胡勇,巨少华,张荫杰,等.通络醒脑泡腾片对大鼠慢性脑缺血致学习记忆功能损伤的影响[J].中国中药杂志,2014; 39(9):38-42.
[9]赵宪林,方秀斌.大鼠血管性痴呆模型制作[J].中国医科大学学报,2002,31(3):166-167.
[10]Du J,Ma M,Zhao Q,et al.Mitochondrial bioenergetic deficits in the hippocampi of rats with chronic ischemia-induced vascular dementia[J].Neuroscience,2013,231:345-352.
[11]Scheufler K M,Lehnert A,Rohrborn H J,et al.Individual value of brain tissue oxygen pressure,microvascular oxygen saturation,cytochrome redox level,and energy metabolites in detecting critically reduced cerebral energy state during acute changes in global cerebral perfusion[J].Journal of neurosurgical anesthesiology,2004,16(3):210-219.
[12]Sas K,Robotka H,Toldi J,et al.Mitochondria,metabolic disturbances,oxidative stress and the kynurenine system,with focus on neurodegenerativedisorders[J].Journalofthe neurological sciences,2007,257(1):221-239.
[13]Satish Srinivasan,Narayan G.Avadhani.Cytochrome c Oxidase Dysfunction in Oxidative Stress[J].Free radic biology and medicine,2012,53(6):1252-1263.
[14]Aliev G,Priyadarshini M,P Reddy V,et al.Oxidative stress mediated mitochondrial and vascular lesions as markers in the pathogenesis of Alzheimer disease[J].Currentmedicinal chemistry,2014,21(19):2208-2217.
[15]Wong-Riley M T T.Cytochromeoxidase:an endogenous metabolic marker forneuronalactivity[J]. Trends in neurosciences,1989,12(3):94-101.
[16]Gennis R,Ferguson-Miller S.Structure of cytochrome c oxidase,energy generator of aerobic life[J].Science(New York,NY),1995,269(5227):1063-1064.
[17]Mesquita A,Weinberger M,Silva A,et al.Caloric restriction or catalase inactivation extends yeast chronological lifespan by inducing H2O2 and superoxide dismutase activity[J].Proceedings of the National Academy of Sciences,2010,107 (34):15123-15128.
[18]Haraldseth O,Gronas T,Unsgard G.Quickermetabolic recovery after forebrain ischemia in rats treated with the antioxidant U74006F[J].Stroke,1991,22(9):1188-1192.
Effects of Tongluo Xingnao effervescent tablets on expression of cytochrome C oxidase in cells in hippocampus of VD rat model
REN Xiang-yi1,2,HU Yong1,2,WEI Jiang-ping1,2,MA Yun-tong1,2,XU Shi-jun1,2△
(1.Sichuan Provincial Key Laboratory,Systematic Research and Development of Chinese Medicinal Resources,Province-Ministry Co-constructed State Key Lab Incubation Base,Chengdu 611137,China; 2.Chengdu University of TCM,Chengdu 611137,China)
Objective:To explore effects of Tongluoxingnao effervescent tablets on the expression of cytochrome c oxidase in hippocampus of vascular dementia(VD)model rats.Methods:Establishing VD model rats induced by permanent occlusion of bilateral common carotid arteries(2-VO).Evaluating the learning and memory ability with the Morris water maze test,and measuring the expression of cytochrome c oxidase in hippocampus of rats with immunohistochemistry and imaging quantitative analysis.Results:On the one hand,as for the VD model rats,the tablets can notably decrease the escape latency and increase frequencies of percentage of entering into the first quadrant dwell,meanwhile it also can decrease the percentage of total numbers of the third quadrant dwell entries and shorten the total swim route.On the other hand,the tablets enhance the positive expression of cytochrome c oxidase in rats hippocampal,and significantly increase its average optical density value compared with the control group which reveals a statistical significance.Conclusion:The Tongluoxingnao effervescent tablets can improve the ability of learning and memory of VD model rats that is related with promoting the expression of cytochrome c oxidase in rats hippocampus.
Tongluoxingnao Effervescent Tablets;Vascular Dementia; Cytochrome C Oxidase.
R285.5
B
1006-3250(2015)02-0159-03
2014-08-05
“重大新药创制”科技重大专项(2013ZX09103002-008);中药药理四川省青年科技创新研究团队(2014TD0007);四川省教育厅自然科学重点项目(12ZA041);成都市产业发展技术支撑计划-高校院所应用基础研究(12DXYB321JH-002)
任香怡(1989-),女,四川广安人,在读硕士,从事中药神经与精神药理学研究。
△通讯作者:徐世军(1975-),男,甘肃静宁人,教授,从事中药神经与精神药理学研究,Tel:028-61800231,E-mail:docxu @126.com。

