艾灸对AD大鼠学习记忆、GSK-3β和磷酸化tau蛋白的影响*
王静蓉,张玉杰,姜美驰,梁 静,许建阳△,黄汉昌,姜招峰
(1.辽宁医学院,辽宁锦州 121001;2.武警总医院,北京 100039; 3.北京联合大学应用文理学院,北京 100191)
艾灸对AD大鼠学习记忆、GSK-3β和磷酸化tau蛋白的影响*
王静蓉1,张玉杰1,姜美驰1,梁 静2,许建阳2△,黄汉昌3,姜招峰3
(1.辽宁医学院,辽宁锦州 121001;2.武警总医院,北京 100039; 3.北京联合大学应用文理学院,北京 100191)
目的:探讨艾灸防治阿尔茨海默病(Alzheimer Disease,AD)的作用及其机制。方法:大鼠双侧脑室微量注射STZ造模,术后第10天艾灸组灸“关元”“长强”“命门”“百会”,同时西药对照组灌胃盐酸多奈哌齐,治疗30 d后用Morris水迷宫测各组大鼠学习记忆能力,再取材用ELISA法、免疫组织化学、Western blot等检测海马区GSK-3β活性及tau蛋白磷酸化位点(Ser396/ Thr231)的含量和表达水平。结果:艾灸组与西药对照组较模型组平均游泳距离百分比上升;与假手术组比较,模型组大鼠海马CA1区椎体细胞形态结构异常,阳性染色深,而艾灸组与西药对照组较模型组形态结构完整,阳性染色浅;除假手术组外,GSK-3β活性及磷酸化tau蛋白Ser396、thr231位点相对表达量均升高,且西药对照组和艾灸组低于模型组。结论:艾灸可部分改善AD大鼠学习记忆,其可能通过抑制海马GSK-3β活性,降低p-tau S396、T231的磷酸化水平起到防治AD的作用,且作用效果与西药盐酸多奈哌齐相同。
阿尔茨海默;艾灸;链脲佐菌素GSK-3β;Ser396;Thr231
阿尔茨海默病(Alzheimer Disease,AD)是一种临床常见神经系统退行性疾病,以认知功能障碍为临床特点,主要表现为学习记忆能力下降等,常起病隐匿,病情呈进行性加重。其主要病理特征是Aβ沉积形成的老年斑(SP)和过度磷酸化Tau蛋白导致的神经纤维缠结 (NFT)[1]。关于AD早期的发病机制有许多假说,其中Tau蛋白学说是目前研究导致AD发病的主要机制之一,即正常结构的Tau蛋白原本是稳定细胞骨架的重要成分,由于各种原因诱使tau蛋白异常过度磷酸化后,导致正常细胞结构被破坏,极易形成NFT,最终促成AD。而GSK-3β能调控磷酸化tau蛋白的表达水平,进而影响AD的发生发展。
对已形成的病理产物不易消除是导致临床中晚期AD治疗花费大、收效差和致死率高的重要原因,故现代研究把目光转向AD的早期防治。
艾灸“治未病”在防治老年痴呆、改善认知方面有较好的临床疗效[2-3]。近年来,一些研究[4-5]从神经突触可塑性、热休克蛋白等方面研究艾灸防治AD的机理。但其对AD大鼠海马内tau蛋白磷酸化水平等方面有何影响且作用机制如何尚未清晰。因此,本文用STZ侧脑室注射造模、早期介入艾灸干预,以期从干预后大鼠学习记忆、海马内GSK-3β活性、p-tau S396、T231的表达情况,探讨艾灸对防治AD的作用及其机制。
1 材料与方法
1.1 动物与分组
选取2月龄雄性SPF级SD大鼠60只,体质量(300±30)g,适应性喂养3 d后,按随机数字表法分为假手术组12只,手术组48只。术后观察9 d,去除死亡大鼠12只,其余36只手术伤口愈合良好,饮食水及二便正常,再利用随机数字表法分为模型组、西药对照组和艾灸组,每组各12只。
1.2 主要试剂与仪器
链脲佐菌素STZ(sigma);GSK-3β ELISA试剂盒(北京普尔伟业);抗体 :GSK3-β、p-tau S396、T231、β-Actin(Abcam);BCA蛋白定量试剂盒与HRP山羊抗兔IgG(H+L)二抗(鼎国昌盛);超敏型二步法检测试剂盒(中杉金桥)及艾绒等大鼠脑立体定位仪(瑞沃德);微量注射器(hamilton);Morris水迷宫,Noldus EhonVision图像采集分析系统;酶标仪(Bio-tek);电泳仪、转膜仪(Bio-Rad);ECL凝胶成像系统(GE Healthcare);电泳成像分析系统Image Quant RTECL(BD Bioscience);倒置显微镜(olympus);切片机、包埋机(Leica)及乐灸牌艾条机等。
1.3 造模
所有大鼠经10%水合氯醛(3.5~4.5 mL/kg)麻醉后,固定于大鼠脑立体定位仪上,常规消毒,正中矢状位切开分离骨膜,牙科钻钻开颅骨暴露前后囟。除假手术组外,其余3组用双侧侧脑室各注射STZ约10 μL(3 mg/kg,注射前将STZ溶于柠檬酸/柠檬酸钠缓冲液,浓度为0.1 mol/L,pH=4.2~4.4)。参考《大鼠脑立体定向图谱》[6]确定打孔点坐标:前囟后1.5 mm,矢状缝左右旁开1.5 mm,脑表面下3.5 mm。注射后留针5 min缓慢出针。缝合创口处滴青霉素。第3天重复注射(剂量同前)。假手术组以等量柠檬酸/柠檬酸钠缓冲液替代STZ。术后禁食24 h后,恢复常规饲养,连续5 d肌注庆大霉素3 U/d,以防感染。
1.4 干预
术后观察9 d,从第10天开始干预。艾灸组治疗时将大鼠从笼内轻轻取出,注意动作柔和,避免惊吓,用柔软透气性好且避光的布巾轻缓裹住大鼠头部,待其消除恐惧感后,无须强行固定,将其仰面安靠在灸台的海绵垫上,整个过程大鼠处于清醒状态,只由1人独立操作以减少干扰,有利于保持大鼠施灸状态平稳。具体施灸方法,图1所示,以左手虎口,左手大拇指、食指、中指三指适度卡住大鼠头、颈、肩,另一只手持特制细艾条取腹部“关元”穴,悬灸距皮肤3~4 cm,穴位皮肤温度保持(37±2)℃之间,15 min/次,然后撤去艾条,将其轻轻翻转成俯卧位,此时若大鼠受惊,稍加抚慰待其状态恢复平静再按次序施灸于“长强”、“命门”、“百会”,每次灸时分别为长强、命门各7 min,百会3 mim,具体操作以皮下温热小动物不烦燥为度,隔2 d灸,10次为1个疗程,共30 d。艾灸条均为艾条机手工压制,直径1 cm,艾绒净重(5.5 g±0.2)g/支;西药对照组给予盐酸多奈哌齐混悬液进行灌胃,其中盐酸多奈哌齐按1 mg/kg计算用药量,每日1次,每次灌胃量不超过3 ml共30次;假手术组、模型组不处理。

图1 小白鼠施灸方法
1.5 Morris水迷宫行为学检测
治疗30 d后的第2天开始定位航行实验。平台随机固定于某一象限内不动,在每个象限边缘取1个起始点,每次训练选1个不同起始点,将大鼠头冲上、面向池壁放入池内,以大鼠找到平台并在台上停留3 s记为1次训练结束时的潜伏期,若大鼠在120 s内找不到平台,将其引导至平台上,潜伏期记为120 s。之后大鼠停留在平台30 s,用以记忆空间。每天训练分上、下午各2次,分别从上午8点和下午1点开始训练,每只大鼠每天共训练4次,实验共历时4 d。
1.6 脑组织样品处理
测试结束后的第2天将大鼠断头取脑,冰上快速分离左右半脑,一半脑置于4%多聚甲醛固定48 h后常规石蜡包埋,另一半取海马组织放入冻存管中,置于液氮罐中速冻,然后转移到-80℃冰箱中备用。
1.7 指标检测
1.7.1 成像系统自动记录定位航行 实验中每组12只大鼠每天4次检测训练的潜伏期及游泳距离百分比,取其平均值作为大鼠平均潜伏期和平均游泳距离百分比。
1.7.2 ELISA法检测大鼠海马GSK-3β活性
每组随机取6只大鼠海马组织冰上研磨,充分裂解、匀浆、离心取上清,按试剂盒操作测出样品吸光度值,再计算出GSK-3β的活性量。
1.7.3 免疫组化 将蜡块连续切片,片厚5μm,每隔20张取1张做HE染色,根据染色结果选取相同位置的海马进行免疫组化染色。其中滴加一抗浓度分别为 p-tauT231 1∶100、p-tau S396 1∶800,阴性对照加PBS。在400倍镜下观察比较各组海马CA1区椎体细胞形态变化以及抗体阳性染色情况。
1.7.4 免疫印迹 每组随机选6个样本分别检测p-tauT231、S396的表达量,每个样品重复测3次,取3次平均值作为结果;采用Quantity One电泳图像分析软件分析所采集的条带灰度值,并以目标条带灰度值比上内参β-actin条带灰度值,表示目标蛋白的相对表达水平。
1.8 统计学方法
采用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析;组间两两比较,方差齐时用LSD检验,方差不齐时采用Dunnett’s T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 定位航行实验结果
表1显示,模型组大鼠平均潜伏期较假手术组延长,平均游过平台象限距离与总距离百分比下降(均P<0.05),说明模型制作是成功的,造模后大鼠的学习记忆能力被明显破坏;与模型组比较,西药对照组平均潜伏期比较差异无统计学意义(P>0.05),但平均游泳距离百分比有所上升(P<0.05),且艾灸组与西药对照组间比较差异无统计学意义(P>0.05),说明艾灸和盐酸多奈哌齐均能部分抑制学习记忆的损伤,起到相同的治疗作用。
2.2 大鼠海马GSK-3β活性
与假手术组比较,各组大鼠海马组织 GSK-3β活性均升高,差异均有统计学意义(均 P<0.05);与模型组比较,西药对照组和艾灸组大鼠海马组织GSK-3β活性均下降,且西药对照组低于艾灸组,差异均有统计学意义(均P<0.05)
2.3 免疫组化检测结果
图2显示,400倍光镜下各组大鼠海马区均可见棕褐色阳性表达,反应部位主要位于细胞膜,细胞核呈阴性。与假手术组比较,模型组大鼠海马CA1区椎体细胞排列松散,细胞形态不规则,胞体缩小,部分胞核固缩,突起缩短,出现断裂甚至消失,表达的阳性细胞着色深,说明造模后损伤大鼠海马CA1区椎体细胞且导致tau蛋白位点S396、T231表达水平升高;与模型组比较,西药对照组、艾灸组的椎体细胞排列较紧密,结构较完整,细胞膜、核膜清晰,体积较大,阳性细胞染色淡,说明2种治疗均能一定程度保护CA1区椎体细胞受损,并降低p-tauT231、S396的表达。

图2 A1-D1 4组大鼠海马CA1区椎体细胞p-tauT231阳性细胞表达(DAB显色×400,箭头示p-tauT231阳性细胞)A2-D2 4组大鼠海马CA1区椎体细胞p-tauS396阳性细胞表达(DAB显色 ×400,箭头示p-tauS396阳性细胞)
2.4 Western blot检测结果
图3显示,模型组大鼠海马p-tauT231、S396条带较假手术组明显增粗且颜色浓,提示模型组该蛋白位点的表达量升高;与模型组比较,西药对照组、艾灸组条带细且颜色淡,提示治疗后2组大鼠海马的蛋白位点表达量下降。这与p-tauT231、S396蛋白相对表达量比较(见表1)结果相符,说明艾灸与盐酸多奈哌齐均能一定程度上抑制AD大鼠海马内p-tauT231、S396的磷酸化水平。
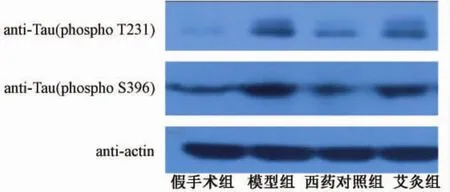
图3 Western blotting检测p-tau T231、S396抗体显影条带
表1 各组大鼠Morris水迷宫定位航行实验结果、海马区GSK-3β活性及p-tauT231、S396蛋白相对表达量比较(±s,均n潜伏期=n距离百分比=12,nGSK-3 β=6,nT231=nS396=3)

表1 各组大鼠Morris水迷宫定位航行实验结果、海马区GSK-3β活性及p-tauT231、S396蛋白相对表达量比较(±s,均n潜伏期=n距离百分比=12,nGSK-3 β=6,nT231=nS396=3)
注:与假手术组比较:#P<0.05;与模型组比较:*P<0.05,☆P>0.05;与对照组比较:▲P>0.05,△P<0.05
组别 平均潜伏期(s)平均游泳距离百分比(%) ELISA Western blot GSK-3β(ng/ml)T231 S396 假 手 术 组 49.64±3.59 38.25±6.11 0.12±0.05 0.23±0.10 0.26±0.09 模 型 组 69.55±4.43 26.47±1.51 0.33±0.19 0.76±0.21 0.77±0.18 对 照 组 60.42±11.76#☆30.29±4.18#*0.21±0.10#*0.34±0.10#*0.40±0.09#*艾 灸 组 70.67± 5.84#▲31.18±4.87#▲0.25±0.14#△0.58±0.12#△0.63±0.07#△
3 讨论
《内经》有云:“人始生,先成精,精成而脑髓生。”肾精主人之生长壮老已,且精生髓化。《中西汇通医经精义》云:“肾系贯脊,通于脊髓,肾精足,则入脊化髓上循入脑而为脑髓,是髓者精气之所会也。”又《素问·骨通论》曰:“督脉者,起于少腹之下……贯脊属肾……上额交颠,入络脑。”可见,肾与脑髓通过督脉相联系[7]。任督二脉均起自胞中,又相交于脑,阴阳环抱,为肾所主,故脑髓之病变可论及肾与任督二脉。
老年痴呆是以肾精亏虚、脑髓失养为病理基础,阳气虚为发病机制的退行性病[8]。故利用艾灸温阳通补的特性,从肾及任督脉论治痴呆。关元乃任脉经穴,足三阴经与任脉之会,温肾固精,培元固本;长强在督脉之端,通于任脉,可调和阴阳、调任督之气;命门补肾益阳;百会位居巅顶,为诸阳之会,可升提阳气,醒脑益智。故艾灸选穴关元、命门阴阳相济,百会、长强高下相合,寓“阴中求阳,阳中求阴”之意,奏“补肾温阳,益智通髓”之功。
“灸”为“久火”,顾名思义是一种以温热刺激为特色的中医常用的治病保健疗法。施灸时通过艾燃烧产生热量,不仅能引起局部组织温度升高同时还伴随产生整体生物效应,其主要以红外辐射的方式传递到治疗部位[9]从而发挥治疗作用。它能显著提高治疗局部与机体整体的能量代谢[10],可为能量缺乏的病态细胞提供活化能[11]。
本文关于灸法的定量标准做以下相关研究:
许培昌[12]等指出,灸距以3~4 cm为宜,若距离太近,随灸时延长局部皮温过高而灼伤。本实验大鼠皮毛较厚散热缓慢,经反复测试后采用灸质量(5.5±0.5)g、直径1 cm的特制细艾条燃烧时,灸距保持在3~4 cm处,穴位表面的温度保持在(37± 2)℃,大鼠能长时间保持安静不烦燥,这构成本次研究中艾灸持续稳定作用于实验对象的前提。
又以王悦同[13]等研究提出不同穴位应采用不同灸时的理论为指导,在反复测试中发现随灸穴位置深度不同,灸至相应时间后热度可透至皮下穴位处,且大鼠对艾灸的耐受度与穴位特性有关:关元位于腹部,定位较深,可灸15 min,长强、命门次之7min,百会位于头顶皮肤下,为诸阳之会,不可过灸,3min为宜。灸之要气至而有效,灸量不足达不到气至的疗效,灸量过大又会导致邪火内郁,或直接灼伤阴津[14],故隔2 d灸1次为好[15]。
临床上,AD初期患者脑葡萄糖代谢和细胞能量产生明显受损,并出现胰岛素/胰岛素受体(insulin/insulin receptor,I/IR)信号系统功能紊乱[16],继而引起tau蛋白过度磷酸化[17]。实验研究证明,STZ侧脑室注射后引起大鼠脑内持久的葡萄糖和能量代谢障碍,并干扰I/IR系统,可以导致tau蛋白的异常磷酸化[18]。根据大鼠双侧侧脑室微量STZ注射后第10天出现病理改变至第60天内逐渐加重的情况[19],我们在术后第10天开始干预,治疗30 d后即术后第40天连续4 d用定位航行实验检测大鼠学习记忆能力,测试结束第2天即术后第45天取材检测海马GSK-3β活性和p-tauT231、S396表达情况,旨在观察AD发病早期用艾灸干预的疗效。
AD的主要病理特征是SP与NFT。过度磷酸化tau蛋白是NFT的主要成分,其形成主要是由蛋白激酶催化的tau蛋白磷酸化与磷酸酯酶催化的去磷酸化之间失衡所致[20]。GSK-3β是神经系统中催化tau蛋白磷酸化的三大蛋白激酶之一[21],在脑组织中含量丰富。当GSK-3β被过度激活,可催化一些参与调节tau蛋白微管结合活性的过度磷酸化位点如Ser396、Thr231[22-24]等。异常过度磷酸化的tau蛋白一方面失去催化微管装配、稳定微管结构的生物效能,抑制tau蛋白与微管的结合,使正常细胞骨架结构被破坏,易于聚集成直丝或双螺旋细丝(PHF)进一步缠绕形成NFT[25];另一方面获得崩解微管的毒性作用,引起胞体与轴突树突之间的APP运输障碍[26],使得神经元突起末端的神经元发生退行性病变[27],导致Aβ沉积形成SP,最终与NFT共同促成AD的发生。
4 结论
本次研究结果显示,在AD发病早期以艾灸任督二脉“补肾温阳,益智通髓”的方法干预治疗,能在一定程度上保护AD大鼠的学习记忆,可能是通过抑制GSK-3β活性,进而降低tau蛋白在Thr231、Ser396位点磷酸化水平的途径来达到防治AD的效果。
[1] Suzhen Dong,Yale Duan,Ying Hu et,al.Advances in the pathogenesis of Alzheimer's disease:a re-evaluation of amyloid cascade hypothesis[J].Transl Neurodegener,2012,1(1):18.
[2] 唐云华,康秀丽.中药与灸法并用治疗老年痴呆症的临床研究[J].中医学报,2011(6):763-764.
[3] 靳英辉,商洪才,谢雨露,等.轻度认知功能障碍中医调摄护理证据评价[J].中国循证医学杂志,2015(3):346-352.
[4] 崔翔,马冉,唐萁,等.针灸对AD模型大鼠海马轴突生长抑制因子MAG及OMgp表达的影响[J].时珍国医国药,2014 (7):1752-1754.
[5] 杜艳军,宋杰,周华,等.针灸预刺激诱导热休克蛋白保护神经元的机制研究(英文)[J].World Journal of Acupuncture-Moxibustion,2014(1):32-38.
[6] 包新民,舒斯云.大鼠脑立体定向图谱[M].北京:人民卫生出版社,1991:30-35.
[7] 潘婕,张玉莲,张连城.从肾精与脑髓之关系论治老年痴呆[J].辽宁中医杂志,2013(10):2031-2032.
[8] 武峻艳,王杰,张俊龙.从督脉论治不同脑老化疾病异病同治的理论基础——以阿尔茨海默病和帕金森病为例[J].中国针灸,2015(5):489-492.[9] 吕丰.艾灸物理特性研究[D].长沙:中南民族大学,2013.
[10] 王波.灸法对肾阳虚模型大鼠ATP能量代谢的影响[C].中国针灸学会(China Association of Acupuncture-Moxibustion),2011中国针灸学会年会论文集(摘要),2011:9.
[11] 杨华元,胡追成.艾灸的生物物理特性(英文)[J].World Journal of Acupuncture-Moxibustion,2010(2):27-31.
[12] 许培昌,李达良,崔淑丽.不同施灸距离对人体体表皮肤温度的影响——论施灸的安全距离[J].中国针灸,2012(7):611-614.
[13] 王悦同,王盛隆,李霖,等.灸法禁忌[J].上海针灸杂志,2013 (9):790-792.
[14] 夏有兵,程洁,穆艳云,等.浅析承淡安先生对针灸量学的探索[J].针刺研究,2013(1):73-77.
[15] 阚丽娜,孙曌.灸法量学要素初探[J].光明中医,2009(8): 1504-1506.
[16] Craft Suzanne,Cholerton Brenna,Baker Laura D.Insulin and Alzheimer's disease:untangling the web[J].J Alzheimers Dis,2013,33(1):263-75.
[17] Noura B.El Khoury Maud Gratuze,Marie-Amelie Papon,et,al.Insulin dysfunction and Tau pathology[J].Front Cell Neurosci,2014,8:22.
[18] 杨文青,马晶,刘争,等.侧脑室注射链脲佐菌素致大鼠脑内胰岛素通路障碍和认知水平降低[J].中国病理生理杂志,2013(3):462-468.
[19] 曹续政,张黎明,周姗姗,等.侧脑室注射链脲菌素制备阿尔茨海默病大鼠模型的研究[J].沈阳部队医药,2006(5):296-298.
[20] Wang Y,Yang R,Gu J,et,al.Cross talk between PI3K-AKTGSK-3β and PP2A pathways determines tau hyperphosphorylation [J].Neurobiol Aging,2015,36(1):188-200.
[21] Mazanetz MP,Laughton CA,Fischer PM.Investigation of the flexibility of protein kinases implicated in the pathology of Alzheimer's disease[J].Molecules,2014,19(7):9134-9159.
[22] Xie H1,Litersky JM,HartiganJA,e-t,al.The interrelationship between selective t-au phosphorylation and microtubule associateion[J].Brain Res,1998 Jul 6,798(1-2):173-183.
[23] Wang JZ, Zhang Y.Configuration-specific immunotherapy targeting cis pThr231-Pro232 tau for Alzheimer disease[J].Neurol Sci,2015,348(1-2):253-255.
[24] Sivaprakasam P,Han X,Civiello RL,et,al.Discovery of new acylaminopyridines as GSK-3 inhibitors by a structure guided indepth exploration of chemical space around a pyrrolopyridinone core[J].Bioorg Med Chem Lett,2015,25(9):1856-1863.
[25] Hern ández F,García-GarcíañE, Avila J. Microtubule depolymerization and tau phosphorylation[J].J Alzheimers Dis,2013,37(3):507-513.
[26] Rodríguez-Martín T,Cuchillo-Ibáñe-z I,NobleW,et,al.Tau phosphorylation affects its axonal transport and degradation[J].Neurobiol Aging,2013,34(9):2146-2157.
[27] Dawson HN,Cantillana V,Jansen M,et,al.Loss of tau elicits axonal degeneration in a mouse model of Alzheimer's disease [J].Neuroscience,2010,169(1):516-531.
Effects of Moxibustion on the Alzheimer Disease Rat Models’Learning and Memory,GSK-3 Beta and Tau Protein Phosphorylation
WANG Jing-rong1,ZHANG Yu-jie1,JIANG Mei-chi1,LIANG Jing2,XU Jian-yang2△,HUANG Han-chang3,JIANG Zhao-feng3
(1.Liaoning Medical University,Jinzhou 121001,China;2.General Hospital of armed police forces Beijing 100039,China; 3.College of Applied and Science of Beijing Union University,Beijing 100191,China)
Objective To study the effect and mechanism of moxibustion for prevention and treatment of Alzheimer’s Disease(AD).Methods:After making the AD model rats with a pair of lateral ventricle injection of STZ,we observe the rats’learning and memory by using Morris water maze,the activity of GSK-3 beta in rats hippocampus by ELISA and Tau protein phosphorylation sites(Ser396/Thr231)of content and expression by immunohistochemistry and Western blot technology.Results:The average swimming distance percentage of moxibustion group are more than model group; hippocampus CA1 in model group district vertebral body immune of staining shows cell form exception,positive cell staining deep while in two a treatment group cell form structure more full and positive staining shallower;GSK-3 Beta activity and the phosphate of Tau protein Ser396,thr231 bit points relative expression volume compared:while the model rose to the highest,control group decline below the moxibustion group and the moxibustion below the model.Conclusion:Moxibustion may partly improve learning and memory in AD rats,possibly through inhibition of hippocampal GSK-3β activities,decreased the phosphorylation of phosphorylation levels of Tau protein site Ser396/Thr231 so as to control AD.
Alzheimer disease;Moxibustion;STZ;GSK-3β;Ser396;Thr231
R245.81
B
1006-3250(2015)10-1287-04
2015-03-07
武警总部专项课题(2011003)
王静蓉(1989-),女,云南芒市人,医学硕士,从事针灸中药对脑功能的临床与研究。
许建阳(1962-),男,医学博士后,博士研究生导师,从事针灸中药对脑功能的临床与研究,E-mail:xujianyang @sina.com。

