磁性纳米γ-Fe2O3/SiO2去除水中亚甲基蓝
陈 东,曾玉彬,李 源,汪 勉,李嘉晨
(武汉大学 动力与机械学院,湖北 武汉 430072)
磁性纳米γ-Fe2O3/SiO2去除水中亚甲基蓝
陈 东,曾玉彬,李 源,汪 勉,李嘉晨
(武汉大学 动力与机械学院,湖北 武汉 430072)
以纳米γ-Fe2O3为磁性介质制备了磁性纳米γ-Fe2O3/SiO2,并将其用于水中亚甲基蓝的吸附。表征结果显示:制备的γ-Fe2O3/SiO2呈不规则核壳结构,平均粒径为38 nm,比表面积为74.35 m2/g,比饱和磁化强度为55 A·m2/kg。实验结果表明:γ-Fe2O3/SiO2对亚甲基蓝的吸附适宜在中碱性条件下进行,4 h即可达吸附平衡;在初始亚甲基蓝质量浓度为180 mg/L、γ-Fe2O3/SiO2加入量为2 g/L、初始溶液pH为7.0、吸附温度为298 K的条件下,吸附量最高为25.4 mg/g;共存金属离子会降低吸附效率,而少量的腐殖酸则会促进吸附;吸附过程符合准二级动力学方程,颗粒内扩散不是唯一的控速步骤;等温吸附满足Langmuir模型,该吸附是一个物理吸附过程;用乙醇洗涤的γ-Fe2O3/SiO2重复使用4次时仍能保持约80%的原吸附量。
γ-氧化铁;二氧化硅;亚甲基蓝;吸附;循环利用
染料废水是造成水体色度污染和富营养化的重要原因之一[1]。水中的染料不但会阻止光和氧气的透过,降低水生生物的光合活性[2],还会直接或间接地对人类健康造成危害[3]。目前,染料废水的处理方法有吸附法、膜处理法、高级氧化法、微生物处理法等[4],其中,吸附法脱色效率高、成本低、工艺简单,最为直接有效[5-6]。吸附剂往往具有较大的比表面积和较高的吸附量,在吸附过程中与吸附质反应迅速,无需添加其他试剂,故利用吸附法去除水中的污染物速度快、适应性强[7]。然而,除高速离心外,很难将粉末状或胶体状的吸附剂从处理后的废水中分离出来,导致其应用受到限制。磁辅助吸附分离技术提供了一种新思路,结合了磁性介质的吸附剂可通过外加磁场轻易地从水中被分离[8]。磁性纳米γ-Fe2O3颗粒具有比表面积大、顺磁性强、水中性质稳定、合成方法多样等优点[9],可作为吸附剂的优良磁性介质。
本工作以磁性纳米γ-Fe2O3为磁性介质将SiO2包裹其上,制备了磁性纳米γ-Fe2O3/SiO2吸附剂,对其进行了表征,并将其用于水中亚甲基蓝的吸附。
1 实验部分
1.1 试剂、材料和仪器
正硅酸乙酯,亚甲基蓝,无水乙醇,氨水:分析纯。
γ-Fe2O3:褐色粉末,球形,粒径20 nm,纯度99.5%,阿拉丁试剂公司。
JEM-100CXII型透射电子显微镜:日本电子公司;D/MAX-RB型转靶X射线衍射仪:日本理学公司;ASAP 2020M型全自动比表面积及孔隙度分析仪:美国麦克公司;LakeShore-740型振动样品磁强计:美国LakeShore公司;TU-1950型双光束紫外-可见分光光度计:北京普析通用仪器公司;雷磁PHSJ-3F型pH测定仪:上海仪电科学仪器公司;JJ-1型电动搅拌器:金坛市宏华仪器厂;SHZ-82型恒温振荡仪:金城国胜实验仪器厂。
1.2 γ-Fe2O3/SiO2的制备
室温下将0.8 g γ-Fe2O3加至80 mL无水乙醇和20 mL去离子水的混合液中,超声扩散60 min,加入2 mL氨水混匀;逐滴加入0.4 mL正硅酸乙酯和10 mL无水乙醇的混合液,以200 r/min的转速搅拌2 h;磁分离,将所得湿材料用100 mL无水乙醇洗涤3次,置于60 ℃烘箱中烘干12 h,冷却后取出研磨,即得橙红色粉末状磁性纳米γ-Fe2O3/SiO2吸附剂。
1.3 吸附实验
将一定量的γ-Fe2O3/SiO2粉末加至50 mL一定浓度的亚甲基蓝溶液中,用盐酸和NaOH调节pH,在一定温度下以150 r/min的速率恒温振荡一定时间,通过外加磁场将γ-Fe2O3/SiO2从溶液中分离出来,取清液待测。
分别用去离子水、乙醇、醋酸、盐酸、氨水和氢氧化钠溶液对吸附后的γ-Fe2O3/SiO2进行洗涤,磁分离、回收后烘干,并再次用于亚甲基蓝的吸附,共使用4次。
1.4 分析方法
采用透射电子显微镜观察γ-Fe2O3/SiO2的微观形貌;采用转靶X射线衍射仪分析γ-Fe2O3/SiO2的晶体结构;采用全自动比表面积及孔隙度分析仪测定γ-Fe2O3/SiO2的比表面积;采用振动样品磁强计测定γ-Fe2O3/SiO2的比饱和磁化强度。
采用紫外-可见分光光度计,测定反应前后亚甲基蓝溶液于波长664 nm处的吸光度,计算γ-Fe2O3/SiO2对亚甲基蓝的吸附量。
2 结果与讨论
2.1 γ-Fe2O3/SiO2的表征结果
γ-Fe2O3/SiO2的TEM照片见图1。由图1可见,由于磁性纳米γ-Fe2O3在溶液中易团聚,导致SiO2包覆在团聚体表面,形成了不规则的核壳结构。γ-Fe2O3/SiO2和γ-Fe2O3的XRD谱图见图2。由图2可见,γ-Fe2O3/SiO2出现了和γ-Fe2O3一致的特征峰,且在2θ=20°附近出现了SiO2的特征峰,说明SiO2在未引起γ-Fe2O3晶体结构改变的情况下成功包裹在了γ-Fe2O3表面。根据Scherrer公式可计算出γ-Fe2O3的平均晶粒尺寸为34 nm,γ-Fe2O3/SiO2的平均晶粒尺寸为38 nm,故SiO2的平均包裹厚度为2 nm左右。

图1 γ-Fe2O3/SiO2的TEM照片
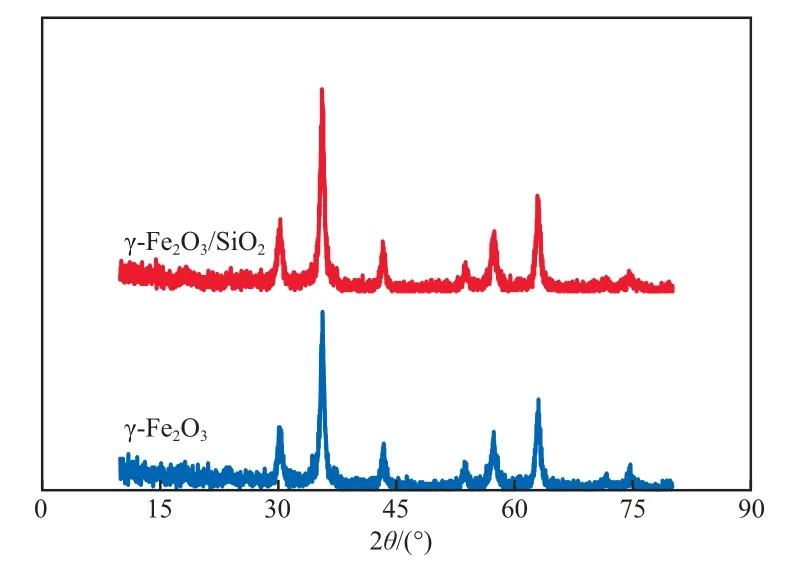
图2 γ-Fe2O3/SiO2和γ-Fe2O3的XRD谱图
经测定:γ-Fe2O3的比表面积为68.10 m2/g,比饱和磁化强度为62 A·m2/kg(300 K);γ-Fe2O3/ SiO2的比表面积为74.35 m2/g,比饱和磁化强度为55 A·m2/kg(300 K)。由此可见,SiO2的包裹导致颗粒的比表面积增大,而比饱和磁化强度下降。但比饱和磁化强度的少量下降并未影响磁分离效果,磁分离过程中γ-Fe2O3起到了较强的磁性介质作用。
2.2 吸附量的影响因素
2.2.1 初始溶液pH
在初始亚甲基蓝质量浓度为30 mg/L、γ-Fe2O3/ SiO2加入量为2 g/L、吸附温度为298 K、吸附时间为4 h的条件下,初始溶液pH对亚甲基蓝吸附量的影响见图3。
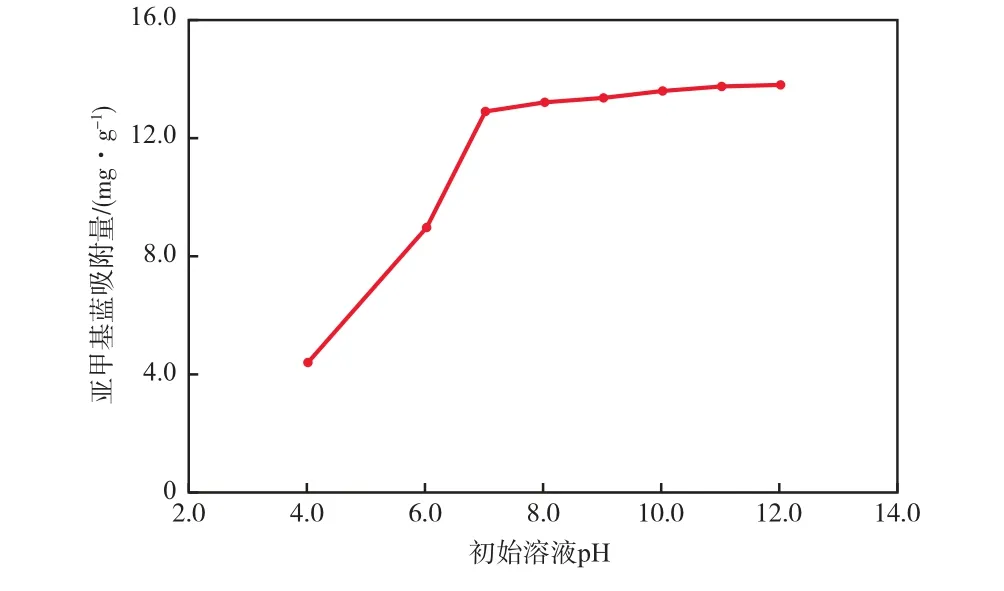
图3 初始溶液pH对亚甲基蓝吸附量的影响
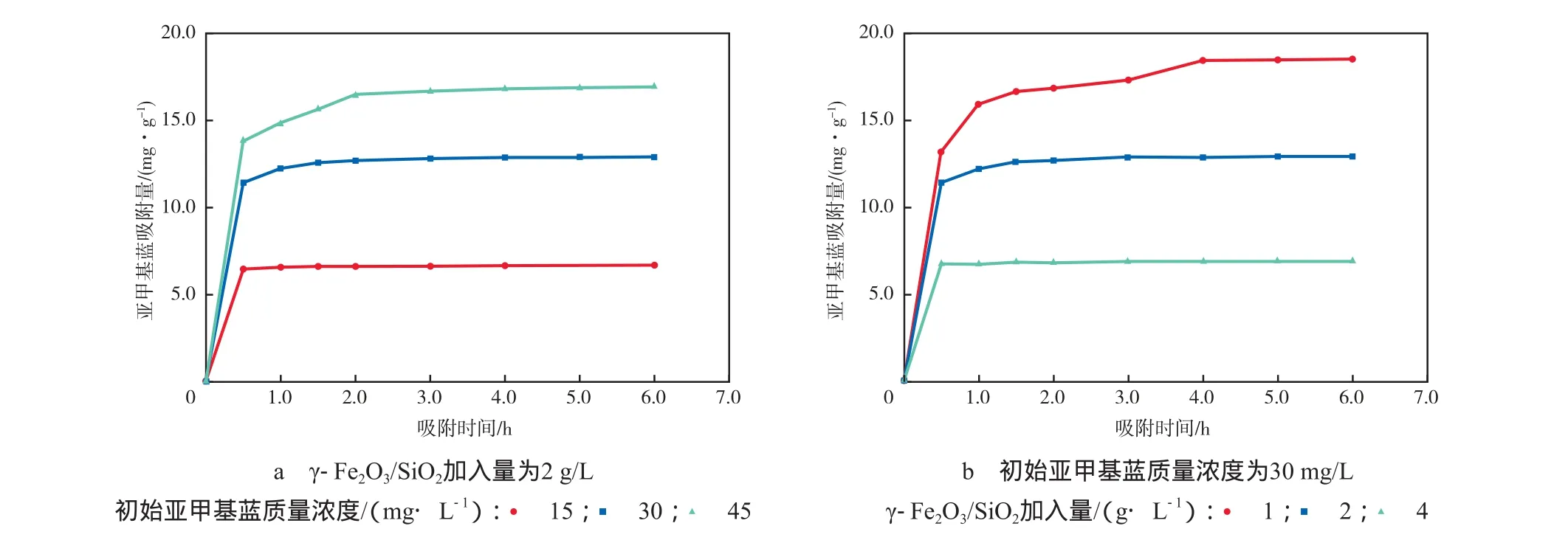
图4 吸附时间对亚甲基蓝吸附量的影响
由图3可见,碱性条件有利于γ-Fe2O3/SiO2对亚甲基蓝的吸附,这是因为碱性环境下亚甲基蓝的正离子倾向明显,γ-Fe2O3/SiO2表面吸附OH-形成带负电荷的吸附中心,促进了亚甲基蓝离子的吸附。由图3还可见,碱性条件下pH的变化对亚甲基蓝吸附量的影响较小。实际应用中可适量引入其他碱性废水,维持pH在7.0以上就能获得良好的吸附效果。
2.2.2 吸附时间
在初始溶液pH为7.0、吸附温度为298 K的条件下,吸附时间对亚甲基蓝吸附量的影响见图4。由图4可见,γ-Fe2O3/SiO2对亚甲基蓝的吸附快速,吸附的前2 h就能达到局部平衡,4 h后基本整体达到平衡。增大对单位浓度污染物的吸附表面积可加快吸附速率,故初始亚甲基蓝质量浓度越小,γ-Fe2O3/SiO2加入量越大,达到平衡所需的时间越短。这与图4的趋势相一致。因此,利用吸附法处理染料废水时,根据需要适当增加吸附剂用量,可在提高吸附效果的同时有效缩短吸附时间。
2.2.3 初始亚甲基蓝质量浓度
在γ-Fe2O3/SiO2加入量为2 g/L、初始溶液pH为7.0、吸附时间为4 h的条件下,初始亚甲基蓝质量浓度对亚甲基蓝吸附量的影响见图5。由图5可见,随初始亚甲基蓝质量浓度的增加,γ-Fe2O3/SiO2对亚甲基蓝的吸附量也逐渐增加。初始质量浓度的增加提高了亚甲基蓝由溶液中向γ-Fe2O3/SiO2表面迁移的推动力,使得平衡向着有利于吸附的方向移动。由图5还可见,初始亚甲基蓝质量浓度为180 mg/L时,吸附趋于饱和,此时298,308,318 K下的吸附量分别为25.4,22.8,20.5 mg/g。随温度的升高吸附量下降,说明该吸附过程是一个放热过程。
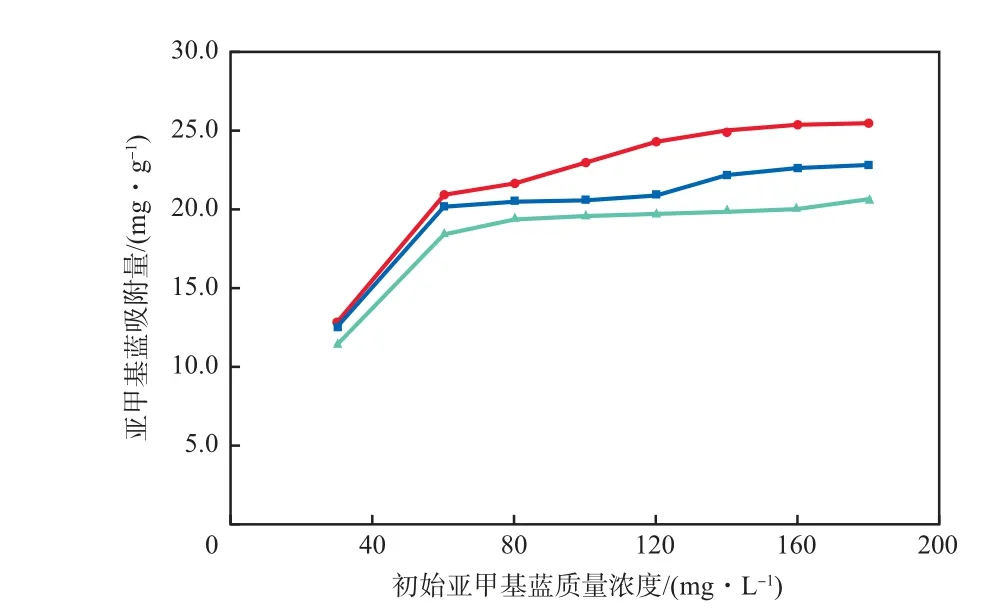
图5 初始亚甲基蓝质量浓度对亚甲基蓝吸附量的影响吸附温度/K:● 298;■ 308;▲ 318
2.2.4 共存的金属离子和腐殖酸
在初始亚甲基蓝质量浓度为30 mg/L、γ-Fe2O3/ SiO2加入量为2 g/L、初始溶液pH为7.0、吸附温度为298 K、吸附时间为4 h的条件下,溶液中共存的金属离子和腐殖酸对亚甲基蓝吸附量的影响见图6。由图6a可见,溶液中共存金属离子会降低γ-Fe2O3/SiO2对亚甲基蓝的吸附效率,降低程度从小到大依次为Ca2+,Cu2+,Cr3+。γ-Fe2O3/SiO2对金属离子具有一定的吸附能力,一方面会减少表面吸附位点,另一方面会排斥同样显正电性的亚甲基蓝,故金属离子半径越大,携带电荷越多,吸附效率降低越明显。由图6b可见,少量共存的腐殖酸会促进γ-Fe2O3/SiO2对亚甲基蓝的吸附,过量的腐殖酸则会使吸附效果变差。腐殖酸作为天然大分子聚合物,对水中的重金属、染料等具有良好的吸附和络合作用[10],少量腐殖酸会附着在γ-Fe2O3/ SiO2团聚体表面,共同起到对亚甲基蓝的吸附作用;而过量的腐殖酸不仅会占据大量表面吸附位点,阻塞颗粒孔道,还会降低溶液pH,不利于吸附过程的进行。2.3 吸附动力学
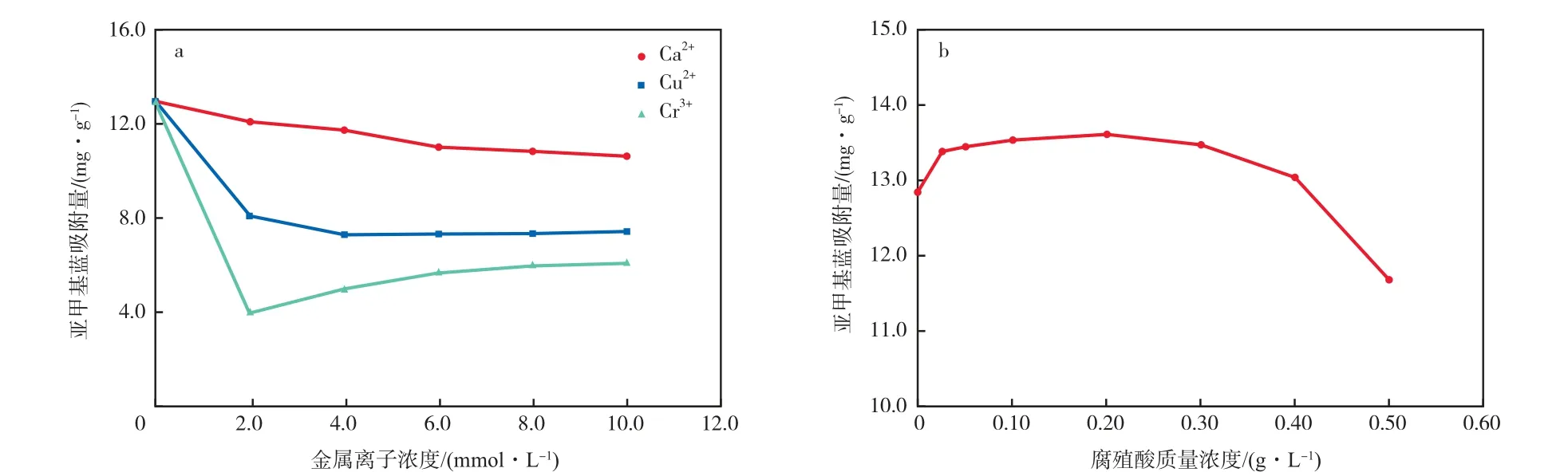
图6 溶液中共存的金属离子(a)和腐殖酸(b)对亚甲基蓝吸附量的影响
分别采用准二级动力学方程(见式(1))和颗粒内扩散方程(见式(2))对γ-Fe2O3/SiO2吸附亚甲基蓝的过程进行拟合[11-13],动力学方程的拟合结果见表1。

式中:t为吸附时间,h;qt和qe分别为t时刻和吸附平衡时的吸附量,mg/g;k2和ki分别为准二级动力学方程和颗粒内扩散方程的反应速率常数,单位分别为g/(mg·h)和mg/(g·h1/2);C为颗粒内扩散方程的截距,mg/g。
由表1可见,γ-Fe2O3/SiO2吸附亚甲基蓝的过程与准二级动力学方程符合较好,与颗粒内扩散方程符合较差。颗粒内扩散方程拟合直线未通过原点,表明颗粒内扩散并不是该吸附过程中唯一的控速步骤。
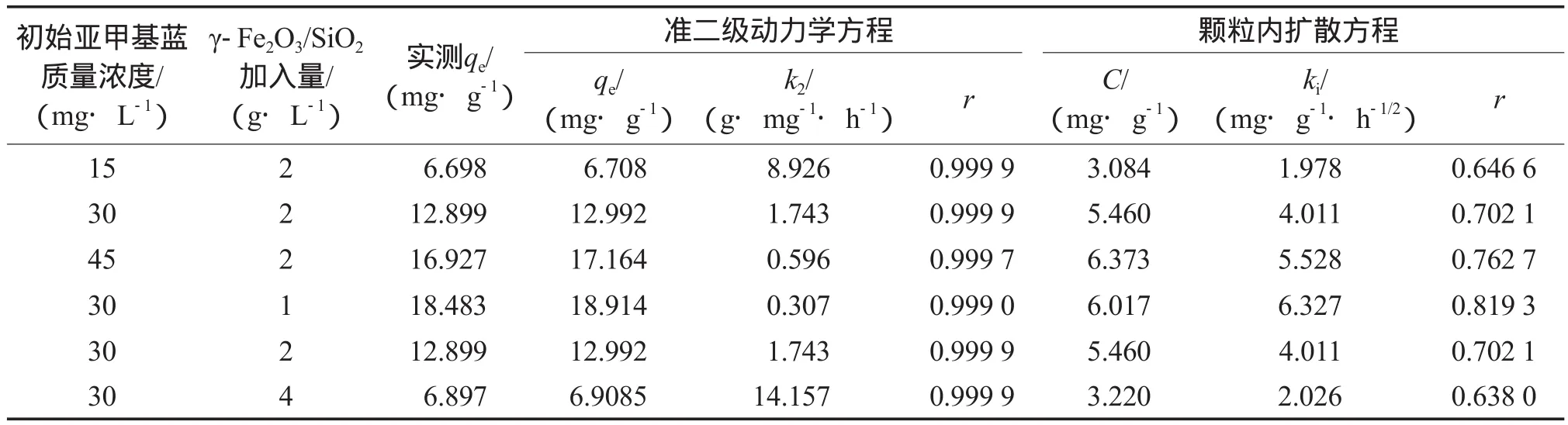
表1 动力学方程的拟合结果
2.4 等温吸附模型
分别采用Langmuir等温吸附模型(见式(3))和Dubinin-Radushkevich(D-R)等温吸附模型(见式(4))对γ-Fe2O3/SiO2吸附亚甲基蓝的过程进行拟合[14-15],等温吸附模型的拟合结果见表2。


式中:ρe为吸附平衡时亚甲基蓝的质量浓度,mg/ L;qsat为饱和吸附量,mg/g;b为吸附系数,L/ mg;β为D-R模型常数,(mol/J)2;ε为Polanyi吸附势,J/mol。ε按式(5)计算。式中:R为气体常数,8.314 J/(mol·K);T为吸附温度,K。

通过式(6)可求出吸附过程的平均活化能(E,kJ/mol)。

由表2可见,Langmuir等温吸附方程比D-R等温吸附方程更适于描述亚甲基蓝在γ-Fe2O3/SiO2上的吸附行为。E的大小可用来推测吸附机理:当E小于8 kJ/mol时,物理吸附占主导作用;当E为8~16 kJ/mol时,吸附可归因于化学离子交换[16]。本工作计算出的E为0.302~0.434 kJ/mol,说明γ-Fe2O3/SiO2对亚甲基蓝的吸附是一个物理吸附过程。
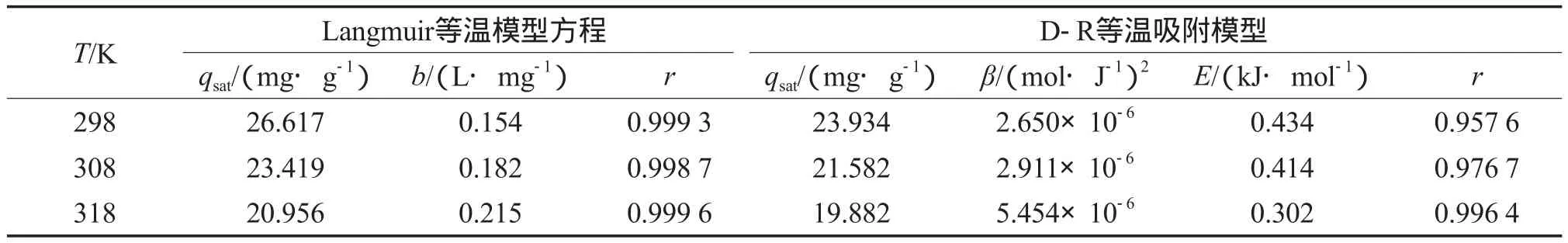
表2 等温吸附模型程的拟合结果
2.5 γ-Fe2O3/SiO2的重复利用
在初始亚甲基蓝质量浓度为30 mg/L、γ-Fe2O3/ SiO2加入量为2 g/L、初始溶液pH为7.0、吸附温度为298 K、吸附时间为4 h的条件下,γ-Fe2O3/SiO2的重复利用实验结果见图7。由图7可见,6种洗涤剂都不能使γ-Fe2O3/SiO2完全恢复吸附性能,其中,用乙醇洗涤的γ-Fe2O3/SiO2使用4次后仍能保持约80%的原吸附量,效果最好。在实际废水处理时,以乙醇为洗涤剂,只需添加少量新的吸附剂就能弥补其吸附性能的下降,完全可以达到重复利用的要求。
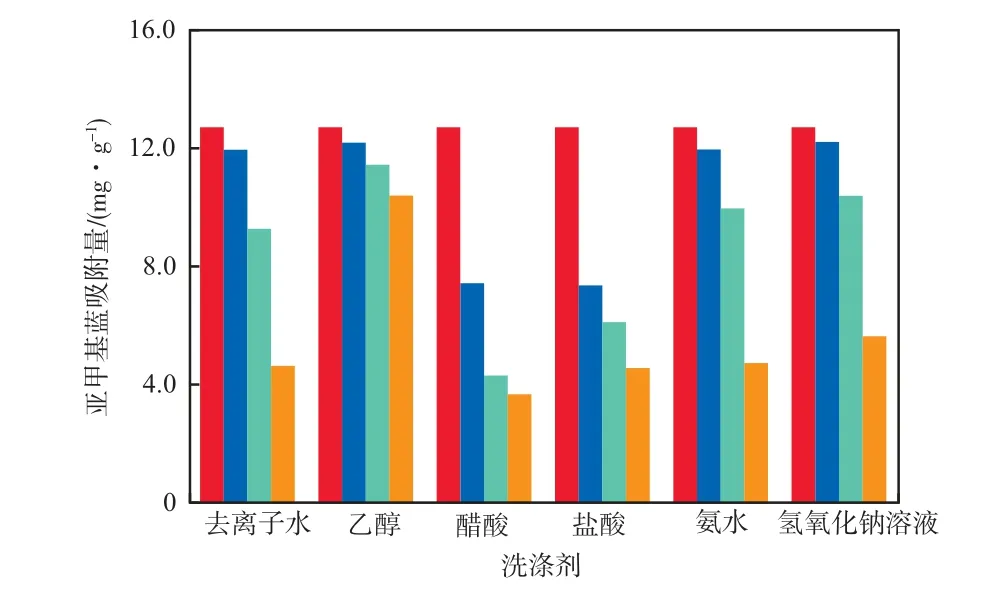
图7 γ-Fe2O3/SiO2的重复利用实验结果γ-Fe2O3/SiO2的使用次数:■ 1;■ 2;■ 3;■ 4
3 结论
a)以纳米γ-Fe2O3为磁性介质制得磁性纳米γ-Fe2O3/SiO2吸附剂。制备的γ-Fe2O3/SiO2呈不规则核壳结构,平均晶粒尺寸为38 nm,比表面积为74.35 m2/g,比饱和磁化强度为55 A·m2/kg。
b)γ-Fe2O3/SiO2对亚甲基蓝的吸附适宜在中碱性条件下进行,4 h即可达吸附平衡;在亚甲基蓝初始质量浓度为180 mg/L、γ-Fe2O3/SiO2加入量为2 g/L、初始溶液pH为7.0、吸附温度为298 K的条件下,吸附量最高为25.4 mg/g;共存金属离子会降低吸附效率,而少量的腐殖酸则会促进吸附。
c)γ-Fe2O3/SiO2对亚甲基蓝的吸附过程符合准二级动力学方程,颗粒内扩散不是唯一的控速步骤;Langmuir等温吸附模型比D-R等温吸附模型更适于描述亚甲基蓝在γ-Fe2O3/SiO2上的吸附行为,该吸附是一个物理吸附过程。
d)用乙醇洗涤的γ-Fe2O3/SiO2使用4次后仍能保持约80%的原吸附量,可达重复利用要求。
[1] Zangeneh H,Zinatizadeh A A L,Habibi M,et al. Photocatalytic Oxidation of Organic Dyes and Pollutants in Wastewater Using Different Modif i ed Titanium Dioxides:A Comparative Review[J]. J Ind Eng Chem,2015,26:1 - 36.
[2] Vakili M,Rafatullah M,Salamatinia B,et al. Application of Chitosan and Its Derivatives as Adsorbents for Dye Removal from Water and Wastewater:A Review[J]. Carbohydr Polym,2014,113:115 - 130.
[3] Alver E,Metin A Ü. Anionic Dye Removal from Aque-ous Solutions Using Modif i ed Zeolite:Adsorption Kinetics and Isotherm Studies[J]. Chem Eng J,2012,200/201/202:59 - 67.
[4] 任南琪,周显娇,郭婉茜,等. 染料废水处理技术研究进展[J]. 化工学报,2013,64(1):84 - 94.
[5] 周露,陈君红,于飞,等. 芬顿试剂法制备磁性碳纳米管及其对亚甲基蓝的吸附性能[J]. 环境化学,2012,31(5):669 - 676.
[6] 卢雪丽,张惠灵,刘雪成,等. 污泥-谷壳吸附剂对混合染料吸附机理的研究[J]. 化工环保,2014,34(3):215 - 218.
[7] 刘亚纳,周鸣,汤红妍,等. 亚甲基蓝在污泥活性炭上的吸附[J]. 环境工程学报,2012,6(7):2339 - 2344.
[8] Zhu Huayue,Jiang Ru,Xiao Ling,et al. A Novel Magnetically Separable γ-Fe2O3/crosslinked Chitosan Adsorbent:Preparation,Characterization and Adsorption Application for Removal of Hazardous Azo Dye[J]. J Hazard Mater,2010,179(1/2/3):251 - 257.
[9] Ahmadi A,Heidarzadeh S,Mokhtari A R,et al. Optimization of Heavy Metal Removal from Aqueous Solutions by Maghemite (γ-Fe2O3)Nanoparticles Using Response Surface Methodology[J]. J Geochem Explor,2014,147(B):151 - 158.
[10] 徐雪松,许端平,褚海艳. 褐煤腐殖酸吸附脱除废水中活性艳红的研究[J]. 安全与环境学报,2011,11(3):62 - 65.
[11] Namasivayam C,Sureshkumar M V. Removal of Chromium(Ⅵ)from Water and Wastewater Using Surfactant Modi fi ed Coconut Coir Pith as a Biosorbent[J]. Bioresour Technol,2008,99(7):2218 - 2225.
[12] Du Gaoxiang,Li Zhaohui,Liao Libing,et al. Cr(Ⅵ)Retention and Transport Through Fe(Ⅲ)-Coated Natural Zeolite[J]. J Hazard Mater,2012,221/222:118 - 123.
[13] Nourmoradi H,Nikaeen M,Khiadani M H. Removal of Benzene,Toluene,Ethylbenzene and Xylene(BTEX)from Aqueous Solutions by Montmorillonite Modified with Nonionic Surfactant:Equilibrium,Kinetic and Thermodynamic Study[J]. Chem Eng J,2012,191:341 - 348.
[14] Nilchi A,Dehaghan T S,Garmarodi S R. Kinetics,Isotherm and Thermodynamics for Uranium and Thorium Ions Adsorption from Aqueous Solutions by Crystalline Tin Oxide Nanoparticles[J]. Desalination,2013,321:67 - 71.
[15] Ranjithkumar V,Sangeetha S,Vairam S. Synthesis of Magnetic Activated Carbon/α-Fe2O3Nanocomposite and Its Application in the Removal of Acid Yellow 17 Dye from Water[J]. J Hazard Mater,2014,273:127 - 135.
[16] Yusan S D,Erenturk S A. Sorption Behaviors of Uranium (Ⅵ)Ions on α-FeOOH[J]. Desalination,2011,269(1/2/3):58 - 66.
(编辑 魏京华)
一种酸性染料工业废水的处理方法
该专利涉及一种酸性染料工业废水的处理方法。包括以下步骤:1)酸性染料工业废水经格栅去除较大的杂质后,进入调节池,进行水量水质的调节;加碱调节废水pH至6~9;2)用泵将废水提升进入一沉池进行预处理;3)废水进入水解酸化池和接触氧化池进行生化处理,出水进入二沉池进行泥水分离,二沉池的污泥一部分回流至好氧池前,一部分排至污泥池;4)二沉池的出水进入中间水池,然后提升至石英砂过滤塔以去除SS和COD,并加入复合絮凝剂;5)将各阶段产生的污泥集中进行污泥压滤脱水后外运,填埋或焚烧。/ CN 104724892 A,2015-07-01一种磁性黏土矿物-聚苯胺复合吸附材料的制备方法
该专利涉及一种磁性黏土矿物-聚苯胺复合吸附材料的制备方法。具体步骤如下:以黏土矿物为无机体,苯胺为有机体,Fe(Ⅲ)盐同时作为氧化剂和磁源,通过联合化学氧化聚合和共沉淀技术,通过一步法制得。该复合材料对Cu2+、Cd2+、Pb2+等重金属离子和水溶性染料具有很好的吸附效果,而且在外加磁场的作用下,可以方便地从溶液中将吸附了重金属离子或染料的磁性吸附剂分离出来。该吸附材料制备原料廉价易得,制备过程简单,反应条件温和,无需氮气保护,成本低廉,使用方便,可快速有效去除重金属离子和水溶性染料。/ CN 104741096 A,2015-07-08
Removal of Methylene Blue from Water Using Magnetic Nano γ-Fe2O3/SiO2
C h e n D o n g,Z e n g Y u b i n,L i Y u a n,W a n g M i a n,L i J i a c h e n
(S c h o o l o f P o w e r a n d M e c h a n i c a l E n g i n e e r i n g,W u h a n U n i v e r s i t y,W u h a n H u b e i 4 3 0 0 7 2,C h i n a)
Magnetic nano γ-Fe2O3/SiO2was prepared using nano γ-Fe2O3as magnetic material,and was used for adsorbing methylene blue from water. The characterization results show that:the product presents irregular core-shell structure with 34 nm of average particle diameter,74.35 m2/g of specific surface area and 55 A·m2/kg of specific saturation magnetization. The experimental results show that:Neutral and alkaline conditions are suitable for adsorption of methylene blue on γ-Fe2O3/SiO2,which can reach equilibrium in 4 h;Under the conditions of initial methylene blue mass concentration 180 mg/L,γ-Fe2O3/SiO2dosage 2 g/L,initial solution pH 7.0 and adsorption temperature 298 K,the highest adsorption capacity is 25.4 mg/g;Coexisting metal ions may reduce the adsorption efficiency,while a small amount of humic acid can promote the adsorption;The adsorption process accords with the pseudo-second-order kinetics equation,intra-particle diffusion is not the only speed-control step;The adsorption isotherm meets Langmuir model,and the adsorption is a physical process;γ-Fe2O3/SiO2still maintain 80% of original adsorption capacity after washed by ethanol and reused for 4 times.
γ-ferric oxide;silica;methylene blue;adsorption;recycling
X703.1
A
1006-1878(2015)05-0481-06
2015 - 04 - 16;
2015 - 07 - 03。
陈东(1990—),男,河南省长葛市人,硕士生,电话 15271898785,电邮 09school@163.com。联系人:曾玉彬,电话13971620799,电邮 zyb_hb@126.com。

