外源激素对纳罗克非洲狗尾草种子休眠的破除效果
罗富成,郭轶敏,彭健,段新慧,许文花,何超,郭凤根
( 云南农业大学动物科技学院草学系,云南昆明650201)
纳罗克(Narok)是禾本科(Gramineae)狗尾草属(Setaria)多年生疏丛型牧草兼地被植物——非洲狗尾草(Setaria sphacelata)的一个优良品种。原产于非洲海拔600 ~2 600 m 的地区,1963 年由Jones 从阿贝尔德尔引入澳大利亚昆士兰[1]。1974 年从澳大利亚引入我国广西,生长良好[2]。1983 年,经澳方专家引入我国云南[3],1997 年11 月经全国牧草审定委员会审定通过并正式登记为引进品种[4]。多年的推广应用表明:纳罗克非洲狗尾草是南方热带、亚热带和暖温带地区草业生产和生态建设的骨干草种[5-6]。该牧草株高1.5 ~2.5 m,在暖温带至南亚热带年降水700 ~2 200 mm、海拔1 000 ~2 200 m 的地区能正常生长发育,开花结实。用作永久性放牧栽培草地,年干物质产量一般可达5 ~10 t·hm-2。高水肥条件单播,收种后一次性刈割,干草产量15 ~22 t·hm-2[7],推广前景十分广阔。但该牧草种子产量低,品质差,休眠严重。大田生产条件下,种子产量一般只有100 kg·hm-2左右,发芽率在10%左右[8],甚至更低,种子供应不足,严重限制了该种优良禾草在我国的推广应用。邓菊芬等[3]对纳罗克非洲狗尾草种子生产关键技术研究表明,在小区试验条件下,其种子产量可达到326.4 kg·hm-2。生产中推广应用“分蘖期刈割两次+抽穗-开花期喷施600 mg·L-1氯丁唑+施75 kg·hm-2尿素+铺膜收种+堆捂+干燥脱粒”技术[3],至少可使其种子产量提高3 倍,可大大缓解种子供求矛盾,但种子休眠机理尚不清楚。本研究以纳罗克非洲狗尾草种子为试验材料,采用GA3、ABA、IBA、6-KT、ETH 溶液进行浸种处理,探讨破除休眠、提高种子活力的途径,旨在为纳罗克非洲狗尾草种子破除休眠提供技术支持。
1 材料与方法
1.1 试验材料
试验材料为云南农业大学种植6 年收获的纳罗克非洲狗尾草种子,2013 年秋收获。其净度、发芽率分别为36.8%和26%。将其杂质完全清除后,用1.5%硫酸铜溶液消毒10 min 用作供试种子。净种子的生活力为76%,休眠率为50%。
1.2 试验方法
1.2.1 样品预处理 分别用赤霉素(GA3)溶液200、400、600 mg·L-1,吲哚丁酸(IBA)溶液10、15、20 mg·L-1,6-糠氨基嘌呤(6-KT)溶液5、15、25 mg·L-1和乙烯利(ETH)溶液150、300、450 μL·L-1处理12、24、36 h。
1.2.2 种子萌发试验
参照云南省技术监督局DB/5300B20001 -91《牧草种子检验规程》[9],将预处理后的种子置于标准发芽床,在人工气候箱内进行发芽试验,以未经处理的种子为对照(CK)。发芽期14 d,温度(30 ±1)℃,24 h 光照,至第7 天和第14 天萌发的百分率分别计为发芽势和发芽率。试验结束后,立即将幼苗烘干,称其干重[10],并按下式计算种子发芽指数和活力指数[11]。3 次重复。
发芽指数(GI)=∑(Gt/Dt);
活力指数(VI)=GI×S。
式中,Gt,某日的发芽数;Dt,与Gt对应的发芽天数;S,单株幼苗干重。
1.3 数据处理
所有数据的整理和作图均用EXCEL 完成,方差分析则用SPSS 17.0 软件完成。
2 结果与分析
2.1 GA 3 对纳罗克非洲狗尾草种子休眠的破除效果
2.1.1 GA3溶液浸种对种子发芽势和发芽率的影响 GA3溶液浸种,对非洲狗尾草种子的萌发具有显著的促进作用(P <0.05)(图1)。在低浓度(200和400 mg·L-1)下,发芽势和发芽率均随浸种时间的延长逐步提高,高浓度(600 mg·L-1)下,则随浸泡时间的延长变化不明显(P >0.05),但均显著高于对照(CK)。从发芽势和发芽率来看,400 mg·L-1GA3溶液浸种24 和36 h 相对较好,发芽势最高达48%,发芽率最高达54%。但仅从发芽势、发芽率的高低来看,尚不能判别这些处理的效果的优劣,还需从发芽指数和活力指数来评判。
2.1.2 GA3溶液浸种对种子发芽指数和活力指数的影响 GA3溶液浸种提高了纳罗克非洲狗尾草种子的发芽指数,在200 mg·L-1浓度下,发芽指数随浸种时间的延长而增加,400 mg·L-1时呈现先增加后降低的趋势;600 mg·L-1浓度下则呈现持续下降的趋势。综合浓度和时间的处理效应,以400 mg·L-1的GA3溶液浸种24 h 的效果最好,种子发芽指数达到19.46,显著高于对照(P <0.05)(图2)。
GA3溶液浸种,对纳罗克非洲狗尾草种子活力指数的影响与其对种子发芽指数的影响一致。其中;400 mg·L-1的GA3溶液浸种24 h 种子活力指数最高(0.015)且显著高于对照(P <0.05),同时也优于其他浓度和时间处理(图2)。
2.2 IBA 对纳罗克非洲狗尾草种子休眠的破除效果

图1 GA 3 溶液浸种对纳罗克种子发芽势和发芽率的影响Fig.1 Effects of GA 3 treatment on germination energy and percentage of Narok seeds

图2 GA 3 溶液浸种对纳罗克种子发芽指数和种子活力指数的影响Fig.2 Effect of GA 3 treatment on germination index and vigor index of Narok seeds
2.2.1 IBA 溶液浸种对种子发芽势和发芽率的影响 低浓度(10 mg·L-1)的IBA 溶液浸种,种子发芽势和发芽率均随浸种时间的延长而逐渐升高;中、高浓度(15、20 mg·L-1)下则随着浸种时间的延长出现先增加后降低的趋势。其中,10 mg·L-1IBA溶液浸种36 h 和20 mg·L-1IBA 溶液浸种24 h,发芽势分别达36%和34%,发芽率均为40%,显著高于对照(P <0. 05),但彼此间差异不显著(P >0.05)(图3)。
2.2.2 IBA 溶液浸种对种子发芽指数和活力指数的影响 不同时间、不同浓度的IBA 溶液浸种对纳罗克非洲狗尾草种子发芽指数的影响与其对种子发芽势和发芽率的影响有一致的趋势,即低浓度处理时间长,高浓度浸种时间则可适当缩短(图4)。10 mg·L-1浓度处理36 h 和20 mg·L-1浸种24 h 是较好的浓度与时间组合,其发芽指数分别达到12.11 和12.28,但与对照及各处理之间差异不显著(P>0.05)。
IBA 溶液浸种,种子活力指数与发芽指数的变化一致,较对照(CK)均有一定程度的提高,但差异不显著(P >0.05),其中20 mg·L-1的IBA 溶液浸种24 h,种子活力指数最高,为0.010(图4)。

图3 IBA 溶液浸种对纳罗克种子发芽势和发芽率的影响Fig.3 Effects of IBA treatment on germination energy and percentage of Narok seeds

图4 IBA 溶液浸种对纳罗克种子发芽指数和种子活力指数的影响Fig.4 Effects of IBA treatment on germination index and vigor index of Narok seeds
2.3 6-KT 对纳罗克非洲狗尾草种子休眠的破除效果
2.3.1 6-KT 溶液浸种对种子发芽势和发芽率的影响 6-KT 溶液的处理浓度和时间对提高纳罗克非洲狗尾草种子的发芽势和发芽率起着关键作用(图5)。5 mg·L-16-KT 溶液浸种24 h 效果最好,发芽势和发芽率分别为37%和42%,种子发芽势和发芽率显著高于对照及除25 mg·L-16-KT 溶液浸种24和36 h 以外的其他处理(P <0.05)。
2.3.2 6-KT 溶液浸种对种子发芽指数和活力指数的影响 6-KT 溶液浸种以后,纳罗克非洲狗尾草种子的发芽指数均呈现先升高后降低的趋势(图6)。其中,5 mg·L-1浓度下浸种24 h 效果较好,种子发芽指数达到12. 43,与对照比较差异显著(P <0.05)。
6-KT 溶液浸种对纳罗克非洲狗尾草种子活力指数的影响不显著(P >0.05)(图6)。其中,只有5 mg·L-1浓度下处理24 h 相对较好,种子活力指数最大(0.010)。
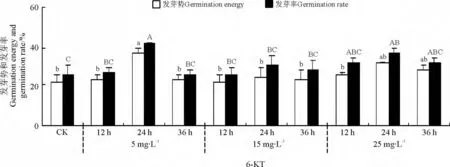
图5 6-KT 溶液浸种对纳罗克种子发芽势和发芽率的影响Fig.5 Effects of 6-KT treatment on germination energy and percentage of Narok seeds

图6 6-KT 溶液浸种对纳罗克种子发芽指数和种子活力的影响Fig.6 Effects of 6-KT treatment on germination index and vigor index of Narok seeds
2.4 ETH 对纳罗克非洲狗尾草种子休眠的破除效果
2.4.1 ETH 溶液浸种对种子发芽势和发芽率的影响 ETH 溶液浸种显著提高了纳罗克非洲狗尾草种子的发芽势和发芽率,随浸种时间的延长而增加(图7)。300 μL·L-1ETH 溶液浸种12 h 效果稍差,发芽势和发芽率较对照差异不显著(P >0.05),其他处理的发芽势和发芽率均显著高于对照(P <0.05),450 μL·L-1处理36 h 种子发芽势和发芽率最高,分别为41%和45%,但浓度和时间的不同处理之间差异不显著(P >0.05)。
2.4.2 ETH 溶液浸种对种子发芽指数和活力指数的影响 150 和300 μL·L-1ETH 溶液浸种24 h、36 h,450 μL·L-1ETH 溶液浸种12、24、36 h,种子发芽指数较对照均有显著提高(P <0.05)(图8),范围为11.95 ~13.96,但彼此之间差异不显著(P >0.05)。
从活力指数的变化来看(图8),ETH 溶液浸种,以450 μL·L-1浓度下浸种24 h 效果最好,种子活力指数达到0.012,明显高于其他处理。
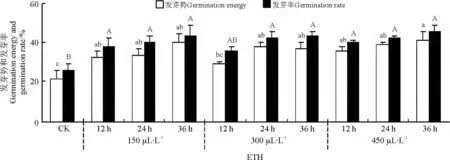
图7 ETH 溶液浸种对纳罗克种子发芽势和发芽率的影响Fig.7 Effects of ETH treatment on germination energy and percentage of Narok seeds

图8 ETH 溶液浸种对纳罗克种子发芽指数和种子活力的影响Fig.8 Effects of ETH treatment on germination index and vigor index of Narok seeds
3 讨论与结论
植物种子的休眠源于植物经过长期进化和演变,从而获得的一种对不利环境及季节变化的一种生物学适应。研究表明,植物激素如赤霉素(GA3)、细胞分裂素(CK)、乙烯利(ETH)等可以使休眠种子中存在的化学抑制物质钝化或失效,同时激活种子内酶的活性,提高种子的发芽率,从而解除种子休眠[12-13]。
GA3是一种常见的植物生长调节剂,处理种子能促使细胞分裂分化进而促进种子胚的发育和种子发芽[14],本研究表明,在几种植物激素中,赤霉素对提高纳罗克非洲狗尾草种子萌发和幼苗生长的促进作用最显著,为最佳的试剂;该结果与大果蔷薇(Rosa vwebbian)种子[15]、猕猴桃(Actinidia chinensis)种子[16]、野生防风种子[17],以及玉竹(Polygonatum odoratum)种子[18]萌发的研究结果相似;但其作用效果与植物的种类密切相关[19]。本研究还发现,所有经GA3处理萌发的种子,均是先长子叶,对照则是先长胚根,说明子叶对赤霉素较敏感。
IBA 可促进细胞分裂和组织分化,从试验结果可以看出,适宜的浓度和处理时间(20 mg·L-1IBA浸种24 h)可以很好地促进种子萌发和生长,但高浓度和长时间处理反而效果不理想,这与孙睿等[20]的研究低浓度IBA 对一串红(Salvia splendens)种子萌发和幼苗生长有一定的促进作用,高浓度的IBA会产生抑制作用结果相一致。
6-KT 具有促进细胞分裂,组织分化及诱导芽分化的作用,可以打破侧芽休眠,促进种子发芽。本研究表明,6-KT 处理对于纳罗克非洲狗尾草种子的发芽有一定影响,发芽率、发芽势、发芽指数和活力指数均高于对照,以5 mg·L-1浓度浸种24 h 效果为最好,以往用6-KT 处理种子的报道较少,但同为细胞分裂素的6-BA 在种子处理中确有很好的表现[21]。
乙烯利是一种优质高效植物生长调节剂,对植株的生长具有一定的后效作用[22],利用乙烯利处理种子后,种子萌发的各项指标较对照显著提高,这与用乙烯利打破休眠薄荷(Mentha arvensis)种子的研究结果一致[23]。ETH 溶液浸种对破除纳罗克非洲狗尾草种子休眠的效果仅次于赤霉素,而IBA 和6-KT 浸种的破眠效果一般。这与激素对蒺藜状苜蓿(Medicago truncatula)种子的研究结果一致[24]。
4 种外源激素对纳罗克非洲狗尾草休眠种子均有不同程度的破眠效果。其中,赤霉素(GA3)处理的效果最好,以400 mg·L-1GA3溶液浸种24 h 效果最好,种子各项活力指标均显著高于对照(P <0.05),发芽势为48%,发芽率为54%,分别较对照提高了1.18 和1.08 倍;发芽指数为19.46,活力指数达到0.015 2,分别较对照提高了1.31 和1.14 倍。乙烯利(ETH)溶液浸种对破除纳罗克非洲狗尾草种子休眠的效果仅次于GA3,以450 μL·L-1ETH溶液浸种24 h 为好。吲哚丁酸(IBA)和6-糠氨基嘌呤(6-KT)对纳罗克非洲狗尾草种子的浸种效果一般,但20 mg·L-1IBA 和5 mg·L-16-KT 浸种24 h,对促进纳罗克非洲狗尾草种子的萌发仍有显著作用(P <0.05)。
[1] Oram R N.Register of Australian Herbage Plant Cultivar[M].Australia:CSIRO,1990:52.
[2] 董宽虎,沈益新.饲草生产学[M].北京:中国农业出版社,2003:156.
[3] 邓菊芬,尹俊,张美艳,马兴跃,王跃东,阙龙云,唐昊. 纳罗克非洲狗尾草种子生产关键技术研究[J]. 草业与畜牧,2010(5):1-6.
[4] 全国牧草品种审定委员会.中国牧草登记品种集[M].北京:中国农业大学出版社,1999:75.
[5] 邓菊芬,马兴跃,尹俊,毕玉芬,唐昊.混合选择对纳罗克非洲狗尾草草种性复壮的影响[J].草业科学,2008,25(1):43-46.
[6] 张美艳,邓菊芬,尹俊.施氮和刈割对纳罗克非洲狗尾草生产特性的影响[J].草业与畜牧,2008(5):10-12.
[7] 奎嘉祥,钟声,匡崇义.云南牧草品种与资源[M].昆明:云南科技出版社,2003:2.
[8] 邓菊芬,张美艳.应用灰色系统理论评价纳罗克非洲狗尾草种子生产的田间栽培技术[J].草原与草坪,2009(1):27-32.
[9] 云南省技术监督局.DB/5300B20001 -91 牧草种子检验规程[S].昆明:1991.
[10] 罗富成,段新慧,彭健,杨超,许文花,郭轶敏,郭凤根.纳罗克非洲狗尾草种子休眠人工破除方法[J].草业学科,2014,31(2):256-263.
[11] 邢妍妍.玉米种子活力形成及休眠机理研究[D].泰安:山东农业大学,2006.
[12] 侯冬花.新疆野生杏种子萌发及抗逆性研究[D].乌鲁木齐:新疆农业大学,2007.
[13] 汪妮,张志轩.低温及赤霉素处理丝棉木种子对其发芽力的影响[J].种子,2010,29(12):95-97.
[14] 安惠霞,胡红旺.3 种化学试剂浸种对黄莲种子发芽率和发芽势影响的试验初报[J].甘肃农业科技,2005(1):47-48.
[15] 李永红,费芳,王春梅.不同化学药剂对大果蔷薇种子萌发的影响[J].中南林业科技大学学报,2010,30(8):53-56.
[16] 安成立,刘占德,刘旭峰,张正品,郭婧.赤霉素对猕猴桃种子萌发的影响[J].种子,2010,29(10):65-67.
[17] 周立业,熊梅.赤霉素对野生防风种子发芽的影响[J].北方园艺,2012,29(10):149-151.
[18] 郑永春,庄倩倩.赤霉素对玉竹种子萌发的影响[J].湖北农业科学,2013,52(24):6087-6089.
[19] Rouhi H R,Shakarami K,Tavakkol Afshari R.Seed treatments to overcome dormancy of waterlily tulip (Tulipa kaufmanniana Regel.)[J].Australian Journal of Crop Science,2010,4(9):718-721.
[20] 孙睿,邵红,王仲,李修平.吲哚丁酸对一串红种子萌发及幼苗生长的影响[J].林业科技,2012,37(3):6-7,30.
[21] 朱进.6-BA 和GA3对山葵种子发芽率和出苗率的影响[J].长江大学学报,2010,7(3):18-19.
[22] 丛超,蒋欣梅,于锡宏.乙烯利对苦瓜种子的萌发及其生长发育的影响[J].中国蔬菜,2010(14):60-63.
[23] 牛文昊,赵岩.不同激素前处理对薄荷种子萌发的影响[J].安徽农业科学,2012,40(21):10857-10858,10869.
[24] 刘建利.激素对蒺藜状苜蓿种子休眠的破除[J].安徽农业科学,2010,38(2):665-667.

