健康成人大脑灰质体积年龄相关性变化的研究
彭飞 耿左军 朱青峰 宋振虎 王亚
正常老化过程中脑萎缩逐渐发生,确定其变化的时间、空间模式有助于阐明老化的潜在机制。基于体素的形态学测量方法(VBM)是一种在体素水平对脑MRI影像进行分析的技术,能定量计算局部灰、白质密度和体积的改变,从而精确地显示脑组织形态学变化。本研究应用VBM分析健康成年人大脑灰质体积的改变,从而进一步探索大脑退化的规律。
1 资料与方法
1.1 一般资料 2012年6月9月招募右利手健康志愿者124例。所有志愿者简易精神状态检查(minimental state examination,MMSE)评分>27分。纳入标准:(1)无任何神经系统疾病的症状及体征;(2)无颅脑手术或外伤史,无高血压、糖尿病、心脏病等基础病或慢性病史;(3)无MRI检查禁忌证,如体内存在心脏起搏器、神经刺激器、金属动脉夹、不可摘除的假牙等金属植入物等;(4)无酗酒、吸烟成瘾、长期服用药物、毒品依赖等;(5)无抽搐、癫痫、痉挛史,无脑炎或脑膜炎史;(6)无各种原因所致的智能障碍;(7)无脑乏氧史,无长期低血糖史;(8)头颅MRI常规扫描未见病灶者;(9)按照上述标准及对扫描获得的图像评估质量,并进行后处理,去除伪影严重及后处理不理想者。所有志愿者均知情并同意接受检查。见表1。
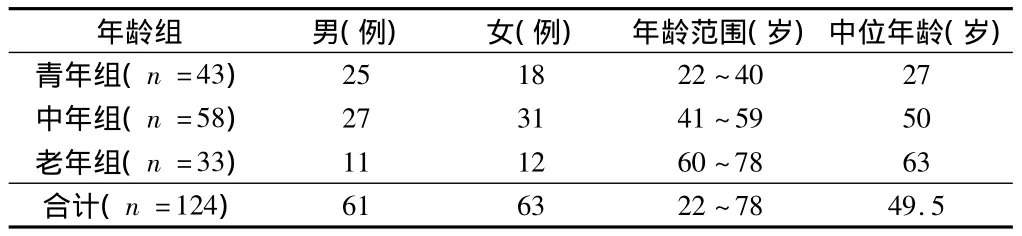
表1 研究对象按年龄、性别的分组
1.2 仪器与方法 采用飞利浦公司Achieva 3.0T超导磁共振设备,标准8通道头部线圈扫描。颅脑常规MRI检查包括:轴位T1WI:TSE序列:TR/TE/TI 3056/7.6/860 ms,FA 90°;轴位 T2WI:TSE 序列:TR/TE 2 000/80 ms,FA 90°;轴位 T2FLAIR:T2FLAIR 序列:TR/TE/TI 10002/130.4/2 400 ms,FA 90°。以上序列层厚均为6.0 mm,层间隔为1.0 mm,矩阵:512 ×256,FOV:24 cm×24 cm,平均激励次数1次;矢状T2WI:TSE 序列:TR/TE 2 000/80 ms,层厚 6.0 mm,层间隔1.0 mm,矩阵:328 ×235,FOV:230 mm ×219 mm ×125 mm,平均激励次数1次。3D T1结构像成像:采用T1-FFE序列行矢状面高分辨三维结构像扫描。扫描基线与前、后联合连线平行。扫描参数:TR/TE 7.7/3.8 ms,翻转角8°,层厚1 mm,层间距为0 mm,体素大小=1×1×1 mm,矩阵为252×227,FOV为250 mm×250 mm×180 mm,扫面层数为180层,扫描时间为2 min 58 s。
1.3 图像后处理 MRI图像通过飞利浦后处理工作站获取。运用SPM8和VBM8对图像数据进行分析。运行环境为:MATLAB R2012a(the Math Works)。应用VBM检测脑容积具体过程如下:(1)空间标准化,选取的模板为ICBM152(international consortium for brain mapping,ICBM)。产生像素大小为1.5 mm×1.5 mm×1.5 mm的脑图像。(2)组织分割,分别得到脑灰质、脑白质及脑脊液图像。(3)平滑处理,选择与一个8 mm半高宽(full width at half maximization,FWHM)的各向同性的高斯滤波器进行卷积,通过此处理可以提高图像的信噪比。(4)对平滑后的灰质结果进行统计分析,同时计算每一个体的GM总体积、WM总体积和CSF总体积,而颅内总体积(total intracranial volume,TIV)为三者体积的总和。
1.4 统计学分析 应用SPSS 13.0统计软件,使用双因素方差分析(two-way analysis of variance,two-way ANOVA)检测每两个年龄组间的GMV差异。将年龄(以组别分为2个水平)和性别(以性别分为男和女两水平)作为两因素,以TIV做为协变量,体素绝对值大于0.1者纳入分析。分别比较两两组间灰质体积的年龄差异(P<0.05,FDR校正)。选取15个以上连续像素的高亮区(Cluster>15)视为组间有显著性差异的区域。
2 结果
3个年龄组间性别构成比差异无统计学意义(P>0.05)。每一组内男、女之间的年龄分布差异无统计学意义(P>0.05)。因组间受教育程度差异无统计学意义(P>0.05),故在MRI图像统计分析中仅将TIV作为协变量。使用双因素方差分析每2组间脑灰质体积差异。两个因素分别为年龄和性别,TIV作为协变量纳入统计模型。
2.1 青年组与中年组之间脑灰质体积差异 青年组与中年组存在显著的年龄主效应(P<0.05,FDR校正),表现为中年组局部灰质体积的下降,主要位于两侧额上回、两侧额下回三角部、右侧额下回眶部、双侧丘脑、双侧颞中回、右侧额上回眶面、右侧颞中极、右侧岛叶、右侧尾状核及右侧顶叶。见表2。
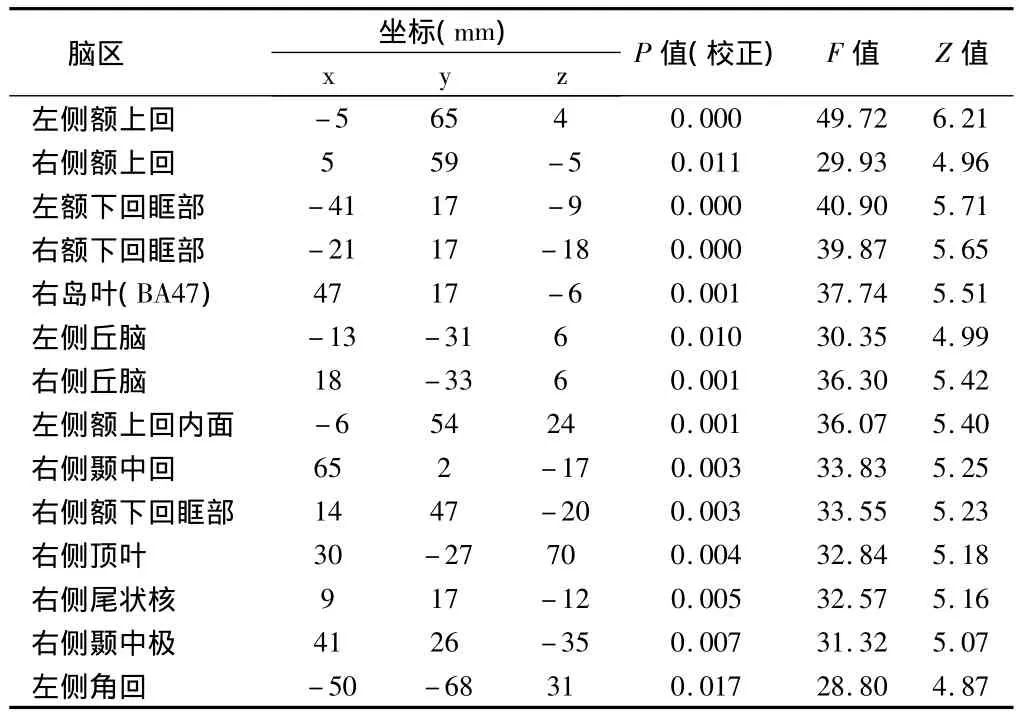
表2 青年组与中年组灰质体积变化的VBM分析
2.2 中年组与老年组之间脑灰质体积差异 中年组与老年组比较存在显著的年龄主效应 (P<0.05,FDR校正),表现为老年组局部灰质体积的下降,主要位于右侧颞中极、杏仁核、扣带回后部、两侧枕叶舌回、两侧海马/海马旁回及两侧颞下极。见表3。
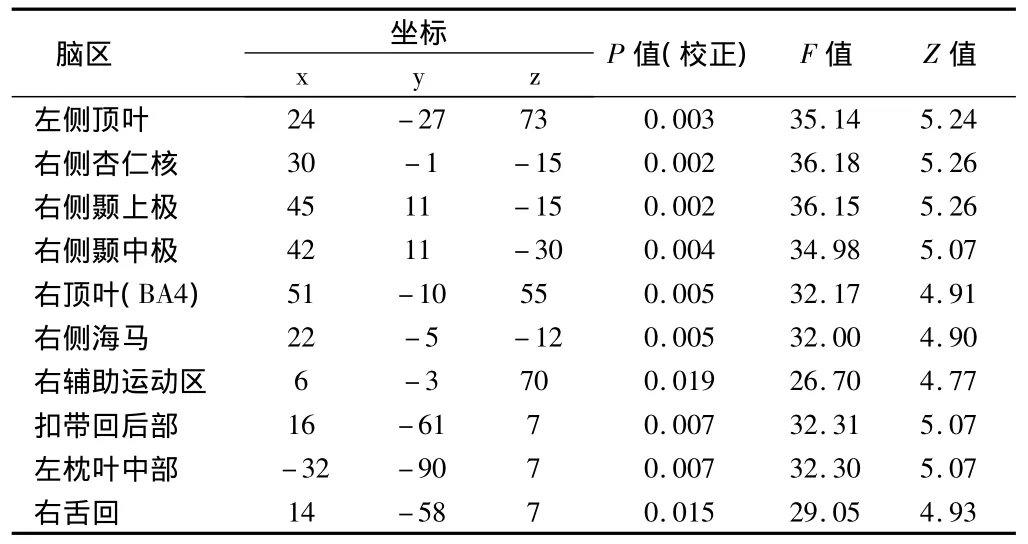
表3 中年组与老年组灰质体积变化的VBM分析
2.3 青年组与老年组之间脑灰质体积差异 青年组与老年组比较存在显著的年龄主效应(P<0.05,FDR校正),表现为除枕叶外,老年组全脑灰质体积的广泛下降。见图1。

图1 应用多角度透视图及3D脑成像显示青年组与老年组2组间灰质体积变化的显著区域
2.4 性别在脑老化过程中对灰质体积的影响 每两组间脑灰质体积比较时,未发现显著的年龄×性别交互效应(P<0.05,FDR校正),提示性别对老化过程中灰质体积的改变的影响不显著。但是当不采用多重对比校正时,可观察到青年组与中年组之间部分脑区,如右侧颞中回、右侧颞上回、左侧角回、右侧枕叶中部、左侧扣带回中部、右额下回三角部,存在年龄×性别交互效应(P<0.01,未采用多重对比校正),表现为女性对上述脑区的保护作用。见表4。
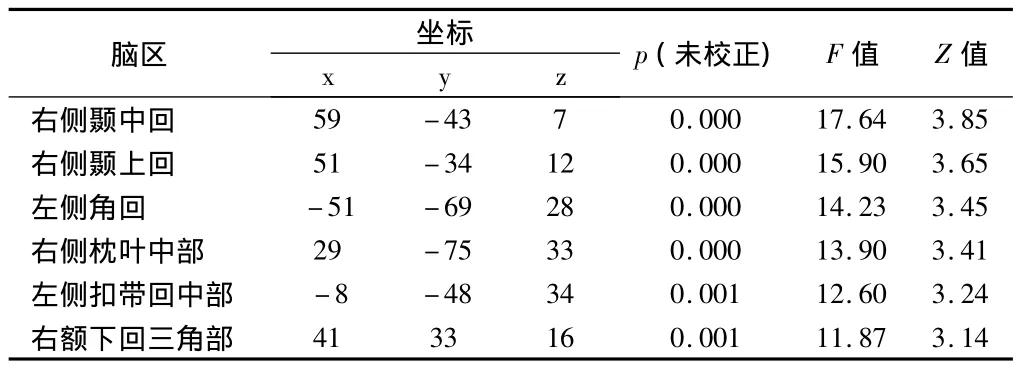
表4 青年组与中年组灰质体积变化中年龄×性别交互效应的VBM分析
3 讨论
双因素方差分析的结果表明绝大部分脑区灰质体积随着年龄的增长而下降,其主要区域位于前额,颞叶,岛叶、扣带回和中央前沟周围灰质,已在文献中证实[1,2]。随着年龄的增长,萎缩范围扩展至右侧颞中极、内侧颞叶(包括海马结构及部分边缘系统)、扣带回后部、两侧枕叶舌回及两侧颞下极等。两侧枕叶大部分脑区未表现出明显的萎缩。
当前的研究明显支持“后进先出”的假说,即最后成熟或开发的脑区最先老化[3]。根据髓鞘化的规律,额叶是最后髓鞘化完成的区域,因此在老化过程中最易受损。之前的那些包括大量超过60岁老年人的研究中,观察到初级皮层在此年龄段灰质体积均表现出相同模式的明显萎缩[4]。这与缺少60岁以上受试者的研究[5]结果形成对比;在此基础上,我们可以提出假说,初级皮层灰质体积随着年龄的增加而下降,但在老年人群(大于60岁成年人)中,只有在覆盖了足够数量的此年龄段受试者的研究中才能体现。此外,同理可以解释即使在无感觉或运动的体征变化的情况下,参与构成中央前回皮质的辅助运动功能区随年龄的增长而改变[6]。MRI形态学研究长报道年龄相关性的初级皮层灰质体积的萎缩,尤其是在感觉运动区及视觉皮层(位于枕叶),但本实验中枕叶皮质区灰质体积无明显变化,其中原因之一可引用上述推理得到接受,虽然本研究中老年组年龄段为60~78岁,但中位年龄在63岁,并且样本个数较少(为总样本量的18.6%),这可能不足以检测老年期视觉皮层的显著性萎缩。第二,此区域年龄相关性改变本身不如前额叶及中央前回等脑区强烈,从而可能更难以检测[2]。
有研究报道大脑灰质体积减少的性别差异,男性比女性灰质体积下降程度更加明显[7]。在相关分析及青年组与中年组方差分析中,显示性别和年龄的交互作用(未采用多重对比校正)。此结果与上述研究相符合。
Murphy等[8]报道,在男性中额叶及颞叶更易受年龄的影响,在女性中海马和顶叶随年龄增长萎缩更加明显。相比之下,健康受试者年龄在30~40岁的研究[9]和健康受试者年龄在60~80岁[10]研究的结果不同,这两项研究均未发现年龄与性别之间的交互效应。但是,这个矛盾的结果可能反映了一个这样的事实:那些包含40~50岁的受试者的研究,即包含更年期年龄受试者的研究,观察到性别和年龄的交互作用,更年期可能是主要的原因。Sherwin等[11]认为雌激素在海马依赖的认知功能有其最深刻的影响,如记忆和学习。在测量平均年龄为67岁的女性大脑体积是发现脑体积与激素治疗(雌激素和孕激素)有关,当应用激素治疗时,额叶、顶叶及颞叶灰质萎缩程度得到改善,尤其是在内侧颞叶,这些区域均是易受年龄影响的脑区[12]。类似结果被另一项 MRI研究证实,相对于过去或从不应用雌激素的研究对象,应用雌激素治疗者拥有更大的海马体积[13]。研究表明,在女性边缘系统和大脑神经认知激活模式的保护时发挥了重要作用[14]。进入老年期后,雌激素分泌减少,雌激素对灰质的保护作用减弱直至消失,因此,在我们的研究中,未发现中年组与老年组之间明显的年龄与性别的交互效应。男性在整个生命过程中,缺少雌激素的保护作用,从而男性灰质体积的年龄相关性萎缩更多的表现为连续的相关性更强的线性模式。
然而,青年组与老年组之间同样未发现性别和年龄的交互作用,其中原因可能是老年组表现出全脑皮质明显的萎缩,年龄对灰质体积的影响充分体现,而掩盖了性别在其中的作用。
假设存在性别和年龄的交互作用,依目前的结果表明,性激素可能影响大脑的老化。此外,男性和女性之间社会互动的差异和动态变化,随着年龄增长,也可以影响大脑衰老模式。在探讨脑老化过程中年龄与性别的交互作用时,还要考虑和匹配受检者健康、疾病以及社会活动的情况。
1 Salat DH,Buckner RL,Snyder AZ,et al.Thinning of the cerebral cortex in aging.Cereb.Cortex,2004,14:721-730.
2 Walhovd KB,Fjell AM,Reinvang I,et al.Effects of age on volumes of cortex,white matter and subcortical structures.Neurobiol Aging,2005,26:1261-1270.
3 Raz N.Ageing and the brain.Encyclopedia Life Sciences,2005,48:1-6.
4 Ziegler DA,Piguet O,Salat DH,et al.Cognition in healthy aging is related to regional white matter integrity,but not cortical thickness.Neurobiol Aging,2010,31:1912-1926.
5 Fjell AM,Westlye LT,Amlien I,et al.High Consistency of Regional Cortical Thinning in Aging across Multiple Samples.Cereb Cortex,2009,19:2001-2012.
6 Kolev V,Falkenstein M,Yordanova J.Motor-response genera-tion as a source of aging-related behavioural slowing in choice-reaction tasks.Neurobiol Aging,2006,27:1719-1730.
7 Fujimoto T,Matsumoto T,Fujita S,et al.Changes in glucose metabolism due to aging and gender-relate ddifferences in the healthy human brain.Psychiatry,2008,164:58-72.
8 Murphy DG,DeCarli C,McIntosh AR,et al.Sex differences in human brain morphometry and metabolism:an in vivo quantitative magnetic resonance imaging and positron emission tomography study on the effect of aging.Arch Gen Psychiatry,1996,53:585-594.
9 Good CD,Johnsrude IS,Ashburner J,et al.A voxel-based morphometric study of aging in 465 normal adult human brains.Neuroimage,2001,14(1Pt 1):21-36.
10 Lemaitre H,Crivello F,Grassiot B,et al.Age-and sex-related effects on the neuroanatomy of healthy elderly.Neuroimage,2005,26:900-911.
11 Sherwin BB,Henry JF.Brain aging modulates the neuro-protective effects of estrogen on selective aspects of cognition in women:a critical review.Front Neuroendocrinol,2008,29:88-113.
12 Erickson KI,Colcombe SJ,Raz N,et al.Selective sparing of brain tissue in postmenopausal women receiving hormone replacement therapy.Neurobiol Aging,2005,26:1205-1213.
13 Lord C,Buss C,Lupien SJ,et al.Hippocampal volumes are larger in postmenopausal women using estrogen therapy compared to past users,never users and men:a possible window of opportunity effect.Neurobiol Aging,2008,29:95-101.
14 Wataru Gonoi,Osamu Abe,Hidenori Yamasue,et al,Age-related changes in regional brain volume evaluated by atlas-based method.Neuroradiology,2010,52:865-873.

