姜黄素对局灶缺血再灌注损伤小鼠学习记忆功能及caspase-8的影响
李焰 刘凤丽 王培培 左慧敏 程冉冉 周燕 李芬
脑缺血性疾病是严重危害人类健康的常见病和多发病。脑缺血损伤所涉及的病理生理机制十分复杂,研究发现,在脑缺血后的几个小时内,缺血半暗带或梗死区周围的神经元死亡主要以凋亡性死亡为主。姜黄素具有抗氧化、抗炎、调节神经递质和受体等作用[1,2]。同时姜黄素在缺血性损伤中的作用越来越得到大家的认可,在前期工作中,我们进行了线粒体凋亡通路中Bcl2及Bax相关因子表达变化影响的研究[3],目前此领域内鲜有对外源性凋亡通路相关因子进行实验研究的报道,本研究采用小鼠局灶性脑缺血再灌注损伤模型,观察姜黄素对缺血再灌注损伤小鼠的caspase-8蛋白表达以及学习记忆功能的影响,从凋亡信号转导通路方面深入探讨姜黄素对小鼠局灶缺血再灌注损伤神经细胞的保护作用的可能分子机制,为临床神经细胞保护新药的开发提供理论研究基础。
1 材料与方法
1.1 实验动物及分组 131只健康雄性昆明小鼠,动物合格证号 SCXK(京)(2007-0001),清洁级(SPF),体重28~32 g,由河北工程大学医学院实验动物中心提供。术前在22~25℃实验室中饲养12 d以适应实验室环境。动物随机分为A组:假手术组20只;B组:缺血再灌组[I/R+0.9%氯化钠溶液(NS)]57只;C组:姜黄素治疗组54只;治疗组于脑缺血前1 h腹腔给予20 mg/kg姜黄素。
1.2 主要试剂 姜黄素购自美国sigma公司,用二甲基亚砜溶解配置10 mg/ml储存液,避光于4℃冰箱保存;Caspase-8兔抗鼠多克隆抗体(Santa cruz biotechnology,Inc)。水迷宫(北京硕林苑科技有限公司);图像采集及图像分析系统(Bio-Rad公司)。TUNEL试剂盒(Roche)。
1.3 动物模型的制备 本实验采用线栓法制备MCAO局灶性脑缺血再灌注模型。将头端涂有适量硅胶的6-0单尼龙线自小鼠右侧颈外动脉向颈内动脉插入,至大脑中动脉与大脑前动脉分叉处(插入深度约为11 mm),阻塞大脑中动脉血流,造成右侧大脑中动脉所辖区缺血。模型成功标准为出现神经功能缺损状态,如不能完全伸展对侧前爪,行走时向左侧转圈,成追尾状,站立不稳,向对侧(左侧)倾倒等。
1.4 脑梗死灶的测定 再灌注24 h后,小鼠断头取脑,续冠状切成2 mm厚的脑片,于2%TTC中染色30 min,4%多聚甲醛固定2 h以上。计算机图像处理系统测量每一脑切片尾侧面的梗塞面积,将各脑切片的梗塞面积乘以2 mm(脑片厚度)再相加,既为梗死灶体积。
1.5 学习和记忆功能测试 为避免小鼠脑损伤后运动功能障碍对水迷宫测试结果的影响,3组分别于伤后第7、8、9及10天进行Morris水迷宫测试。实验时,将安全岛随机置于水迷宫四个象限(N、S、E、W)中的任一象限,加水(奶粉冲呈乳白色)至高过安全岛10 mm,水温保持在22~25℃,由摄象机及计算机自动跟踪、拍摄和统计大鼠分别由其他3个象限入水后寻找到安全岛的轨迹和潜伏值。如在180 s内未找到安全岛,则潜伏期值记为180 s。
1.6 免疫组织化学染色及TUNEL检测 用40 g/L多聚甲醛将小鼠进行大循环灌流固定后,端头取脑,于视交叉前后2 mm处选取顶叶脑组织,于40 g/L多聚甲醛中后固定24 h。常规脱水、透明、浸蜡、石蜡包埋,石蜡连续冠状切片,厚5 μm,行免疫组织化学染色,一抗采用兔抗鼠多克隆抗体,阴性对照用PBS(0.01 mol/L,pH 值7.3)代替一抗孵育,根据免疫组织化学试剂盒进行操作,DAB试剂盒进行显色,细胞核用苏木素复染。细胞凋亡TUNLE检测步骤同说明书。光镜下神经元胞浆或胞核中有棕黄色颗粒的为阳性细胞。每张切片于梗死灶周围缺血侧皮层随机选择10个具有代表性的相互非重叠高倍视野(×400),计算阳性细胞数,取平均值,进行半定量分析。
1.7 western blotting 检测caspase-8蛋白表达 将小鼠端头,取右侧皮质,每100毫克组织样本加入1ml裂解液,低温下组织匀浆12 000 r/min,10 min,离心后取上清液。蛋白变性后加样于SDS聚丙烯酰胺凝胶电泳分离,半干法转至硝酸纤维素膜,牛血清蛋白(BSA)封闭,加一抗兔抗鼠caspase-8、内参3-磷酸甘油醛脱氢酶(GAPDH)4℃过夜,TBST(Tris碱 2.42 g,氯化钠8.00 g,吐温 20 ml,双蒸水定容至 1 000 ml,调节 pH值至7.5)洗涤3次,每次5 min,加碱性磷酸酶藕连的羊抗兔IgG,37℃ 2 h,TBST洗涤3次,加入显色液对甲苯胺蓝/氯化硝基四氮唑蓝,避光显色,至出现条带后用双蒸水终止反应。
1.8 统计学分析 应用SPSS 16.0统计软件,相关性采用pearson方法两两相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 鼠脑大体形态及TTC染色结果 缺血后缺血侧鼠脑肿胀,有明确的梗死灶形成,TTC染色正常脑组织呈红色,缺血灶呈苍白色,缺血灶与大脑中动脉分布区域一致,证实模型制作成功,应用姜黄素后可见明显缩小的梗死灶。见图1。

图1 TTC染色梗死体积
2.2 3组小鼠学习和记忆功能比较 B组第9天(P<0.01)及第10天(P<0.01)搜索安全岛潜伏期较A组明显延长。C组第9天(P<0.01)及第10天(P<0.01)搜索安全岛潜伏期较B组明显缩短。见图2。
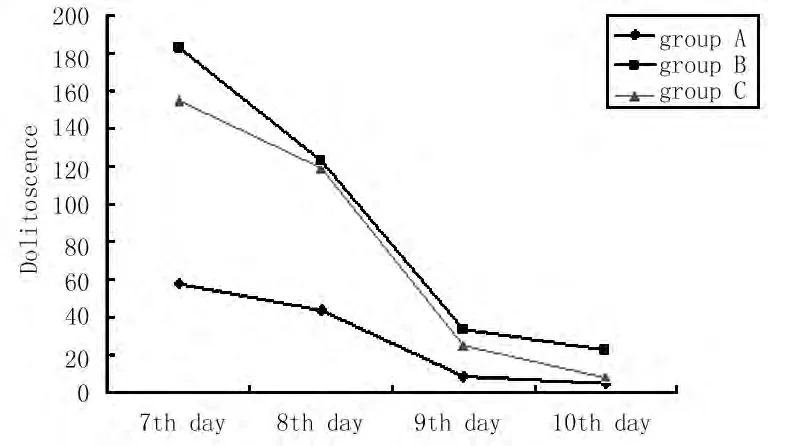
图2 3组小鼠水迷宫实验比较
2.3 caspase-8免疫组织化学观察 caspase-8产物为棕黄色颗粒,定位于神经元胞质。与A组比较,B组3 h后缺血半球半影区皮质caspase-8表达增加,12 h达高峰,24 h逐渐降低,72 h降至A组水平并持续。与B组比较,在缺血半球半影区皮质C组中caspase-8在12 h、24 h、48 h 显著回降(P<0.05)。见图 3,表1。
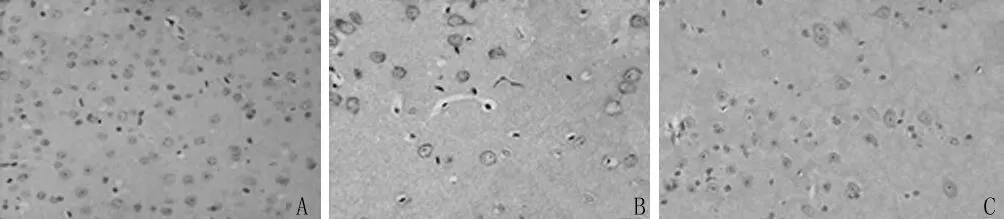
图3 再灌注12 h后3组小鼠皮质区caspase-免疫组化比较
表1 3组caspase-表达的阳性细胞数比较±s

表1 3组caspase-表达的阳性细胞数比较±s
注:与 A 组比较,*P <0.05;与B 组比较,#P <0.05
30 min 3 h 12 h 24 h 48 h 72 h A 组 4.25 ±1.21 4.01 ±1.23 3.78 ±1.22 3.88 ±1.61 4.2组别1 ±1.38 4.26 ±1.52 B 组 5.21 ±1.32 12.21 ±1.56* 32.42 ±1.78* 12.89 ±1.87* 10.36 ±1.65* 4.26 ±1.52 C 组 6.02 ±1.57 11.31 ±1.43* 16.32 ±1.43*# 7.32 ±1.72*# 5.54 ±1.83#5.51 ±1.67
2.4 western blotting检测 caspase-8蛋白表达 caspase-8动态表达规律与免疫组织化学检测结果相符,B组与A组比较,caspase-8在再灌后3 h、12 h、24 h、48 h显著增高(P<0.05)。C组与B组相比caspase-8 在3 h、12 h、24 h 显著回降(P<0.05)。见图4。
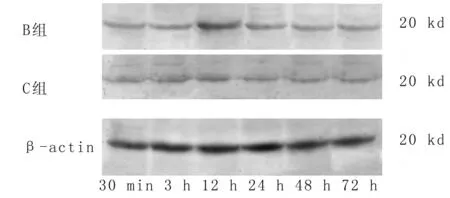
图4 B组和C组caspase-8免疫的蛋白表达
2.5 细胞凋亡检测结果 凋亡神经细胞表现胞质浓缩,染色质凝集,核深染,呈深棕色颗粒状。B组与A组比较,伤后3 h TUNEL阳性细胞开始显著增加(P<0.05),随着时间推移阳性细胞表达逐渐增多,伤后48 h达高峰(P<0.05)。C组TUNEL阳性细胞各时相表达与模型组相似,但TUNEL阳性细胞数明显减少,C 组与 B 组比较,12 h、24 h、48 h(P<0.05)。见表2。
表2 3组凋亡细胞数比较±s
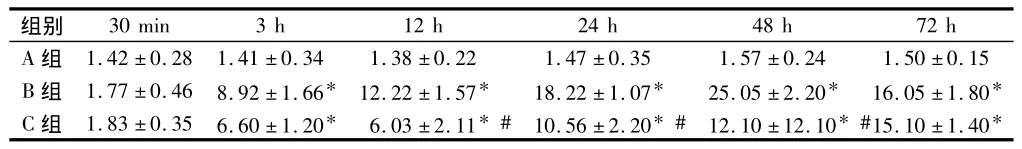
表2 3组凋亡细胞数比较±s
注:与 A 组比较,*P <0.05;与 B 组比较,#P <0.05
组别30 min 3 h 12 h 24 h 48 h 72 h A 组 1.42 ±0.28 1.41 ±0.34 1.38 ±0.22 1.47 ±0.35 1.57 ±0.24 1.50 ±0.15 B 组 1.77 ±0.46 8.92 ±1.66* 12.22 ±1.57* 18.22 ±1.07* 25.05 ±2.20* 16.05 ±1.80*C 组 1.83 ±0.35 6.60 ±1.20* 6.03 ±2.11*# 10.56 ±2.20*# 12.10 ±12.10*#15.10 ±1.40*
3 讨论
缺血性脑血管疾病发病率高、死亡率高、致残率高及复发率高的特点,严重危害了人类的健康和生命。近几十年的研究发现,在脑缺血后的几个小时内,缺血半暗带或梗死区周围的神经元死亡主要以凋亡性死亡为主。也就是说脑缺血损伤与细胞凋亡的关系非常密切,因此脑缺血后神经细胞凋亡机制的探索以及基于抗凋亡为靶点的抗脑缺血药物的研发亦成为研究的热点。姜黄素是从姜黄中提取的酚性色素,姜黄素的保护性作用已在心肌及全脑缺血的动物实验中得到证实,其具体机制也呈现多样化的特点。已发现其具有抗炎、抗氧化、调脂、抗病毒、抗感染、抗肿瘤、抗凝、抗肝纤维化、抗动脉粥样硬化等广泛的药理活性,且毒性低、不良反应小[4],但其对脑缺血再灌注损伤的保护作用机制不祥。本室前期工作已证实姜黄素对小鼠局灶缺血再灌注有一定的保护作用[3],为了更深入探讨其抗凋亡机制本实验从外源性凋亡通路加以探讨,以其为临床新药的开发提供坚实的理论基础。
目前,一般认为参与缺血性脑损伤细胞凋亡调控的有三条信号转导通路,分别是线粒体通路、死亡受体通路和内质网通路[5]。死亡受体通路即外源性细胞凋亡通路,TNF-α或Fas与死亡受体结合后,诱导死亡受体发生寡聚化,形成死亡诱导信号复合体(death inducing signaling complex,DISC),导致 Caspase-8 激活。研究证实caspase-8是关键的启动型caspase,其可通过特殊的细胞信号途径导致caspase-3激活,将凋亡信号传至caspase-3,caspase-3活化物能裂解DNA修复酶,使细胞不可逆地发生凋亡改变,包括核浓缩和DNA断裂,最终导致细胞凋亡[6]。在我们的研究中TTC染色结果显示,C组与B组相比较梗死体积显著缩小,小鼠搜索安全岛潜伏期明显缩短,进一步说明姜黄素在小鼠脑缺血再灌注模型中一定程度上减轻了脑损伤和改善了学习记忆功能,与文献报道[7]一致。Taoufik等[8]研究在永久性脑缺血模型中发现Caspase-8促进了神经细胞凋亡。为了证实姜黄素是否对外源性凋亡通路起作用,我们对Caspase-8进行了观测,免疫组化及免疫印迹结果显示:假手术组脑组织内Caspase-8表达水平极低,主要表达在神经元的胞浆内。在小鼠脑缺血再灌后3 h,大脑皮层Caspase-8蛋白表达开始增加,并于伤后12 h达到高峰。而凋亡细胞检测高峰期出现在伤后48 h,Caspase-8的表达早于凋亡细胞的表达,同时二者的空间表达具有较强的一致性,统计学分析二者的时间变化趋势具有平行性。提示:Caspase-8参与了局灶性脑缺血后的凋亡过程[9],加重了缺血再灌注损伤。与模型组比较,免疫组化及免疫印迹结果均表明姜黄素可显著减少各对应时相点Caspase-8的表达。同时相关分析结果提示Caspase-8阳性细胞数与TUNEL阳性细胞数呈正相关趋势(r=0.794,P<0.01)。所以我们推测姜黄素的神经保护机制之一为:减少Caspase-8的表达,从而减轻细胞凋亡而发挥神经保护作用。
1 Londeau N,Laur Itzen I,Widmann C,et al.A potent protective role of lysopholipida against global cerebral ischemia and glutamate excitotoxitity in neuronal cultures.Cereb Blood Flow Metab,2002,22:821-834.
2 雷军荣,秦军,张晶.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响.中国药理学通报,2010,26:120-123.
3 李焰,程冉冉,周燕,等.姜黄素对小鼠脑缺血再灌注的脑组织中NO含量和Bcl-2、Bax表达的影响.职业与健康2012,28:1157-1159.
4 谌辉,张景辉,刘文琪.姜黄素抗血吸虫病肝纤维化及其机制的实验研究.中草药,2009,40:1274-1277.
5 吴坤,赵艳,于卫平.细胞凋亡的研究进展.国外医学遗传学分册,2001,24:134-138.
6 Ferre I,Planas AM.Signaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra.Neuropatho Exp Neurol,2003,62:329-339.
7 Lei J R,Qin J,Zhang J,et al.Effects of curcumin on inflammatory reaction and blood-brain barrier permeability in rats following cerebral ischemic injury.Chin Pharmacol Bull,2010,26:120-123.
8 Taoufik E,Valable S,Müller GJ,et al.FLIP(L)protects neurons against in vivo ischemia and invitro glucose deprivation-induced cell death.J Neurosci,2007,27:6633-6646.
9 Vikas Kaushal,Lyanne C.Schlichter.Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra.Neuroscience,2008,28:2221-2230.

