FoxM1、Cep55和c-Myc蛋白在基底细胞样乳腺癌中的表达及临床意义
马秋双 周炳娟 张金库 赵文明 赵亚飞
基底细胞样乳腺癌(basal-like breast carcinoma,BLBC)是指具有基底细胞基因表型并伴有不同程度基底细胞角蛋白和(或)肌上皮标记物表达的乳腺癌。BLBC约占全部乳腺癌的8%~20%,具有独特的组织形态特点、易发生远处转移、对传统的内分泌治疗无效、无病生存期与总体生存率均较其他类型的乳腺癌差[1]。目前,对于BLBC的发病机制及影响预后的相关因素尚不清楚。癌症发生重要的环节之一是对转录水平的调节,本研究通过免疫组化方法检测细胞周期中重要的转录因子FoxM1及其下游基因Cep55在BLBC中的表达情况,以探讨其在BLBC发生、发展中的作用。
1 资料与方法
1.1 一般资料 收集保定市第一中心医院病理科2007至2012年手术及会诊的乳腺癌存档蜡块450例,全部标本均经病理证实。所有乳腺癌患者均为女性,术前均未行新辅助化疗和放射治疗。标本均常规取材,10%甲醛固定,常规石蜡包埋,4 μm厚连续切片。根据目前公认的BLBC的免疫表型诊断标准[ER/PR、HER-2阴性,CK5/6 和(或)EGFR 阳性],筛选出BLBC病例66例[年龄24~71岁,平均年龄(48±12)岁]及癌旁正常癌旁乳腺组织(距肿瘤边缘5 cm)66例,NON-BLBC 70例[年龄22~85岁,平均(51±18)岁]。
1.2 试剂 兔抗人FoxM1多克隆抗体购自美国Abcam公司,兔抗人Cep55多克隆抗体购自北京博奥森公司,兔抗人c-Myc多克隆抗体,兔抗人ER、兔抗人PR、兔抗人HER2、鼠抗人 CK5/6、鼠抗人 EGFR、即用型快捷免疫组化MaxVisionTM检测试剂盒和对氨基联苯胺(DAB)显色试剂盒均购自福州迈新公司。
1.3 方法
1.3.1 免疫组化:采用免疫组化方法(EnVision二步法)检测BLBC、NON-BLBC及癌旁乳腺组织中FoxM1、Cep55的表达情况,所有操作步骤均依据产品说明书进行,采用柠檬酸修复液(pH值6.0)高温高压修复抗原,以FoxM1、Cep55及c-Myc阳性的胃癌组织作为阳性对照,以磷酸盐缓冲液(PBS)替代一抗作为阴性对照,对氨基联苯胺(DAB)显色,苏木精复染,中性树胶封固。
1.3.2 结果判定:FoxM1阳性表达显示棕黄色均匀细颗粒位于细胞核,少量出现于胞浆,Cep55阳性表达显示棕黄色均匀细颗粒位于细胞浆,c-Myc阳性表达棕黄色均匀细颗粒位于细胞核。免疫组化结果由两位高年资病理医师采用盲法高倍镜下对每张切片随机选择5个视野,每个视野计数100个细胞,采用半定量计分方法,根据着色强度(A)和阳性细胞所占比例(B)两者乘积来判定。(A)着色强度按下列标准评定记分:无色0分,淡棕色1分,棕黄色2分,棕褐色3分;(B)阳性细胞所占比例按下列标准评定记分:<25%为1分,26% ~50%为2分,51% ~75%为3分,>75%为4分。两项得分相乘(A×B),将结果分为4个等级:阴性(0~1分)、弱阳性(2~4分)、中度阳性(5~8分)、强阳性(9~12分),>2分视为阳性结果[2]。
1.4 统计学分析 应用SPSS 17.0统计软件,FoxM1、Cep55及c-Myc蛋白的表达及其与BLBC的临床病理因素的分析采用χ2检验,FoxM1、Cep55及c-Myc相关性分析采用spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 FoxM1、Cep55及c-Myc蛋白在 BLBC和癌旁正常乳腺组织中的表达情况
2.1.1 FoxM1蛋白免疫组化的阳性表达显示棕黄色均匀细颗粒,主要位于细胞核,少量出现于胞浆。FoxM1蛋白在BLBC、NON-BLBC及癌旁正常乳腺组织中的阳性表达率分别为77.3%(51/66)、60.0%(42/70)和13.6%(9/66)。BLBC中FoxM1蛋白的阳性表达率明显高于NON-BLBC和正常组,差异有统计学意义(P<0.05)。而基底细胞样乳腺癌组与非基底细胞样乳腺癌组相比,c-Myc的阳性率差异有统计学意义(P<0.05)。见表1,图 1。
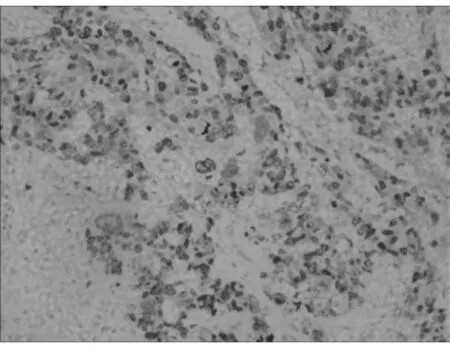
图1 FoxM1在BLBC中的阳性表达(IHC×100)
2.1.2 Cep55蛋白免疫组化的阳性表达显示棕黄色均匀细颗粒,位于细胞浆。Cep55蛋白在BLBC、NONBLBC及癌旁正常乳腺组织中的阳性表达率分别为74.2%(49/66)、57.1%(40/70)和 16.7%(11/66)。BLBC中Cep55蛋白的阳性表达率明显高于NONBLBC和正常组,差异有统计学意义(P<0.05)。而基底细胞样乳腺癌组与非基底细胞样乳腺癌组相比,c-Myc的阳性率差异有统计学意义(P<0.05)。见表1,图2。
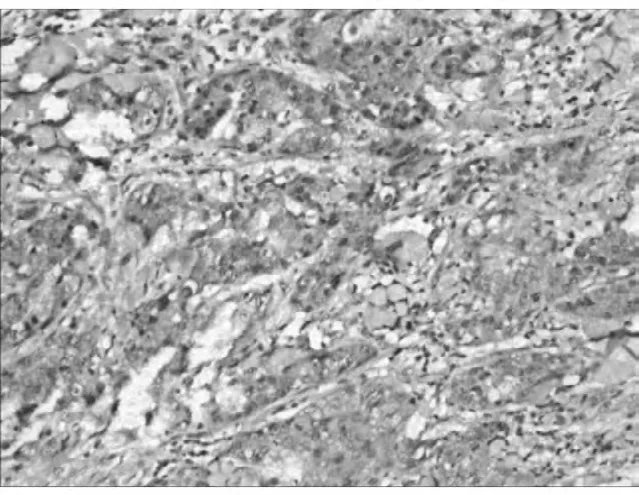
图2 Cep55在BLBC中的阳性表达(IHC×100)
2.1.3 c-Myc蛋白免疫组化的阳性表达显示棕黄色颗粒,主要位于细胞核。c-Myc蛋白在 BLBC、NONBLBC及癌旁正常乳腺组织中的阳性率分别为71.2%(47/66)、64.3%(45/70)和 22.7%(15/66)。BLBC中c-Myc的阳性率高于NON-BLBC和正常组,差异有统计学意义(P<0.05)。而基底细胞样乳腺癌组与非基底细胞样乳腺癌组相比,c-Myc的阳性率差异有统计学意义(P<0.05)。见表1,图3。
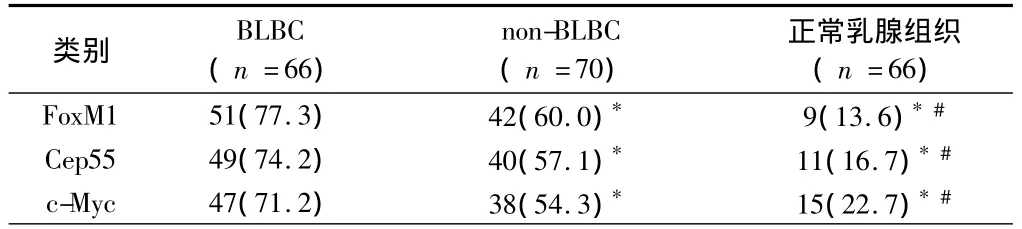
表1 FoxM1、Cep55及c-Myc在3组中的表达情况 例(%)
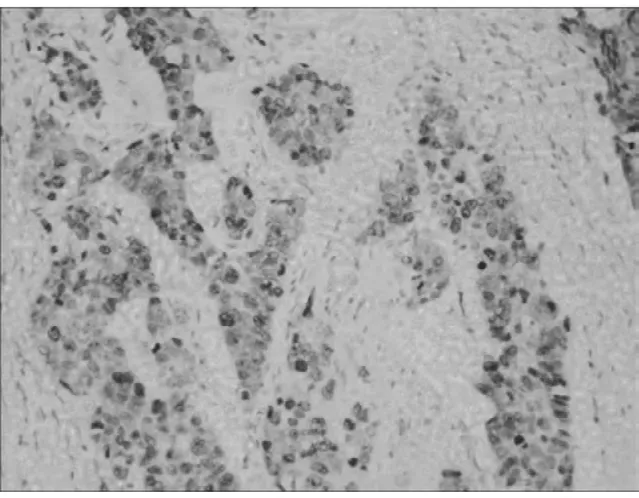
图3 c-Myc在BLBC中的阳性表达(IHC×100)
2.2 FoxM1、Cep55 及 c-Myc蛋白的关系
2.2.1 FoxM1蛋白与 Cep55蛋白在BLBC中的表达呈正相关关系(r=0.259,P<0.05)。见表2。

表2 FoxM1、Cep55在BLBC中的表达关系 例
2.2.2 FoxM1蛋白与c-Myc蛋白在 BLBC中的表达呈正相关关系(r=0.294,P<0.05)。见表3。
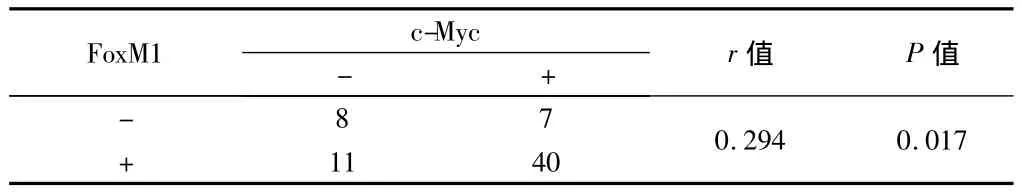
表3 FoxM1、c-Myc在BLBC中的表达关系 例
2.2.3 Spearman相关分析检验得出,Cep55蛋白与c-Myc蛋白在BLBC中的表达无相关性(r=0.221,P>0.05)。见表4。

表4 c-Myc、Cep55在BLBC中的表达关系 例
2.3 FoxM1、Cep55及c-Myc蛋白的表达与 BLBC临床病理因素的关系 FoxM1蛋白、Cep55蛋白及c-Myc在BLBC中的表达与淋巴结转移及TNM分期有关(P<0.05),而与年龄、绝经与否、肿瘤大小无关(P>0.05)。见表5。
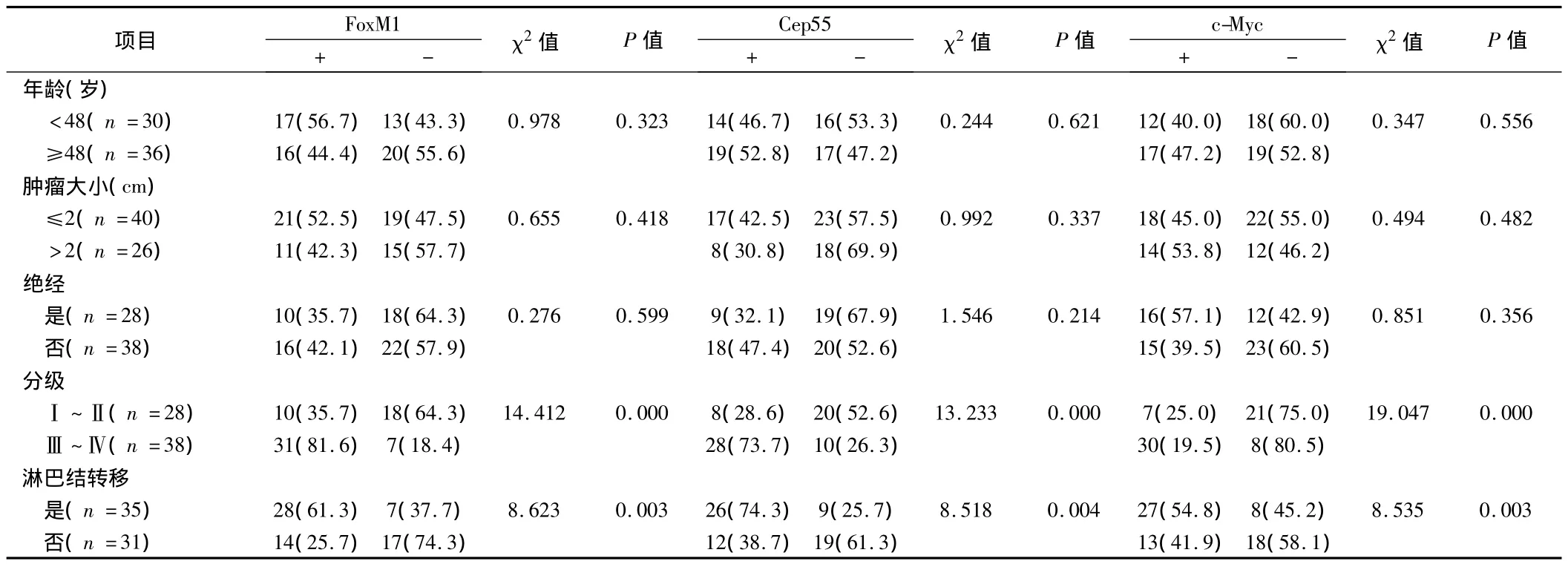
表5 FoxM1、Cep55及c-Myc的表达与BLBC临床病理特征的关系
3 讨论
乳腺癌是女性常见的恶性肿瘤,严重影响着女性的生存及生活质量,目前根据cDNA组织芯片基因表型将乳腺癌分为5种分子亚型,即管腔A型(luminal subtype A)、管腔B型(luminal subtype B)、正常乳腺样型(normal breast-like subtype)、HER-2过表达型(HER-2 over-expression subtype)以及基底细胞样型(basal-like subtype)[3]。作为新近发现的乳腺癌亚型,基底细胞样乳腺癌以其独特的组织学形态、较差的生物学行为越来越多的引起医学界的关注,本研究采用免疫组化的方法初步探讨了与BLBC发生、发展密切相关的因素,以期为BLBC寻找特异性的基因治疗靶点提供理论依据。
转录水平的调控是癌症发生的一个重要方面,同时也是基因靶向治疗的一个方向[4]。FoxM1是Forkhead Box(Fox)转录因子家族的重要成员之一,位于染色体12p13.3,全长约 25kb,具有 A、B、C3 个亚型[5]。FoxM1在多种恶性肿瘤组织中过表达,如胃癌[6]、胰腺癌[7]、肝癌[8]、大肠癌[9]和宫颈癌[10]等。其可能机制为参与细胞周期的调控,促进G1/S的过渡导致肿瘤细胞增殖[11];调节VEGF的信号通路,促进肿瘤新生血管的形成[12];激活参与 ECM 降解酶(如 MMPs)的转录促进肿瘤的浸润与迁移[7];参与并维持干细胞多能性等[13]。本研究发现,FoxM1蛋白在BLBC中的阳性表达率明显高于癌旁正常乳腺组织及NON-BLBC,提示FoxM1可能与BLBC的发生、发展有关,同时数据显示FoxM1蛋白的表达与BLBC的TNM分期及淋巴结转移相关,表明FoxM1的过表达与BLBC的侵袭能力密切相关,可能是BLBC预后不良的原因之一。
中心体是哺乳动物细胞内的微管组织中心,参与纺锤体的装配,在胞质分裂中起重要调控作用。最新发现的中心体相关蛋白Cep55(centrosomal protein,55 kD)属于卷曲螺旋(coiled-coil)蛋白质家族成员,其基因定位于人染色体 10q23.33[14,15]。该蛋白质在多种正常组织及肿瘤细胞中均有表达。Cep55参与细胞周期中的中心体和中间体偶联,被Erk2、Cdk1及Plk1共同磷酸化后发挥细胞周期调控作用[16]。本研究结果显示,Cep55蛋白在BLBC中的阳性表达率明显高于癌旁正常乳腺组织及NON-BLBC,同时,Cep55蛋白的表达与BLBC的TNM分期及淋巴结转移有关,提示Cep55蛋白的过表达可能参与BLBC的发生、发展。
Cep55是FoxM1的下游靶基因,与FoxM1共同参与调节细胞的分化、增殖、细胞凋亡以及维持干细胞多能性等生理过程[16]。Erk2是Ras-MAPK信号通路的信号分子,FoxM1使Ras-MAPK信号通路持续激活而影响Erk2的激活状态,Erk2和Cdk1,Plk1在细胞周期中可依次将Cep55蛋白的S425/S428、S436磷酸化使其激活而发挥作用[17]。由此可见,FoxM1不但调控着Cep55的转录与生成,还通过Ras-MAPK信号通路影响其活性,这可能是FoxM1促进细胞增殖的机制之一。本研究结果显示FoxM1与Cep55在BLBC中的表达呈正相关性,进一步支持FoxM1与Cep55之间的相互作用关系,并推测可能由于FoxM1的过表达增加了Cep55的稳定性,过表达的FoxM1单独或与Cep55协同促进BLBC的侵袭、转移。
c-Myc基因是一种序列特异性转录因子,其定位于染色体8q24.12-13,主要包括3个成员:c-Myc1、c-Myc2 和 c-MycS[18,19]。该基因主要激活方式是基因扩增、重排或过度表达[20]。其编码蛋白定位于细胞核内,具有转录因子活性,有调节细胞周期、促进细胞增殖、刺激血管生成、抑制细胞分化、参与细胞凋亡等作用[21]。在肺癌、胃癌、肝癌等多种恶性肿瘤[22]中均异常表达。Rummukainen等[23]发现c-Myc基因扩增水平增高与乳腺癌中的组织学级别较高、PR阴性、DNA非整倍体、较高的S期指数等因素有关。张宏武[24]还发现在乳腺癌中c-Myc的基因扩增及蛋白过表达均与ER阴性显著相关。另有研究发现c-Myc基因在luminal型和Her-2过表达型表达量低,而在基底细胞样乳腺癌中表达水平较高[25,26]。本研究结果显示,基底细胞样乳腺癌组织中c-Myc蛋白的表达明显高于正常乳腺组织及non-BLBC,且与BLBC的TNM分期及淋巴结转移有关(P<0.05),提示c-Myc表达水平升高可能与基底细胞样乳腺癌的发生、发展具有相关性,并且可能参与BLBC的侵袭。
同时c-Myc亦是FoxM1的下游靶基因,与FoxM1共同参与调节细胞的分化、增殖、细胞凋亡等生理过程。Guney等[27]现在受到FoxM1siRNA干扰的胃癌细胞中c-Myc的mRNA和蛋白表达水平都发生下调。本研显示FoxM1与c-Myc在BLBC中的表达呈正相关性,说明FoxM1与c-Myc在基底细胞样乳腺癌的发生、发展中存在协同关系,其相互作用的可能机制为:(1)作为一个常规的转录因子,通过与靶基因核心启动子上游结点的结合(5’-A-C/TAAA-C/T-AA-3’)而发挥作用[28];(2)FoxM1直接结合TATA盒框,转录活化人类c-MycP1和P2启动子[29]过MEK/Erk1/2信号途径抑制c-Myc的表达后,c-Myc通过与FoxM1启动子序列的E-box元件相互作用下调FoxM1表达,降低c-Myc及其靶基因hTERT在内的下游基因的表达,构成了c-Myc-FoxM1的正反馈环,介导肿瘤细胞的生长抑制[30]。
Cep55与c-Myc之间的相互作用没有文献报道,而本实验研究结果显示二者之间没有相关关系,说明两者可能通过不同的作用途径对基底细胞样乳腺癌的发生发展及浸润转移产生影响,相关机制有待进一步实验研究。
1 Lin Y,Lin S,Watson M,et al.A gene expression signature that predicts the therapeutic response of the basal-like breast cancer to neoadjuvant chemotherapy.Breast Cancer Res Treat,2010,123:691-699.
2 Song LB,Zeng MS,Liao WT,et al.Bmi1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells.Cancer Res,2006,66:6225-6232.
3 Kapa AV,Jeffery SS,Lanferod A,et al.Discovery and validation of breast cancer subtypes.BMC Genomics,2006,7:231.
4 Ahmad A,Wang Z,Kong D,et al.FoxM1 down-regulation leads to inhibition of proliferation,migration and invasion of breast cancer cells through the modulation of extra-cellular matrix degrading factors.Breast Cancer Res Treat,2009,122:337-346.
5 崔健,郭泰林,茆灿泉.FoxM1的分子进化、结构与蛋白调控及与肿瘤的关系.肿瘤防治研究,2011,38:1329-1331.
6 Zeng J,Wang L,Li Q,et al.FoxM1 is up-regulated in gastric cancer and its inhibition leads to cellular senescence,partially dependent on p27 kip.J Pathol,2009,218:419-427.
7 王花,李雯.转录因子FoxM1与胰腺导管癌临床病理特征和预后关系的研究.广州:中山大学,2010.
8 Wang Z,Ahmad A,Banerjee S,et al.FoxM1 is a novel target of a natural agent in pancreatic cancer.Pharm Res,2010,27:1159-1168.
9 唐慧,邹云莲,朱军,等.应用基因芯片技术筛选结直肠腺瘤-癌序列相关基因的初步研究.中华消化内镜杂志,2009,26:527-532.
10 Chan DW,Yu SY,Chiu PM,et al.Over-expression of FoxM1 transcription factor is associated with cervical cancer progression and pathogenesis.Pathol,2008,215:245-252.
11 Nakamura S,Hirano I,Okinaka K,et al.The FOXM1 transcriptional factor promotes the proliferation of leukemia cells through modulation of cell cycle progression in acute myeloid leukemia.Carcinogenesis,2010,31:2012-2021.
12 Zhang Y,Zhang N,Dai B,et al.FoxM1B transcriptionally regulates vascular endothelial growth factor expression and promotes the angiogenesis and growth of glioma cells.Cancer Res,2008,68:8733-8742.
13 Bao B,Wang Z,Ali S,et al.Over-expression of FoxM1 leads to epithelial-mesenchymal transition and cancer stem cell phenotype in pancreaticcancer cells J Cell.Cell Biochem,2011,112:2296-2306.
14 Fabbro M,Zhou BB,Takahashi M,et al.Cdk1/Erk2-and Plk1-Dependent Phosphorylation of a Centrosome Protein,Cep55,Is Required for Its Recruitment to Midbody and Cytokinesis.Developmental Cell,2005,9:477-488.
15 李传芬,荆文,杜会芹,等.调控胞质分裂的中心体相关蛋白Cep55.生命化学,2006,26:487-489.
16 Waseem A,Ali M,Odell EW,et al.Downstreamtargets of FoxM1:CEP55 and HELLS are cancerprogressionmarkers of head and necksquamouscellcarcinoma.Oral Oncology,2010,46:536-542.
17 Martinez-Garay I,Rustom A,Gardes HH,et al.The novelcentrosomalassociatedproteinCEP55 is present in the spindlemidzone and the midbody.Genomics,2006,87:243-253.
18 Xiao Q,Claassen G,Shi J,et al.Transactivation-defective c-MycS retains the ability to regulate proliferation and apoptosis.Genes Dev,1998,12:3803-3808.
19 Facchini LM,Penn LZ.The molecular role of Myc in growth and transformation:recent discoveries lead to new insights.FASEB J,1998,12:633-651.
20 McNeil CM,Serqio CM,Anderson LR,et al.c-Myc overexpression and endocrine resistance in breast cancer.Steroid Bioehem MolBiol,2006,106:147-155.
21 Hemann MT,Bric A,Teruya-Feldstein J,et al.Evasion of the p53 tumour surveillance network by tumour-derived MYC mutants.Nature,2005,436:787-789.
22 邓君,饶绍琴,黄文芳.C-erbB2、c-Myc和CCNDl mRNA联合检测在乳腺癌诊断中的应用.实用医院临床杂志,2011,8:21-23.
23 Rummukainen JK,Salminen T,Lundin J,et al.Amplification of c-Myconcogene by chromogenic and fluorescence in situ hybridization in archival breast cancer tissue array samples.Lab Invest,2001,81:1545-1551.
24 张宏武.c-Myc、FAK、Her-2、CCND1及 TopoⅡa在乳腺癌中的变化及其与临床病理指标的关系.北京:中国协和医科大学,2007.
25 Sorlie T,Perou CM,Tibshirani R,et al.Geneexpression patterns ofbreastcarcinomas distinguishtumor subclasses with clinical implications.Proc Natl Acad Sci USA,2001,98:10869-10874.
26 Sotiriou C,Neo SY,McShane LM,et al.Breastcancer classification and prognosis based on geneexpression profiles from a population-based study.Proc Natl Acad Sci USA,2003,100:10393-10398.
27 Guney I,Wu S,Sedivy JM.Reduced c-Myc signaling triggers telomereindependent senescence by regulating Bmi-1 and p16(INK4a).Proc Natl Acad Sci USA,2006,103:3645-3650.
28 Wierstra I,Alves J.FOXM1c is activated by cyclin E/Cdk2,cyclin A/Cdk2,and cyclin A/Cdk1,but repressed by GSK-3alpha.BiolChem Biophys Res Commun,2006,348:99-108.
29 Wierstra I,Alves J.Despite its strong transactivation domain,transcription factor FOXM1c is kept almost inactive by two different inhibitory domains.Biol Chem,2006,387:963-976.
30 Cole MD,McMahon SB.The Myc oncoprotein:a critical evaluation of transactivation and target gene regulation.Oncogene,1999,18:2916-2914.

