外源性一氧化碳抗大鼠肢体缺血再灌注所致心肌损伤的实验研究
李婧 杨香敏 宋巧 卢海丽 陈娜 史万英
再灌注严重的缺血肢体后,该肢体的损伤反而会加重,甚至引发其他远隔器官的损伤,该现象为缺血再灌注(ischemia reperfusion,IR)损伤,心肌是对缺血较为敏感的组织之一。肢体IR过程产生的大量活性氧物质和炎性介质,进而使中性粒细胞(polymorphonuclear neutrophil,PMN)在心大量扣押,这是肢体IR后心肌损伤发生的中心环节。血红素氧合酶-1(HO-1)是近来发现的一种可被氧化应激和炎性反应所激活、并对机体具有保护作用的热休克蛋白,其催化产物一氧化碳(CO)具有抗炎性、抗氧化损伤等重要功效。本文主要研究外源性CO对于肢体IR所致缺血肢体的作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物 实验中,22只8个月大SD雄性大鼠(清洁级),体重220~250 g,由河北省实验动物中心提供(动物许可证号,冀504085),随机分3组,2只为假手术组(S组);10只为IR组;10只为IR吸入CO组(RC组)。
1.2 方法 隔离暴露3组右后肢股动脉根部,采用无创血管夹交紧,并把创口进行缝合,用止血带绑扎右后肢根部,造成大鼠肢体缺血。实验4 h后,除去血管夹和橡皮筋,并灌注48 h,以复制大鼠肢体IR模型。手术后4 h开始进行RC组,让大鼠持续吸入含有CO(500 ppm)的医用空气4 h,每间隔12 h后再吸入4 h,连续进行3次,共12 h;IR组和S组均在正常空气中呼吸。实验后,逐一检查各心肌组织学及横纹改变情况,应用流式细胞仪检测肌组织中Bax、Bcl-2及凋亡百分比的值;应用全自动生化分析仪检测肌酸激酶同工酶(CK-MB)和血清乳酸脱氢酶(LDH)表达的变化。
1.3 统计学分析 应用SPSS 11.0统计软件,计量资料以±s表示,采用方差分析和q检验,P<0.05为差异有统计学意义。
2 结果
2.1 外源性CO对心肌组织学的影响 S组心肌细胞形态正常。IR组心肌细胞胞体增大,部分肌细胞变性、甚至坏死;肌浆溶解、被破坏,胞核消失,呈空泡状;闰盘结构不清;胞间有大量的中性粒细胞浸润,且广泛出血。RC组肌组织损伤显著减轻,可见部分肌细胞变性,肌浆含有空泡,呈灶状溶解,大部分肌细胞肿大程度减轻。见图1、2。
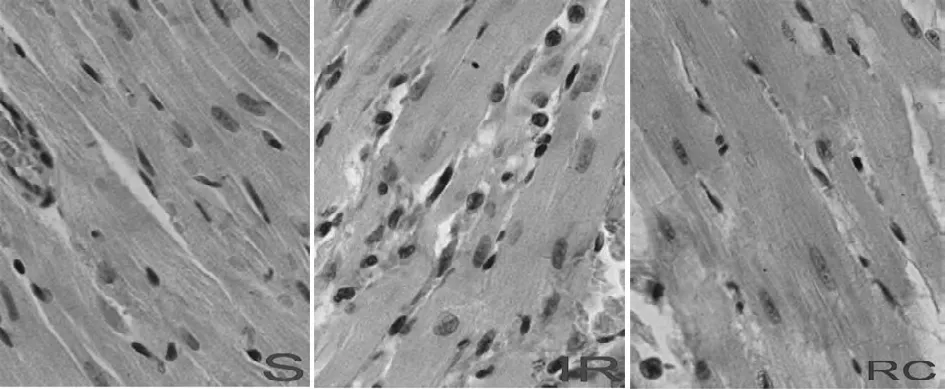
图1 外源性CO对大鼠肢体IR致心肌组织结构的影响(HE×400)

图2 外源性CO对大鼠肢体IR致缺血肢体肌组织横断面结构的影响(HE×400)

图3 外源性CO对大鼠肢体IR致心肌组织横纹的影响(横纹肌染色×400)
2.2 外源性CO对心肌横纹的影响 S组心肌肌纤维形态正常。IR组肌纤维变性、坏死,心肌横纹结构不清,紊乱,部分消失。RC组肌形态基本正常,横纹明显,仅见局灶性横纹排列紊乱。见图3。
2.3 外源性CO对血清LDH、CK-MB的影响 RC组血清LDH值、CK-MB值明显低于IR组(P<0.05)。见表1。
2.4 外源性CO对心肌细胞凋亡百分比、Bax及Bcl-2表达的影响 IR组和RC组比较,心肌促凋亡蛋白Bax的FI值、心肌抗凋亡蛋白Bcl-2的FI值和心肌细胞凋亡百分比差异有统计学意义(P<0.05)。见表1。
表1 外源性CO对大鼠肢体IR致心肌组织中凋亡百分比、Bax、Bcl-2以及血清LDH、CK-MB水平的影响±s
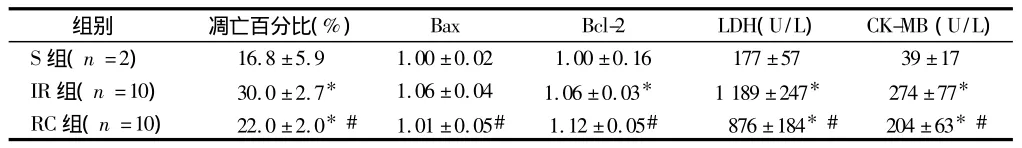
表1 外源性CO对大鼠肢体IR致心肌组织中凋亡百分比、Bax、Bcl-2以及血清LDH、CK-MB水平的影响±s
注:与 S组比较,*P <0.05;与 IR组比较,#P <0.05
组别 凋亡百分比(%) Bax Bcl-2 LDH(U/L) CK-MB(U/L)S组(n=2)16.8 ±5.9 1.00 ±0.02 1.00 ±0.16 177 ±57 39 ±17 IR 组(n=10) 30.0 ±2.7* 1.06 ±0.04 1.06 ±0.03* 1 189 ±247* 274 ±77*RC 组(n=10) 22.0 ±2.0*# 1.01 ±0.05# 1.12 ±0.05# 876 ±184*# 204±63*#
3 讨论
研究表明,动物肢体IR后吸入适量的外源性CO,对肢体IR所导致的脑、肝、肾等器官损伤具有一定防治作用[1]。
IR损伤是全身性病理过程,涉及身体的多个因素。身体器官长时间缺血后,组成细胞呼吸链断裂、能量代谢产生障碍;进行再灌注后,缺血的该器官会产生及释放氧自由基和致炎物质等很多有害因子[2]。该有害物质作用于血液成分及血管内皮后,PMN、EC被大量刺激而激活。表达炎性因子、细胞黏附分子,引起PMN的贴壁、黏附、积聚、移出及释放反应,最终引发全身性炎性损伤[3]。聚集于心肌组织的中性粒细胞和释放的大量毒性物质是肢体IR所致心肌损伤的中心环节。
医学研究发现,信使分子CO具有抗炎、抗氧化及抗细胞凋亡等生物效应[4]。机体在受到重创、休克及氧化应激损伤等病理状态情况下,机体自身会产生更多 CO[5]。Cepinskas等[6]证实,CO 能够下调粘附分子ICAM-1的表达、抑制PMN的扣押。CO可以阻断炎性介质的形成过程,抑制白细胞、血小板的集聚和IL-18介导的炎性反应[7],并能够抑制超氧化物的产生及溶酶体的释放。以上研究从不同侧面证明,CO是通过多途径、多位点发挥其信使分子的作用。据此分析,主动调高内源性CO的表达水平,可能是救治IR损伤的一种较为理想办法。但是,调高内源性CO的表达水平,需要一段较长时间的诱生过程,因此及时给予适量的外源性CO,可能比诱导内源性CO表达更有使用价值。
当动物机体的肌细胞膜结构完整性受到损伤时,LDH、CK可渗透出肌细胞进入血液循环,进而引起机体损伤。本实验结果表明,吸入适量CO可增加心肌细胞膜的稳定性,进而保护组织。
组织细胞遭受IR损伤时的重要病理改变为细胞异常凋亡。Bax为促凋亡蛋白,Bcl-2为抑凋亡蛋白。本实验结果表明,肢体IR后部分心肌细胞启动了凋亡程序,吸入外源性低浓度CO能有效阻止心肌细胞凋亡。
IR损伤时,血管内皮损伤,PMN移出、释放,血管渗出,间质水肿,组织细胞能量代谢障碍,细胞肿胀、变性、凋亡及坏死。本结果显示肢体IR所致心肌损伤时心肌内中性粒细胞浸润程度明显加重,给动物吸入低浓度CO可使浸润程度减轻,提示CO抗肢体IR致心肌损伤的作用与其抑制中性粒细胞浸润有关。本研究结果表明在对受挤压伤、断肢再植术等患者的救治中,使患者适量吸入低浓度CO,可有效减轻心肌的IR损伤。本研究对于其他炎性疾病均极具潜在的临床应用价值。
1 史中立,凌亦凌,姚玉霞,等.大鼠肢体缺血再灌注后肾内HO-1表达的变化及意义.中国病理生理杂志,2004,20:371-374.
2 Chatterjee PK.Novel pharmacological approaches to the treatment of renal ischemia-reperfusion injury:a comprehensive review.Naunyn Schmiedebergs Arch Pharmacol,2007,376:1-43.
3 Chin BY,Jiang G,Wegiel B,et al.Hypoxia-inducible factor 1alpha stabilization by carbon monoxide results in cytoprotective preconditioning.Proc Natl Acad Sci USA,2007,104:5109-5114.
4 Liu SH,Xu XR,Ma K,et al.Protection of carbon monoxide inhalation on lipopolysaccharide-induced multiple organ injury in rats.Chin Med Sci,2007,22:169-176.
5 Harder Y,Amon M,Schramm R,et al.Ischemia-Induced Up-Regulation of Heme Oxygenase-1 Protects from Apoptotic Cell Death and Tissue Necrosis.Surg Res,2008,17:109-113.
6 Cepinskas G,Katada K,Bihari A,et al.Carbon monoxide liberated from carbon monoxide-releasing molecule CORM-2 attenuates inflammation in the liver of septic mice.Am J Phvsiol Gastrointest Liver Physiol,2008,294:G184-191.
7 Zabalqoitia M,Colston JT,Reddy SV,et al.Carbon monoxide donors or heme oxygenase-1(HO-1)overexpression blocks interleukin-18-mediated NF-kappaB-PTEN-dependent human cardiac endothelial cell death.Free Radic Biol Med,2008,44:284-298.

