自主过度通气试验对不同呼吸衰竭患者低氧血症的影响及临床意义
王慧玲 程忠 胡彦峰 任洪波 毛哲哲 郭淑霞 陈奎利
部分不伴肺部疾病的阻塞性睡眠呼吸暂停低通气综合征(OSAHS)存在日间低氧和二氧化碳潴留,少数可发生Ⅱ型呼吸衰竭[1]。随着对睡眠呼吸障碍性疾病的深入认识,发现以呼吸衰竭入院的患者中此类患者并不少见[1]。发病机制可能与呼吸中枢对低氧和高二氧化碳的反应性低下有关,即属于“不愿呼吸者”[2]。与常见的以肺功能受损为主的“不能呼吸者”相比,尽管二者临床上均表现为呼吸衰竭,但诊疗手段并不相同。本研究将测定患者的呼吸中枢反应性探讨其发病机制及自主过度通气试验在此类患者临床识别及指导治疗方案选择中的应用价值。
1 资料与方法
1.1 一般资料 从2012年1月至2013年12月在邯郸市中心医院呼吸科睡眠中心就诊的OSAHS患者中连续入组23例日间低氧伴或不伴二氧化碳潴留的患者,其动脉血气分析达到呼吸衰竭诊断标准。其中男10例,女13例;年龄7~83岁,平均年龄(58±11)岁;患者均较肥胖,平均体重指数(BMI)为(32.98±4.18)kg/m2。结合肺CT、胸片检查,根据常规肺功能检查选择1 s用力呼气容积(FEV1)占预计值的百分比(FEV1%)>70%者15例为研究者。从FEV1% <70%8例患者为对照。
1.2 方法
1.2.1 肺功能及血气分析:患者在自主过度通气前进行常规肺功能检查测定1 s用力呼气容积(FEV1)占预计值的百分比(FEV1%)、1 s用力呼气容积占用力肺活量(FVC)比值(FEV1/FVC);血常规测定红细胞计数、血红蛋白、红细胞比积;清醒、安静、呼吸室内空气下血气分析测定 pH 值、PaCO2、PaO2、SaO2。
1.2.2 睡眠呼吸监测:多导睡眠监测(PSG)测定睡眠呼吸暂停低通气指数(AHI)。
1.2.3 自主过度通气试验:所有患者在清醒、安静、呼吸室内空气下进行自主过度通气(尽可能地深快呼吸)1 min,测定其过度通气前后的脉搏血氧饱和度(血氧Holter仪)。其中10例测定了过度通气前后的血气分析。
1.2.4 呼吸中枢低氧反应性(ΔVE/ΔSaO2)、高 CO2反应性(ΔVE/ΔPaCO2)。低氧反应性采用 Rebuck和Campbell法:受试者重复呼吸袋内预置的普通空气,呼气端连接钠石灰瓶以吸收多余的CO2,使PETCO2在试验过程中维持在恒定水平。从SaO2降至90%时开始,每隔10 s同步记录 VE和 SaO2,直到 SaO2降至70%左右时结束。高CO2反应性测定采用Read法:受试者重复呼吸预先配置在气袋容量为肺活量 +1 L的高CO2混合气[7%CO2,40%氧,53%氮,大约15~20 s出现CO2平台后,每隔10 s钟记录VE和呼气末CO2分压(PETCO2)]。直到PETCO2达60 mm Hg左右为止。整个试验过程中SaO2维持在98%以上。将VE分别与对应的 PETCO2和SaO2进行直线回归,计算其斜率 ΔVE/ΔSaO2和 ΔVE/ΔPaCO2。
1.3 观察指标 其中18例患者进行了持续气道正压通气治疗(CPAP)并测定治疗前后血气分析及ΔVE/ΔSaO2、ΔVE/ΔPaCO2,比较治疗前后变化。
1.4 统计学分析 应用SPSS 13.0统计软件,计量资料以±s表示,同一患者自主过度通气前后的改变应用配对t检验,组间比较应用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 自主过度通气前后SpO2及PaO2变化 23例患者中15例患者自主通气后SpO2显著上升,为4% ~19%,平均(9.23±4)%,大多数达到正常水平,其中8例患者进行了过度通气前后的血气分析测定,PaO2明显上升,为9.9 ~35 mm Hg,平均(22 ±7.8)mm Hg。8例患者变化不明显,SpO2变化为0~5%,平均(2±1.5)%,其中2例患者进行了过度通气前后的血气分析测定,PaO2变化值为分别为2 mm Hg和-1 mm Hg。两者差异有统计学意义(P<0.01)。见表1。
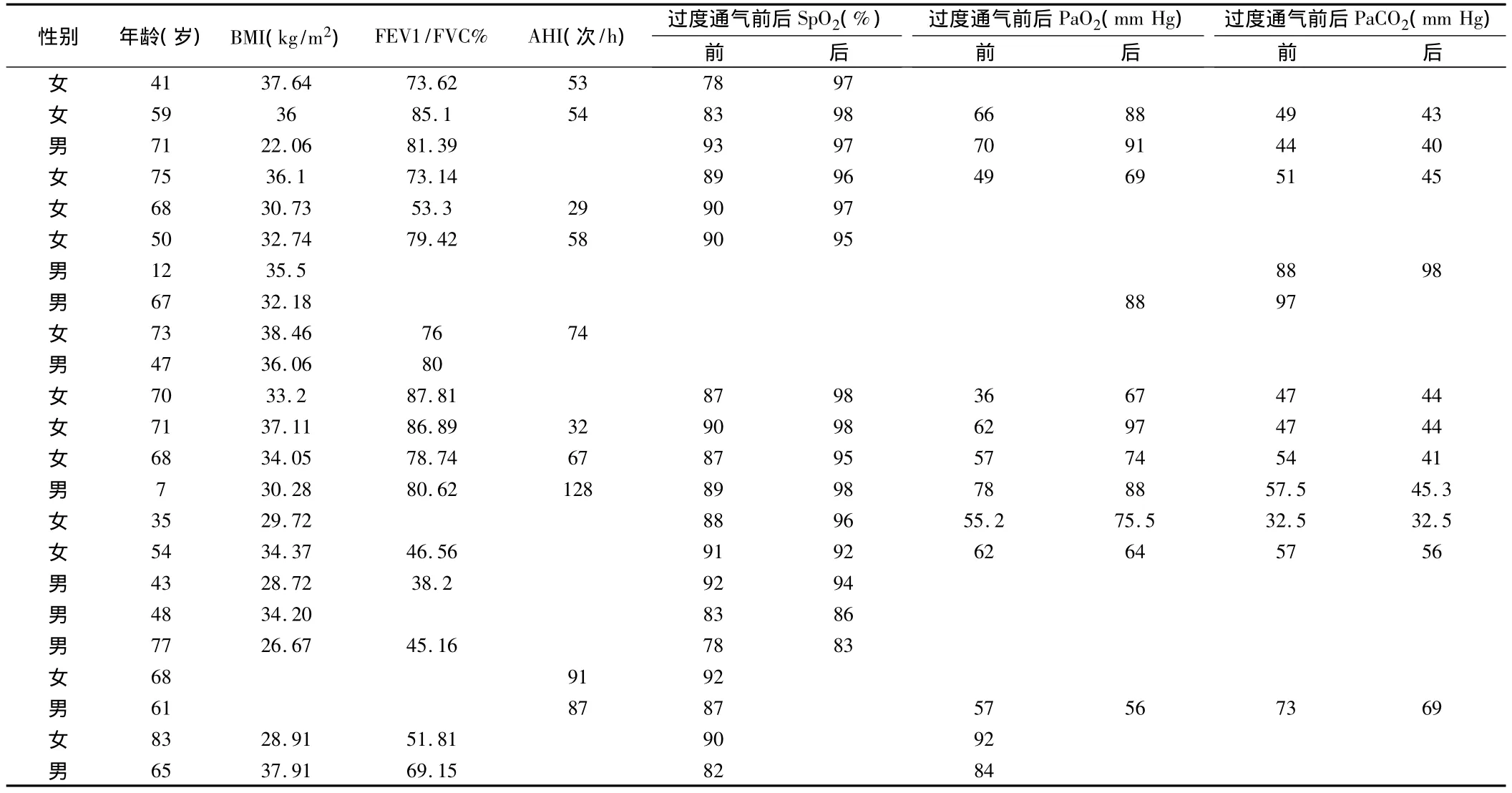
表1 自主过度通气前后SpO2及PaO2变化
2.2 改善组和未改善组BMI、治疗前血气分析、呼吸中枢低氧、高二氧化碳反应性比较 自主过度通气后低氧血症明显改善的患者FEV1/FVC在正常范围(>70%预计值),而无明显改善者FEV1/FVC低于70%。于是,根据自主过度通气实验后低氧血症的改变将患者分为改善组和未改善组,对其BMI、治疗前血气分析和呼吸中枢对低氧和高二氧化碳的反应性进行比较。改善组4例、未改善组5例行呼吸中枢反应性测定,改善组患者低氧反应性均低于正常,为 -0.021~-0.282 L·min-1·%-1[正 常 值 (- 0.38 ±0.04)L·min-1·%-1],高二氧化碳反应性有 2 例分别为 1.888 和 2.338,其余均低于正常,为 0.052 ~0.952 L·min-1·mm Hg-1[正 常 值 (1.22 ±0.53)L·min-1·mm Hg-1]; 未 改 善 组 低 氧和高二氧化碳反应性 均 低 于 正 常, 分 别 为-0.039 ~ -0.085 L·min-1·%-1和 0. 004 ~0.638 L·min-1·mm Hg-1。2 组 BMI、治 疗 前 pH值、PaCO2、PaO2、SaO2差异无统计学意义(P>0.05),呼吸中枢低氧反应性和高二氧化碳反应性差异无统计学意义(P>0.05)。见表2。
表2改善组和未改善组BMI、治疗前血气分析、呼吸中枢低氧、高二氧化碳反应性比较±s

表2改善组和未改善组BMI、治疗前血气分析、呼吸中枢低氧、高二氧化碳反应性比较±s
组别 pH值 PaCO2(mm Hg) PaO2(mm Hg) SaO2(%) 低氧反应性(L·min -1·% -1)高二氧化碳反应性(L·min-1·mm Hg-1)BMI(kg/m2)改善组(n=4) 7.37 ±0.08 60.16 ±1.9 57 ±1.02 86.5 ±5.65 0.108±0.08 0.64 ±0.68 33.45 ±4.18未改善组(n=5) 7.36 ±0.06 66 ±12.8 49 ±9.39 84.9 ±7.99 0.07 ±0.019 0.27 ±0.23 31.8 ±4.33
2.3 2组患者持续气道正压通气治疗后血气分析的改变 改善组中11例、未改善组7例在确诊后应用了双水平持续气道正压通气(BiPAP)治疗,吸气压14~26 cm H2O,呼气压6~8 cm H2O。分别比较治疗前后血气分析的改变。BiPAP治疗后2组患者的PaO2均有显著改善(P<0.05),2组PaO2治疗后改善值差异无统计学意义(P>0.05)。见表3。
表3 2组患者持续气道正压通气治疗后血气分析改变±s

表3 2组患者持续气道正压通气治疗后血气分析改变±s
组别治疗前pH值 PaCO2治疗前(mm Hg)PaO2治疗前(mm Hg)SaO2治疗前(%)治疗后pH值治疗后 PaCO2治疗后(mm Hg)PaO2治疗后(mm Hg) SaO2治疗后(%)改善组(n=11) 7.37 ±0.08 60.16 ±1.9 57 ±1.02 86.5 ±5.65 7.41 ±0.04 46.7 ±5.2 71.1 ± 13.6 93.7 ± 3.3未改善组(n=7) 7.36 ±0.06 66 ±12.8 49 ±9.39 84.9 ±7.99 7.4 ±0.0460.1 ±7.97 70.3 ± 11.8 93.9 ± 1.9
3 讨论
呼吸衰竭是由各种原因引起的肺通气和(或)换气功能严重障碍,致使在静息状态下不能维持有效的气体交换,导致缺氧伴或不伴二氧化碳潴留,从而引起一系列生理功能和代谢紊乱的临床综合征,并除外心内解剖分流和原发于心排血量降低的原因[3]。临床从常见发病机制上分为三种类型:(1)“不能呼吸”:可继发于神经肌肉疾病、肺部疾病等。从我们的研究结果中可以看到SpO2及PaO2不能通过自主的过度通气达到正常水平的这部分患者其FEV1占预计值的百分比(FEV1%)、FEV1/FVC%明显低于正常,存在阻塞型通气障碍,提示存在呼吸系统的病变,属于这种类型。(2)“不愿呼吸”:这种呼吸障碍的产生是由于呼吸中枢化学感受器敏感性下降,对低氧和高二氧化碳的反应性下降,从而使呼吸中枢的驱动能力下降,造成通气不足。从我们的研究结果中可见,患者的肺功能在正常范围,却存在严重的低氧血症和高碳酸血症,但这种低氧和高二氧化碳可通过患者主动的过度通气而恢复正常。这部分患者就属于这种类型。(3)“不该呼吸”:见于某些病态的过度通气综合征。由于过度通气造成二氧化碳排出过多,形成的低碳酸血症和呼吸性碱中毒[4,5]。
临床上对于“不能呼吸”所造成的呼吸衰竭认识比较充分,能够引起足够重视,却常常忽视因“不愿呼吸”造成呼吸衰竭的这部分患者。由于患者缺乏肺部疾患的相关病史,肺功能检查可在正常范围,如果对其缺乏认识,则很容易误诊或漏诊,造成严重后果。有1例因双膝骨性关节炎入骨科待手术,因夜间睡眠差,被给予舒乐安定2 mg口服后出现嗜睡,意识模糊,血气分析二氧化碳分压显著升高,出现了肺性脑病。还有1例患者因不恰当的氧疗造成二氧化碳上升引起昏迷。因此,在临床上如何快速准确的鉴别诊断尤为重要。我们通过以上研究发现这类“不愿呼吸”或“忘了呼吸”的患者具有以下特点:(1)肥胖,多数伴有夜间睡眠呼吸紊乱;(2)低氧及二氧化碳潴留不能以心肺疾病等相关疾病解释;(3)胸部影像学及肺功能大致正常;(4)低氧血症可通过自主过度通气而改善,即属于可复性的呼吸衰竭。由于其呼吸中枢对低氧、高二氧化碳反应性降低,造成呼吸驱动能力下降,如果不恰当的应用镇静安眠药或高浓度氧疗等,就会进一步抑制呼吸中枢的反应性,使呼吸运动进一步减弱,导致症状加重。肥胖低通气综合征就是这类呼吸衰竭最为常见的疾病之一。
在研究中发现“不愿呼吸”的患者低氧和高二氧化碳反应性低于正常,但是,具有肺功能异常的“不能呼吸”的患者也存在低氧和高二氧化碳反应性下降,2组差异无统计学意义(P<0.01)。1例患者为剖腹产术后出现低氧血症,I型呼吸衰竭,临床诊断疑为羊水栓塞,但自主过度通气试验发现患者过度通气后动脉血氧分压由55.2 mm Hg升至75.5 mm Hg,考虑低氧的主要原因为肺泡通气不足。后通过进一步检查最终除外了羊水栓塞的诊断,避免了患者不恰当的过度治疗。由于自主过度通气试验简单易行,在缺乏肺功能等检查设备的基层医院更值得推广。
针对其发病机制的特点,增加患者的通气量是最为有效的治疗方法。本研究中,我们通过应用无创呼吸机治疗人为的增加患者的通气量,并有效治疗其夜间睡眠呼吸紊乱,显著改善了患者的缺氧状态。此外,无创通气治疗还有助于减少呼吸肌活动性,降低吸气负荷,缓解呼吸肌疲劳[6]。结果显示,2组患者经无创通气治疗后血气分析都得到了明显改善,呼吸中枢的敏感性也有所恢复。但长期疗效还需进一步跟踪随访。
1 Leech J,Onal E,Aronson R.Voluntary hyperventilation in obesity hypoventilation.Chest,1991,100:1334-1338.
2 Rhoads CC,Brady JS.Idiopathic alveolar hypoventilation:clinical spectrum.Ann Intern Med,1969,71:271-87.
3 叶任高主编.内科学.第5版.北京:人民卫生出版社,2001.46.
4 韩芳,陈尔璋,魏海琳,等.肥胖通气低下综合征患者呼吸中枢反应性的改变与二氧化碳潴留的相关作用.中华内科杂志,1999,38:466-469.
5 张荣葆,丁东杰,陈尔璋,等.对慢性阻塞性肺病呼吸衰竭患者二氧化碳潴留机制的探讨.中华内科杂志,1998,37:749-752.
6 Pankow W,Hijjeh N,Schulttler F,et al.Influence of noninvasive positive pressure ventilation on inspiratory muscle activity in obese subjects.Eur Respir J,1997,10:2847-2852.

