发酵粗甘油产乳酸的戊糖乳杆菌代谢进化
王世珍,严正平,邱隆辉,方柏山
(1厦门大学化学化工学院,福建 厦门 361005;2厦门市合成生物学重点实验室,福建 厦门 361005)
引言
近年来随着生物柴油的规模化发展,以其廉价副产物粗甘油为原料直接发酵生产乳酸对乳酸工业及生物柴油产业都具有十分重要的现实意义和经济价值[1-2]。目前,微生物法将甘油转化为乳酸的研究尚处于起步阶段[3],国内外利用甘油发酵生产乳酸的研究报道并不多,Mazumdar等[4]利用重组大肠杆菌,发酵40 g·L-1甘油得到32 g·L-1、光学纯度达到99%的D-乳酸,乳酸产率达到1.5 g·L-1·h-1。洪安安等[5-6]筛选到一株大肠杆菌 AC-521,能代谢甘油发酵生产乳酸,该菌株在5 L发酵罐水平,补料分批发酵88 h后,乳酸产量可达85.8 g·L-1,同时会有副产物乙酸、丁二酸、乙醇和 1,3-丙二醇生成。田康明等[7-8]利用乳酸高产大肠杆菌 CICIM B0013-070,建立并优化了一种新型 D-乳酸变温发酵工艺,并通过引入温度诱导型乳酸脱氢酶的转录系统,发酵得到98.5 g·L-1的乳酸并使甘油到乳酸的得率达到88.9%。与葡萄糖等传统发酵原料相比,以粗甘油作为发酵底物会导致菌体生长缓慢、菌浓较低,产酸速率和终产物浓度偏低等一系列问题[9]。
代谢进化(metabolic evolution)[10-11]是利用适应进化有效提高微生物发酵生产速率、产率和终浓度的技术。在微生物发酵过程中,底物利用过程一般产生能量(ATP)和还原力(NADH),而很多产物的合成过程则是消耗还原力。通过遗传改造构建出初级的微生物细胞工厂,使目标产物成为消耗还原力的唯一代谢途径,从而使能量产生和还原力平衡相偶联。因此,通过在发酵反应器中连续传代培养微生物,筛选生长速率大的突变菌,可以同步筛选出目标产物生产速率、产率和终浓度均显著提高的突变菌[12-13]。Ingram 等[14]利用此技术,成功提高了大肠杆菌发酵生产乙醇、L-乳酸、D-乳酸等化合物的生产性能,效果非常显著(提高1~2个数量级)。Zhang等结合途径理性设计和代谢进化,成功构建了大肠杆菌代谢工程菌,使其能高效生产 L-丙氨酸[15]、丁二酸[16-17]。其中L-丙氨酸工程菌能使用简单无机盐培养基,在厌氧批式培养条件下,48 h内生产115 g·L-1的L-丙氨酸,产率达到95%,手性纯度达到 99.5%,使生产成本大大低于目前使用的酶催化技术。丁二酸工程菌能利用简单无机盐培养基,在厌氧批式培养条件下,96 h内生产90 g·L-1左右的丁二酸,产率达到1.5 mol·mol-1葡萄糖。大肠杆菌[18]在代谢进化过程中激活了2条新型的能量保存途径,使丁二酸发酵生产的同时能产生足够的能量用于维持细胞生长代谢[19-20]。
本课题以廉价的工业粗甘油为底物,以自行筛选的戊糖乳杆菌为发酵菌株,通过微好氧发酵来生产乳酸,试图建立一条低成本的乳酸生产路线。通过在发酵培养基中添加一定浓度的粗甘油或乳酸,对本实验室早先筛选并保藏的野生戊糖乳杆菌R3-8[21](Lactobacillus pentosusR3-8)进行代谢进化,使菌株在含有这些物质的发酵培养基中不断地进行传代培养,并通过连续传代培养使优势菌不断富集,以期驯化得到耐受高浓度底物和产物且具有高生产强度和产物终浓度的突变菌株。
1 实验材料和方法
1.1 菌株
实验室筛选的新型野生戊糖乳杆菌 R3-8(Lactobacillus pentosusR3-8),兼性厌氧,保藏于4℃ MRS培养基中。
1.2 主要试剂
酵母粉、胰蛋白胨购自OXOID。牛肉膏购自生工生物工程(上海)有限公司。葡萄糖、无水乙酸钠、四水硫酸锰、三水磷酸氢二钾、乳酸购自国药集团化学试剂有限公司。吐温80购自生工生物工程(上海)有限公司。氨水购自广东化学试剂工程技术研究开发中心。柠檬酸氢二铵购自中国医药集团上海化学试剂公司。七水硫酸镁购自广东汕头西陇化工有限公司。以上试剂均为分析纯。色谱纯甘油购自 Sigma。粗甘油由中国生物柴油国际控股有限公司下属的厦门卓越生物质能源发展公司提供,其甘油含量约为97%。其他试剂均为国产分析纯试剂。粉状活性炭购自广东光华科技有限公司,直接作为吸附剂使用。
1.3 主要仪器设备
主要仪器设备型号与厂商如下:pH计(PB-10,Sartorius)、Bioscreen C全自动生长曲线分析仪(FP-1100-C,Oy Growth Curves Ab Ltd)、电子天平(AR1530,奥豪斯)、恒温摇床(SPH-200B,上海世平实验设备有限公司)、冷冻离心机(5418 R,Eppendorf)、立式电热灭菌锅(HVE-50,Hirayama)、5 L全自动发酵罐(Biostat A Plus,Sartorius)、紫外-可见光分光光度计(UV-6100,上海美谱达仪器有限公司)、超净工作台(SW-CJ-1FD,苏州净化设备有限公司)、高效液相色谱(1200,Agilent)、医用冷藏柜 (4℃)(YC-260L,中科美菱)、医用冷藏柜(-20℃)(DW-YW358A,中科美菱)、电热恒温鼓风干燥箱(DH-9070AS,宁波江南仪器厂)、智能型生化培养箱(SPX,宁波江南仪器厂)。
1.4 培养基
MRS培养基(L-1):葡萄糖20 g,胰蛋白胨10 g,酵母粉5 g,牛肉膏10 g,乙酸钠5 g,磷酸氢二钾 2 g,柠檬酸氢二铵 2 g,吐温 80 1 ml,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.25 g。pH 6.5,115℃灭菌30 min。种子培养基(g·L-1):甘油40,酵母粉5,胰蛋白胨10,乙酸钠6,磷酸氢二钾1.5。pH 6.5,121℃灭菌20 min。
甘油驯化培养基(g·L-1):粗甘油(浓度视实验要求而定),酵母粉5,胰蛋白胨10,乙酸钠6,磷酸氢二钾1.5。pH 6.5,121℃灭菌20 min。乳酸驯化培养基(g·L-1):粗甘油40,酵母粉5,胰蛋白胨10,乙酸钠6,磷酸氢二钾1.5,乳酸(浓度视实验要求而定)。pH 6.5,121℃灭菌20 min。发酵培养基(g·L-1):粗甘油60,酵母粉6,胰蛋白胨10,乙酸钠6,磷酸氢二钾1.5。pH 6.0,121℃灭菌20 min。其中,MRS培养基用于菌种的活化和保藏。
1.5 实验方法
粗甘油的预处理:将粗甘油与去离子水按质量/体积比1:1的比例混合,降低粗甘油的黏度,然后加入一定量的粉状活性炭(甘油:活性炭质量比为100:1),在室温条件下搅拌吸附3 h,搅拌结束后,抽滤除去活性炭,得到滤液即为预处理的粗甘油水溶液。
菌种活化:将4℃保藏的菌种转接至新鲜的MRS培养基中,34℃静置活化10 h,接种量3%(体积)。
种子培养:将活化后的菌液再接种至装有 100 ml新鲜MRS培养基的250 ml锥形瓶中,在34℃、摇床转速150 r·min-1下培养10 h后,获得种子液。
摇瓶培养(代谢进化):将甘油/乳酸驯化培养基100 ml装于250 ml锥形瓶中,以10%(体积)的接种量接入种子液,在34℃ 、摇床转速150 r·min-1下培养12~24 h。在培养基中添加20 g·L-1已灭菌的碳酸钙,可缓冲摇瓶pH的变化。
5 L发酵罐发酵:发酵培养基2 L盛于5 L发酵罐中,以10%(体积)的接种量接入种子液,发酵温度34℃,搅拌转速250 r·min-1,发酵液pH通过自动流加5 mol·L-1的氨水控制在6.0,通入通气比0.4的空气保持微氧环境。每间隔一定时间取样,检测发酵液中甘油浓度、乳酸浓度以及菌体的生物量。
菌种保藏:直接将活化好的菌株置于血清瓶中,在 4℃条件下保存。如长期保存则需将菌液与40%的甘油溶液等体积混合,装入菌种保藏管,在-80℃冰箱中保存。
1.6 分析方法
菌体生物量的测定采用比浊法。将发酵液适当稀释后,以蒸馏水为空白测定其在620 nm下的吸光度值(OD620);通过菌体干重与相应OD值的标准曲线计算出单位体积发酵液中的菌体干重。标准曲线方程为:y=0.3958x+0.0085,线性相关系数R2=0.9958,其中,x为发酵液OD值,y为单位体积发酵液菌体干重 (g·L-1)。
甘油和乳酸的测定采用高效液相色谱。色谱条件为:Aminex-HPX-87H色谱柱(Bio-rad),流动相为0.5 mmol·L-1的H2SO4溶液,流动相流速为0.5 ml·min-1,柱温65℃,检测器为RID-10A折光示差检测器,检测器温度45℃,进样量为20 μl。发酵液样品经12000 r·min-1离心15 min后取上清,将上清液经过适当稀释和 0.22 μm 滤膜过滤处理后,进行液相分析,通过各物质的峰面积与相应浓度的标准曲线进行浓度计算,乘上稀释倍数即得各物质在发酵液中的浓度。
甘油标准曲线方程为y=3×10-6x+0.053,线性相关系数R2=0.9999,其中,x为甘油峰面积,y为甘油浓度(g·L-1)。乳酸标准曲线方程为:y=4×10-6x+0.0111,线性相关系数R2=0.9998,其中,x为乳酸峰面积,y为乳酸浓度 (g·L-1)。
2 实验结果与讨论
2.1 基于粗甘油浓度变化的代谢进化研究
将原始菌株接入 MRS培养基中活化后,再接于MRS培养基中扩增10 h,并将其记为Y-0;然后以10%(体积)的接种量接入100 ml甘油驯化培养基中,培养24 h,即为甘油驯化的第1代,将其记为YG-1(以下编号同理);随后将YG-1的菌液以相同的接种量接入新鲜的甘油驯化培养基中,记为YG-2。每10代作为一个批次,每个批次的前5代培养时间为24 h,后5代的培养时间缩短为12 h,以富集生长较快的突变株;批次间逐步提高发酵培养基中粗甘油浓度,每驯化10代后接入MRS培养基中保藏,分别记为 YG-10、YG-20、YG-30、YG-40、YG-50、YG-60。其中,1~10代所用甘油驯化培养基中添加50 g·L-1粗甘油,11~20代为70 g·L-1粗甘油,21~30代为90 g·L-1粗甘油,31~40代为100 g·L-1粗甘油,41~50代为120 g·L-1粗甘油,51~60代为140 g·L-1粗甘油。
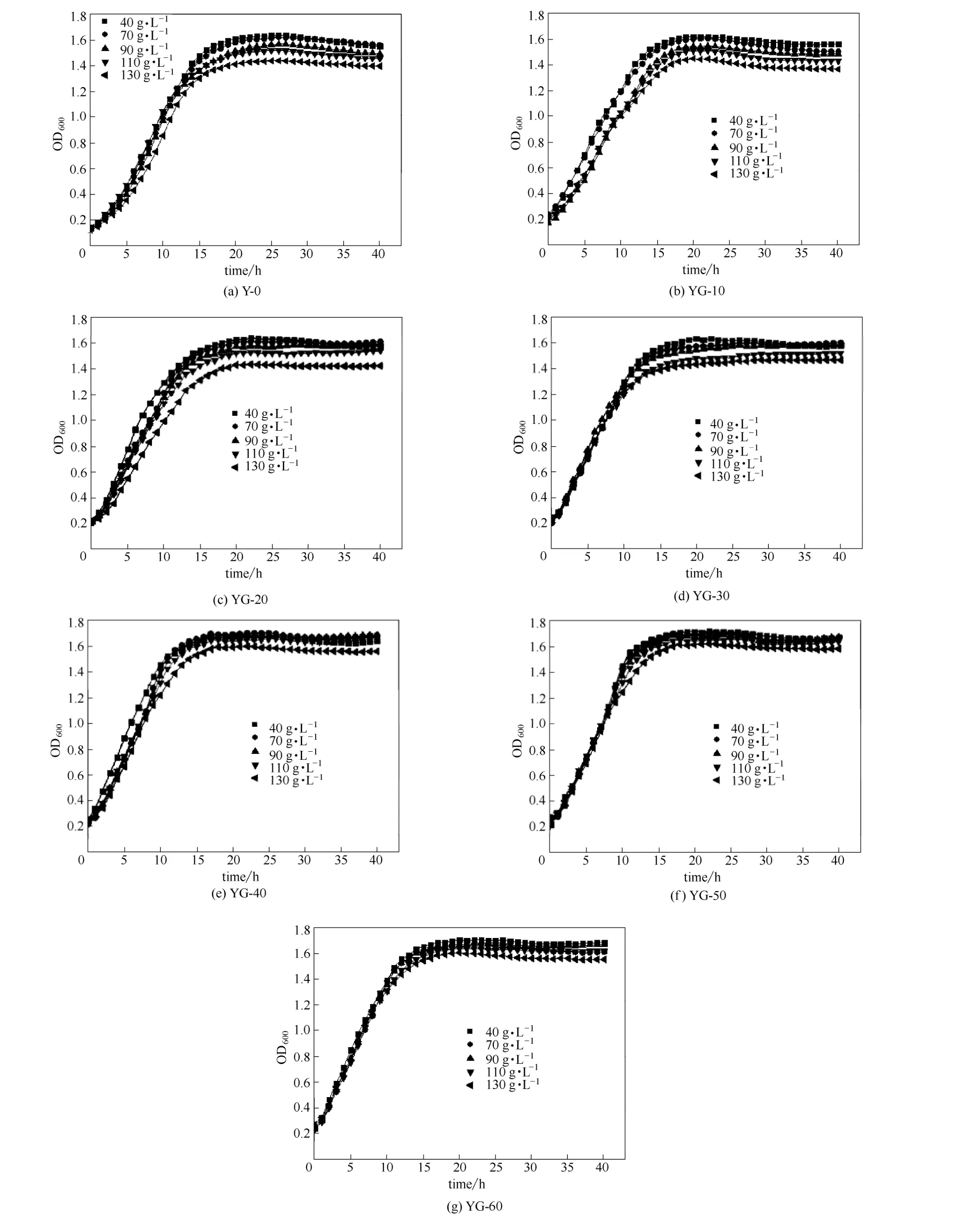
图1 YG系列驯化菌株在含不同浓度粗甘油培养基中的生长曲线Fig.1 Growth curves of YG strains in medium of different raw glycerol concentrations
对通过基于粗甘油浓度变化的代谢进化所得到的菌株YG-10、YG-20、YG-30、YG-40、YG-50和YG-60(统称YG系列菌株)进行底物(粗甘油)和产物(乳酸)的耐受性考察,并与原始菌株 Y-0进行对比:(1)将保藏的各代菌株活化后,接入种子培养基中培养10 h(至对数生长期);(2)将配制好的不同浓度梯度甘油/乳酸驯化培养基加到蜂窝板中,每孔300 µl;(3)以10%(体积)的接种量将各代菌株的种子液加入不同的培养基中,即每孔30 µl的菌液;(4)将加好样的蜂窝板放入Bioscreen C中考察生长曲线,设置考察温度34 ℃,每隔1 h进行一次吸光度测定,持续时间40 h。
其中,甘油驯化培养基中,粗甘油的浓度分别为40、70、90、110和130 g·L-1;乳酸驯化培养基中,乳酸的浓度分别为0、5、10、20和 40 g·L-1。2.1.1 甘油驯化菌株的底物耐受性考察 考察 YG系列驯化菌株对底物粗甘油的耐受性(图1)。由图1可以看出,随着培养基中粗甘油浓度的提高,各代菌株的生长情况都受到了一定程度的影响。将驯化各代次菌株在粗甘油浓度为130 g·L-1的甘油驯化培养基中的生长曲线进行比较(图2)。如图2所示,经过驯化的菌株在粗甘油浓度较高的培养基中,与出发菌株相比,可以更快地进入对数生长期,且生长速率提高。驯化到40代以后的YG-40、YG-50和 YG-60三株菌在生长情况上已经明显优于原始菌株。在生物量方面,YG-60比出发菌株的细胞浓度提升了23%。
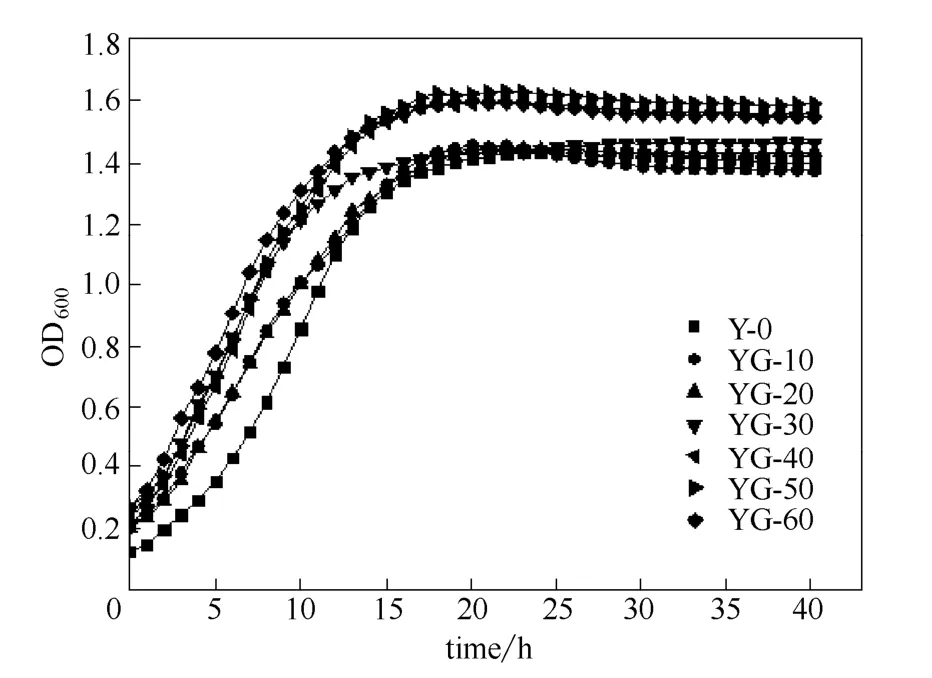
图2 YG系列驯化菌株在含130 g·L-1粗甘油培养基中的生长曲线Fig.2 Growth curves of YG strains in medium containing 130 g·L-1raw glycerol
2.1.2 甘油驯化菌株的产物耐受性考察 考察 YG系列驯化菌株对产物乳酸的耐受性。随着培养基中乳酸浓度的增加,菌体生长受到显著抑制。当培养基中的乳酸浓度上升至40 g·L-1时,各代菌株的生长已经几乎被完全抑制。说明YG系列菌株在乳酸耐受性上的表现与原始菌株并没有表现出较明显的差异。
2.2 基于乳酸浓度变化的代谢进化研究
将原始菌株接入 MRS培养基中活化后,再接于种子培养基中扩增10 h,并将其记为Y-0;然后以10%(体积)的接种量接入100 ml乳酸驯化培养基中,培养24 h,即为乳酸驯化的第1代,将其记为 YL-1(以下编号同理);随后将 YL-1的菌液以相同的接种量接入新鲜的甘油驯化培养基中,记为YL-2。如此连续传代培养,每10代作为一个批次,每个批次的前5代培养时间为24 h,后5代的培养时间缩短为12 h,以富集生长较快的突变株;批次间逐步提高发酵培养基中乳酸浓度,每驯化10代后接入MRS培养基中保藏,分别记为YL-10、YL-20、YL-30、YL-40、YL-50、YL-60。其中,1~10代所用乳酸驯化培养基中添加2 g·L-1乳酸,11~20代为5 g·L-1乳酸,21~30代为10 g·L-1乳酸,31~40代为 20 g·L-1乳酸,41~50代为 30 g·L-1乳酸,51~60代为40 g·L-1乳酸。
考察YL系列驯化菌株对底物粗甘油的耐受性(图3)。由图3可以看出,YL系列各代菌株在不同粗甘油浓度培养基中的生长情况与原始菌株大致相当,各驯化代次表现出微小差异,但无明显的规律性。
YL系列驯化菌株对产物乳酸耐受性考察结果如图4所示。从图4中可以看出,代谢进化后,YL系列菌株对乳酸的耐受性得到提升。但是在高浓度乳酸(40 g·L-1)的抑制作用下,YL系列的菌株与原始菌株类似,生长也近乎停滞。如图4所示,在含 20 g·L-1乳酸的培养基中生长情况的对比来看,YL-50的生物量比初始菌株提升了18%。
2.3 分批发酵考察
通过利用微生物全自动生长曲线分析仪(Bioscreen C)对代谢进化得到的各代菌株进行底物和产物的耐受性考察,对它们的生长能力与耐受能力有了初步的了解。由于Bioscreen C内部的发酵液体积较小,受传质、供氧等条件限制,菌体的生长环境与实际发酵的体系具有一定差异。因此选取了YG-30、YG-60、YL-30、YL-60四株菌进行分批发酵的考察,并与原始菌株Y-0的分批发酵结果进行比较,考察代谢进化对菌体发酵水平的影响。同时,也研究了补料分批对YL-60菌株的发酵水平影响。不同菌株的发酵动力学曲线如图5所示,分批发酵的结果见表1。

图3 YL系列驯化菌株在含不同浓度乳酸培养基中的生长曲线Fig.3 Growth curves of YL strains in medium containing different concentrations of lactic acid

图4 YL系列驯化菌株在含20 g·L-1乳酸培养基中的生长曲线Fig.4 Growth curves of strains in medium containing 20 g·L-1lactic acid
从表1的结果可以看出,经过代谢进化后的各代菌株,在发酵能力上相较原始菌株有所提升。其中以粗甘油驯化至60代的菌株YG-60的批次发酵水平相对较好。主要是因为驯化菌种提高了对培养基的适应性, 在甘油浓度较高的发酵培养基中也可以获得较高的菌浓, 从而可以为乳酸的合成提供有利条件。其乳酸产量、甘油转化率以及生产强度分别为 45.0 g·L-1、0.989 g·g-1和 0.47 g·L-1·h-1,相对原始菌株分别提高了4.4%、1.5%和4.4%。
YG-60经过220 h的补料分批发酵,最终获得83.8 g·L-1的乳酸浓度,比分批发酵提高了近1倍。乳酸对甘油的转化率达到0.978 g·g-1,生产强度为0.43 g·L-1·h-1。究其主要原因在于补料分批降低了甘油对菌株的抑制作用。各驯化代次菌株的发酵动力曲线显示乳酸是典型的生长关联型产物,产量与菌体的生长关系极为密切。因此提高发酵菌株的生长能力是提升乳酸发酵水平的关键。
3 结 论
(1)研究结果显示通过提高培养基中的粗甘油浓度对Lactobacillus pentosusR3-8进行代谢进化,可以提高其对高浓度粗甘油(130 g·L-1)的耐受性。与出发菌株相比,经过代谢进化的菌株与出发菌株相比,可以更快地进入对数生长期,生长速率提高。第 60代驯化菌株生物量比出发菌株提升了23%。

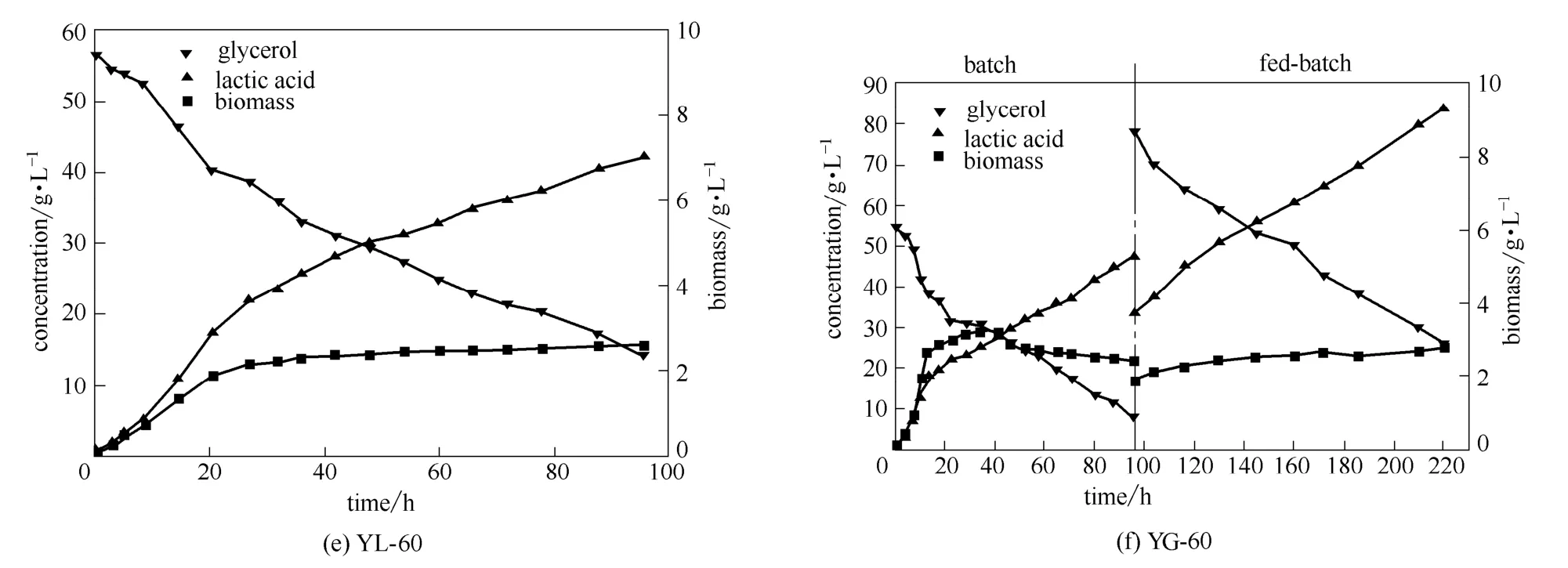
图5 进化菌株的发酵过程曲线Fig.5 Time curves of batch cultivation of evolved strains(fed-batch cultivation)
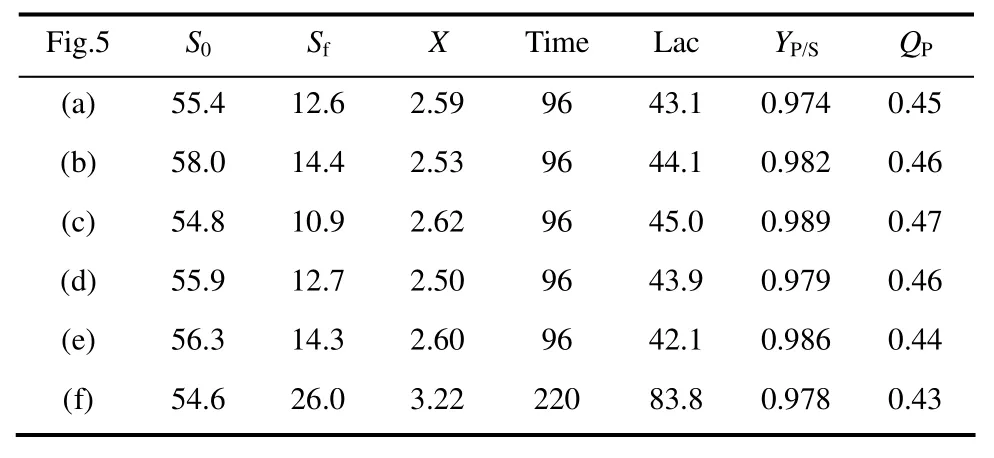
表1 代谢进化菌株的分批发酵结果Table 1 Batch cultivation of evolved strains
(2)经过进化,菌株对乳酸的耐受性得到提升。由含20 g·L-1乳酸的培养基中生长情况的对比可知,YL-50的生物量比初始菌株提升了18%。但由于乳酸对该菌株的抑制作用比较大,在高浓度乳酸的(40 g·L-1)情况,YL系列的菌株与原始菌株类似,生长也近乎停滞。
(3)综合驯化各代次的菌株的分批发酵结果可知,以粗甘油驯化至 60 代的菌株 YG-60 的批次发酵水平相对较好,乳酸产量、甘油转化率以及生产强度分别为 45.0 g·L-1、0.989 g·g-1和0.47 g·L-1·h-1,相对原始菌株分别提高了4.4%、1.5%和4.4%。
(4)YG-60经过220 h的补料分批发酵,最终获得83.8 g·L-1的乳酸浓度,比分批发酵提高了近1倍。乳酸对甘油的转化率达到0.978 g·g-1,生产强度为0.43 g·L-1·h-1。
(5)由于Lactobacillus pentosusR3-8的遗传性状比较稳定,为了获得具有更加优良发酵水平的突变株,需要延长代谢进化的代数。乳酸是典型的生长关联型产物,乳酸的发酵水平受到菌体生长情况的影响,所以后续研究将围绕如何提升菌株在发酵过程中的生长水平。
符号说明
Lac——发酵生成的乳酸浓度,g·L-1
QP——乳酸的生产强度/产率,g·L-1·h-1
Sf——发酵结束时甘油浓度,g·L-1
S0——发酵初始甘油浓度,g·L-1
Time——发酵时间,h
X——发酵过程中发酵液最大的细胞干重值,g·L-1
YP/S——乳酸对甘油的转化率,g·g-1
[1] Basha S A, Gopal K R, Jebaraj S. A review on biodiesel production,combustion, emissions and performance [J].Renew Sust.Energ.Rev.,2009, 13:1628-1634.
[2] Lin L, Zhou C, Saritporn V, Shen X,et al. Opportunities and challenges for biodiesel fuel [J].Appl.Energ., 2011, 88:2020-1031.
[3] Rasal R M, Janorkar A V, Hirt D E. Poly (lactic acid) modifications[J].Prog.Polym.Sci., 2010, 35 (3):338-356.
[4] Mazumdar S, Clomburg J M, Gonzalez R.Escherichia colistrains engineered for homofermentative production of D-lactic acid from glycerol [J].Appl.Environ.Microb., 2010, 76 (13):4327-4336.
[5] Hong An’an (洪安安), Cheng Keke (程可可), Sun Yan (孙燕), Chen Zhen (陈珍), Peng Feng (彭枫), Liu Canming (刘灿明), Liu Dehua(刘德华). Strain screening for bioconversion of glycerol to lactic acid and optimization of culture medium [J].Microbiology China(微生物学通报), 2009, 36 (8):1195-1199.
[6] Hong A A, Cheng K K, Peng F,et al. Strain isolation and optimization of process parameters for bioconversion of glycerol to lactic acid [J].J.Chem.Technol.Biot., 2009, 84 (10):1576-1581.
[7] Tian Kangming (田康明), Zhou Li (周丽), Chen Xianzhong (陈献忠),Shen Wei (沈微), Shi Guiyang (石贵阳), Suren Singh, Lu Fuping (路福平), Wang Zhengxiang (王正祥). Temperature-switched highefficiency D-lactate production from glycerol [J].Chinese Journal of Biotechnology(生物工程学报), 2013, 29 (1):111-114.
[8] Tian Kangming, Chen Xianzhong, Shen Wei, Bernard A Prior, Shi Guiyang, Suren Singh, Wang Zhengxiang. High-efficiency conversion of glycerol to D-lactic acid with metabolically engineeredEscherichia coli[J].Afr.J.Biotec., 2012, 11 (21):4860-4867.
[9] Hofvendahl K, Hahn-Hägerdal B. Factors affecting the fermentative lactic acid production from renewable resources [J].Enzyme Microb.Tech., 2000, 26 (2):87-107.
[10] Zhang Xueli (张学礼). Twenty years development of metabolic engineering—a review [J].Chinese Journal of Biotechnology(生物工程学报), 2009, 25 (9):1285-1295.
[11] Christensen B, Thykaer J, Nielsen J. Metabolic characterization of high- and low-yielding strains ofPenicillium chrysogenum[J].Appl.Microb.Biotec., 2000, 54 (2):212-217.
[12] Madison L L, Huisman G W. Metabolic engineering of poly(3-hydroxyalkanoates):from DNA to plastic [J].Microbiol.Mol.Biol.Rev., 1999, 63 (1):21-53.
[13] Park J H, Lee K H, Kim T Y,et al. Metabolic engineering ofEscherichia colifor the production of L-valine based on transcriptome analysis and in silico gene knockout simulation [J].Proc.Natl.Acad.Sci.USA, 2007, 104 (19):7797-7802.
[14] Jarboe L R, Grabar T B, Yomano L P, Shanmugan K T, Ingram L O.Development of ethanologenic bacteria//Olsson L. Biofuels [M].Berlin:Springer, 2007:237-261.
[15] Zhang Xueli, Kaemwich Jantama, Moore J C, Shanmugam K T,Ingram L O. Production of L-alanine by metabolically engineeredEscherichia coli[J].Appl.Microbiol.Biot., 2007, 77 (2):355-366.
[16] Kaemwich J, Zhang Xueli, Moore J C, Shanmugam K T, Svoronosand S A, Ingram L O. Eliminating side products and increasing succinate yields in engineered strains ofEscherichia coliC [J].Biotech.Bioeng.,2008, 101 (5):881-893.
[17] Kaemwich J, Haupt M J, Spyros A Svoronos, Zhang Xueli, Moore J C,Shanmugamand K T, Ingram L O. Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains ofEscherichia colithat produce succinate and malate[J].Biotech.Bioeng., 2008, 99 (5):1140-1153.
[18] Lee S J, Lee D Y, Kim T Y, Kim B H, Lee J, Lee S Y. Metabolic engineering ofEscherichia colifor enhanced production of succinic acid, based on genome comparison and in silico gene knockout simulation [J].Appl.Environ.Microbiol., 2005, 71:7880-7887.
[19] Glassner D A, Datta R. Process for the production and purification of succinic acid [P]:US, 5143834. 1992.
[20] Meynial-Salles I, Dorotyn S, Soucaille P. A new process for the continuous production of succinic acid from glucose at high yield,titer, and productivity [J].Biotech.Bioeng., 2007, 99 (1):129-135.
[21] Zhao Geng (赵耿). Study on the production of lactic acid by bioconversion of waste glycerol [D]. Quanzhou:Huaqiao University,2010.

