冰片对反式白藜芦醇药动学的影响研究
陈靓,王明凤,关艳,王俊俊,陈勇
(湖北省中药生物技术重点实验室(湖北大学),湖北省生物资源绿色转化协同创新中心(湖北大学),湖北武汉430062)
0 引言
冰片(borneol)又名片脑、龙脑、桔片、艾片等,是著名的中药“药引”,有通诸窍,散郁火,去翳明目,消肿止痛,清热散毒,散火解毒之功效[1].2010年版的中国药典中收录含有冰片的成药有20余种,如安宫牛黄丸、复方丹参滴丸、牛黄降压丸等.近年来有许多文献报道冰片能明显松弛细胞间紧密连接,抑制细胞膜P-糖蛋白(P-gp)功能,促进其他药物进入各种生物脂质膜,提高其生物利用度[2-5].
白藜芦醇(resveratrol,Res)是含有芪类结构的非黄酮类多酚化合物,化学名称为3,4',5-三羟基二苯乙烯,它有顺式与反式两种构型,后者是白藜芦醇的稳定结构.白藜芦醇主要来源于葡萄(红葡萄酒)、虎杖、花生、桑椹等植物,具有广泛的生物学活性,能够抗肿瘤、抗病毒、免疫调节、保护心血管、预防肝损伤,对骨质疏松、痤疮及老年痴呆症也有预防作用[6-8].但反式白藜芦醇口服生物利用度低,且体内代谢消除迅速[9-14].本文中研究了冰片对反式白藜芦醇的药代动力学影响.
1 材料
1.1 实验动物 Sprague-Dawley(SD)雄性大鼠(体重(280±20)g,购于湖北省实验动物研究中心)饲养于SPF动物房,自由饮水和饮食.
1.2 实验仪器 日本岛津高效液相色谱仪(包括LC-20AD二元泵、SPD-20A紫外检测器、CTO-20AC柱温箱、SIL-20ACHT自动进样器、LC-Solution工作站);德国Eppendorf 5810R型高速离心机;德国Sartorius BP211D型电子天平;上海沪西分析仪器厂WH-2微型漩涡混合仪;天津仪器厂Vortex-5型漩涡震荡器;谭氏真空设备有限公司2XZ-4型旋片式真空泵;韩国BioTron Ecospin 3180C LABCONCO型真空浓缩离心机.
1.3 药品和试剂 反式白藜芦醇(纯度≥98%,批号111535-200502,中国药品生物制品检定所);根皮素(纯度≥98%,20 mg,成都曼斯特生物科技有限公司);冰片(纯度≥97%,50 g,阿法埃莎天津化学有限公司);羧甲基纤维素钠(中国医药上海化学试剂公司);分析纯Tween80(BIOSHARP公司);分析纯乙酸乙酯(国药集团化学试剂有限公司);水为屈臣氏蒸馏水;色谱纯甲醇和乙腈(TEDIA公司).
2 方法
2.1 色谱条件 色谱柱:Phenomenex ODS(150×4.60 mm,5 μm)和预柱Zorbax C18 guard column(4.6 mm×12.5 mm,5 μm);流动相:乙腈-水(体积比,28∶72);柱温:40℃;紫外检测波长:306 nm;流速:1.0 mL/ min;进样量:60 μL;分析时间为每个样品15 min.
2.2 对照品溶液配制 精密称量反式白藜芦醇对照品6.40 mg定容于5.0 mL容量瓶中(母液浓度为1.28 mg/mL),并配制标准品相应系列的浓度及质控浓度,于-20℃避光保存.精密称量根皮素对照品3.20 mg,甲醇溶解定容于5.0 mL容量瓶中(母液浓度为0.64 mg/mL),以甲醇稀释得浓度为6.4 μg/mL的根皮素溶液作为内标溶液,于-20℃保存备用.
2.3 血浆样品处理方法 取血浆100 μL置于1.5 mL EP管中,精密加入6.4 μg/mL的内标液8 μL,再加入乙酸乙酯250 mL,涡旋振荡混合3 min,4℃、12 000 r/min离心10 min,吸取上清200 μL至另一支1.5 mL EP管中,冷冻挥干后用100 μL流动相复溶,涡旋振荡混合3 min,4℃、12 000 r/min离心10 min,取上清80 μL进行分析.
2.4 动物实验 雄性SD大鼠40只,随机均分为灌胃给药和尾静脉注射给药两大组.灌胃给药包括反式白藜芦醇(30 mg/kg)单用组,以及反式白藜芦醇分别与低、中、高剂量冰片(50,100和200 mg/kg)合用组,每组5只.尾静脉注射给药包括反式白藜芦醇(10 mg/kg)单用组,以及反式白藜芦醇分别与低、中、高剂量冰片(50,100和200 mg/kg)合用组,每组5只.给药前禁食12 h但不禁水.灌胃给药组反式白藜芦醇和冰片用0.5%羧甲基纤维素钠溶液配制成混悬液,于给药后2,5,10,15,30,60,120,180,240,360,480 min眼眶取血;尾静脉注射组冰片用0.5%羧甲基纤维素钠溶液配制成混悬液,反式白藜芦醇用4% Tween80超声助溶,合用组冰片灌胃25 min后,尾静脉注射反式白藜芦醇,于给药后5,10,20,30,60,120,240,360,480 min眼眶取血.每只大鼠每次取血约0.5 mL,肝素抗凝,4℃、4 000 r/min离心10 min,取上清血浆100 μL,-20℃冻存备用.
2.5 数据处理方法 应用DAS3.0药动学分析软件(中国数学药理学学会),采用非房室模型处理血浆浓度-时间曲线,获得药动学参数.应用配对t检验进行给药前后生化指标的统计学分析,P<0.05被认为有显著性差异.所有测试数据均采用平均值±标准偏差(M±SD)表示.
3 结果
3.1 方法专属性 取SD大鼠空白血浆100 μL,按“血浆样品处理方法”操作;将一定浓度的反式白藜芦醇标准溶液加入空白血浆中,配制成100 μL的含药血浆,同法操作;取给药后的SD大鼠血浆样品100 μL,同法操作.各血浆样品经HPLC分析见图1.结果表明空白血浆中内源性物质不干扰反式白藜芦醇(峰1)和内标根皮素(峰2)的含量测定,且反式白藜芦醇和内标分离良好.
3.2 标准曲线的制备 精密量取反式白藜芦醇对照品储备液,以甲醇和空白血浆稀释成反式白藜芦醇浓度为20,40,80,160,320,640,1 280 ng/mL的含药血浆,按“血浆样品处理方法”操作,进行HPLC分析.以反式白藜芦醇色谱峰面积与内标色谱峰面积之比(Y)为纵坐标,反式白藜芦醇浓度(X)为横坐标制备工作曲线.
回归方程为:Y=0.006 569 66X+0.248 543,r2=0.999 3;线性范围为:20~1 280 ng/mL.
3.3 精密度与回收率考察 制备低、中、高浓度(40,160和640 ng/mL)反式白藜芦醇质控血浆样本各6份,并按“血浆样品处理方法”操作,在同一色谱条件下测定待测物和内标峰面积,代入标准曲线求得实测浓度,考核分析方法的日内、日间(连续3 d)精密度及回收率,结果见表1.
配制上述低、中、高3种浓度质控血浆样本各6份,并按“血浆样品处理方法”操作,在同一色谱条件下测定待测物和内标峰面积,代入标准曲线求得实测浓度,考察方法回收率.结果见表1.

图1 SD大鼠血浆中反式白藜芦醇及内标根皮素的色谱分离图
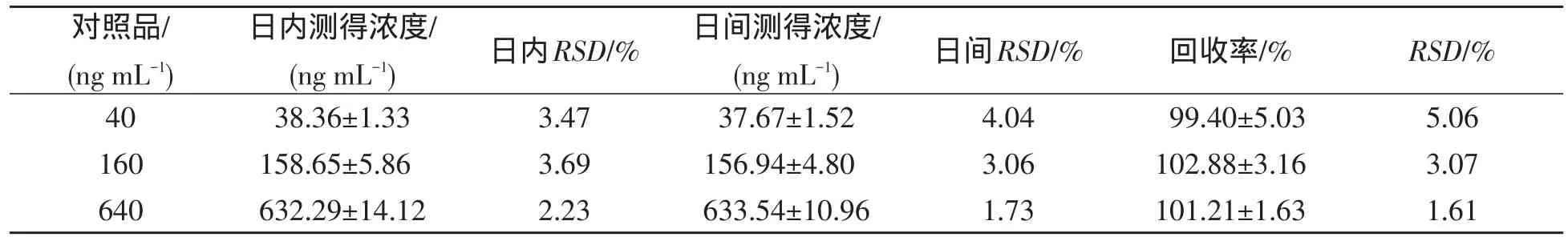
表1 反式白藜芦醇测定方法精密度与回收率(n=6,M±SD)
3.4 稳定性考察 配制成低、高两种不同浓度的血浆样本各3份,置于-20℃冰箱中冷冻保存10 d后取出,室温融解化冻,按“血浆样品处理方法”操作考察长期冷冻稳定性.配制成低、高两种不同浓度的血浆样本各3份,反复冻融3次后,按“血浆样品处理方法”操作考察反复冻融稳定性.配制成低、高2种不同浓度的血浆样本各3份,于室温放置7 h后按“血浆样品处理方法”操作考察样品室温放置稳定性.结果见表2.
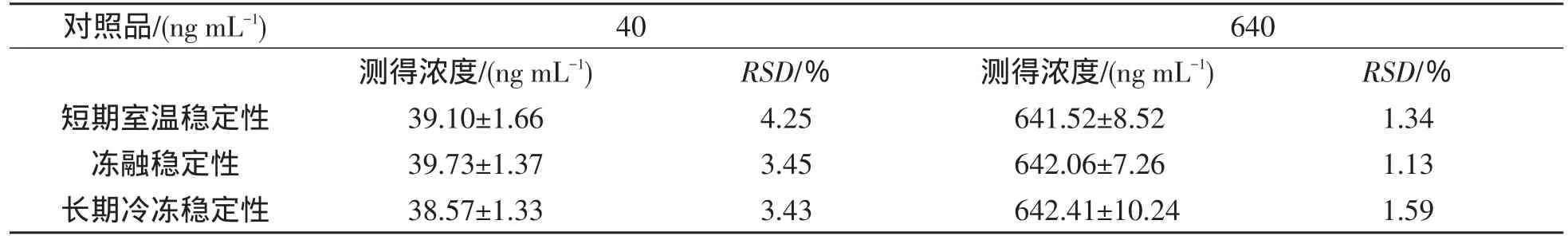
表2 反式白藜芦醇稳定性试验(n=3,M±SD)
3.5 药物代谢动力学结果 大鼠灌胃反式白藜芦醇(30 mg/kg)及其分别与低、中、高剂量冰片(50,100和200 mg/kg)合用后的药代动力学参数见表3,反式白藜芦醇血药浓度-时间曲线见图2.结果表明,与反式白藜芦醇给药组相比,与高剂量冰片合用组浓度-时间曲线下面积(AUC)、血药峰浓度(Cmax)、平均驻留时间(MRT)、消除半衰期(t1/2)、表观分布容积(Vz)及达峰时间(Tmax)明显增大,但与低剂量冰片合用组上述指标(除Vz、Tmax外)均明显减小.此外,随冰片剂量增大,药物清除率(CLz)逐渐减小,其中与低剂量冰片合用时明显高于对照组,与高剂量冰片合用时明显低于对照组.
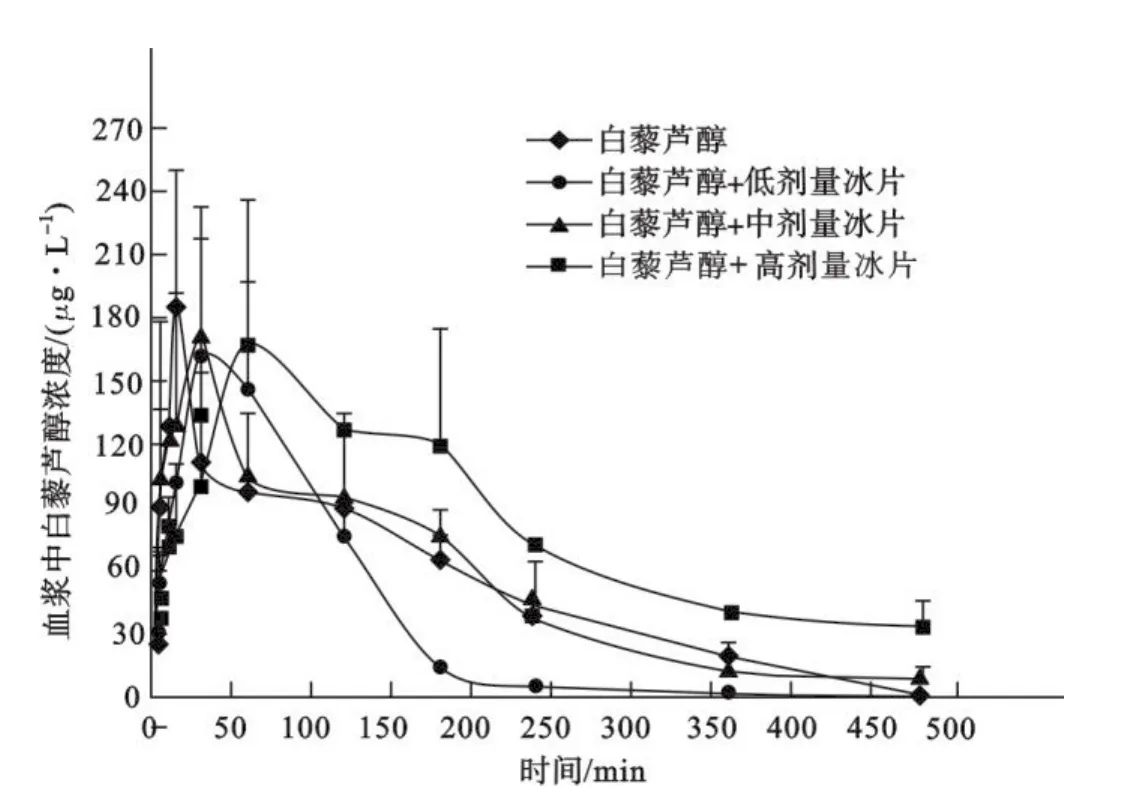
图2 反式白藜芦醇(30 mg/kg)及其分别与低、中、高剂量冰片(50,100和200 mg/kg)合用灌胃给药后大鼠血浆药-时曲线(n=5,M±SD)
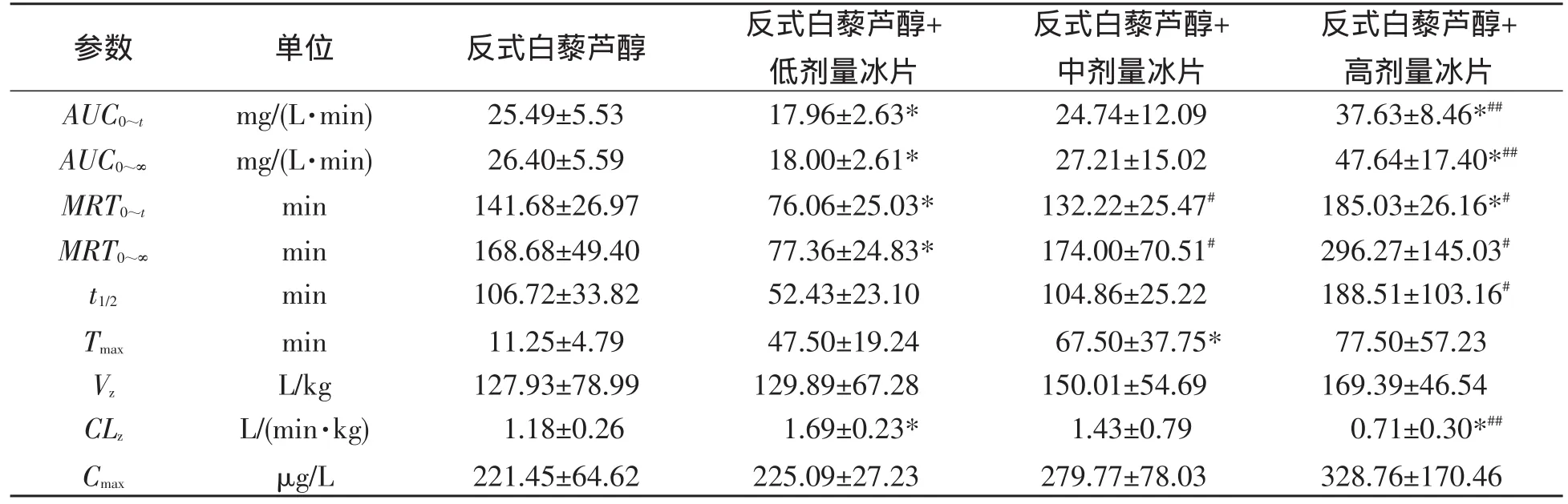
表3 反式白藜芦醇单用及与冰片合用灌胃给药的药动学参数(n=5,M±SD)
大鼠尾静脉注射反式白藜芦醇(10 mg/kg)及其分别与低、中、高剂量冰片(50,100和200 mg/kg)合用后的药代动力学参数见表4,反式白藜芦醇血药浓度-时间曲线见图3.结果表明,与反式白藜芦醇给药组相比,合用组浓度-时间曲线下面积(AUC)、血药峰浓度(Cmax)、平均驻留时间(MRT)逐渐增大,表观分布容积(Vz)和药物清除率(CLz)逐渐减小.其中与高剂量冰片合用组AUC0~∞增大了73.6%(P<0.05),Vz减小了39.2%(P>0.05),Cmax升高了20.1%(P>0.05),MRT0~∞延长了20.1%(P>0.05),CLz减小了42.1%(P<0.05).
4 讨论
近年来研究表明,冰片能够促进药物吸收,提高血管壁通透性,开放血脑屏障及血-脑脊液屏障,从而提高药物的治疗效果[15-17].在实验中,设定的反式白藜芦醇及冰片的低、中、高给药剂量均是参考中国药典(2010版)[18]中关于人的相关规定,经人与大鼠的给药剂量换算得出的.
本研究表明,反式白藜芦醇与冰片合用,不管是灌胃给药,还是静脉注射给药,对反式白藜芦醇大鼠体内药动学均有明显影响.与高剂量冰片合用,大鼠灌胃与尾静脉注射给药均能较明显提高反式白藜芦醇的AUC,延长MRT,降低CLz.在灌胃给药时,低剂量冰片降低了反式白藜芦醇在大鼠体内的AUC与MRT,提高了CLz;但高剂量冰片增加了反式白藜芦醇在大鼠体内的AUC与MRT,降低了CLz;这可能是冰片在低剂量时,对相关CYP450酶活的诱导作用[19-20]强于其对反式白藜芦醇的促吸收作用,而随着冰片剂量的增大,促吸收作用逐渐占据主导地位的结果.在静脉注射给药中,冰片对反式白藜芦醇的吸收虽有促进作用,但并不呈现剂量依赖性,说明冰片对药物影响的剂量效应并不明确,增加冰片的量不一定能成比例地促进药物的吸收,此结论对比相关研究,也可以得到佐证[21-22].
大鼠与高剂量冰片合用能增加反式白藜芦醇的药-时曲线下面积,但冰片可能对反式白藜芦醇在大鼠体内的吸收、分布以及消除均有影响.但具体是哪条途径决定了冰片对反式白藜芦醇的药代动力学影响,还需要进一步的实验来验证.
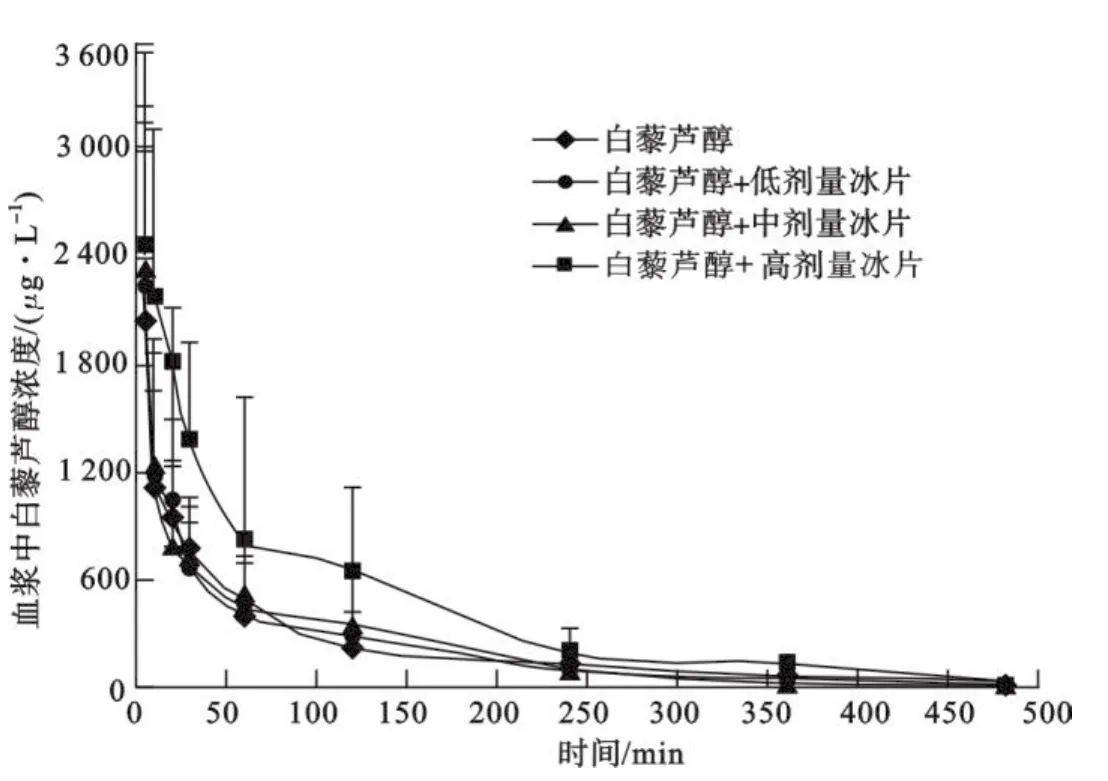
图3 反式白藜芦醇(10 mg/kg)及其分别与低、中、高剂量冰片(50,100和200 mg/kg)合用静注后大鼠血浆的药-时曲线(n=5,M±SD)
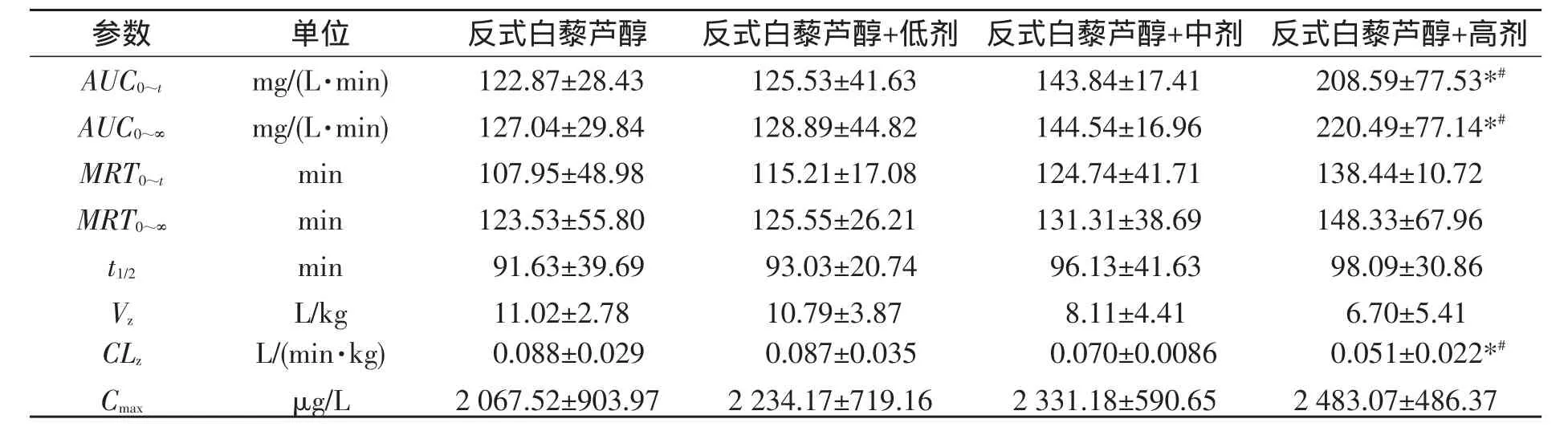
表4 尾静脉注射反式白藜芦醇及其与冰片合用时的药动学参数(n=5,M±SD)
[1]郭珊珊,余玲,陈巧玲,等.冰片药效学研究进展[J].中国现代中药,2008,10(6):6-9.
[2]He H,Shen Q,Li J.Effects of borneol on the intestinal transport and absorption of two P-glycoprotein substrates in rats[J]. Archives of Pharmacal Research,2011,34:1161-1170.
[3]Yu B,Ruan M,Dong X,et al.The mechanism of the opening of the blood-brain barrier by borneol:a pharmacodynamics and pharmacokinetics combination study[J].Journal of Ethnopharmacology,2013,150:1096-1108.
[4]Cui Y,Li L,Zhang L,et al.Enhancement and mechanism of transdermal absorption of terpene-induced propranolol hydrochloride[J].Archives of Pharmacal Research,2011,34:1477-1485.
[5]Liu J,Fu S,Wei N,et al.The effects of combined menthol and borneol on fluconazole permeation through the cornea ex vivo[J].European Journal of Pharmacology,2012,688:1-5.
[6]张宝红.白藜芦醇药理研究进展[J].现代医院,2008,8(3):66-67.
[7]周福成,周艳琴,郭婷婷,等.白藜芦醇的研究进展[J].研究进展,2009,6(8):11-13.
[8]韩晶晶,刘炜,毕玉平.白藜芦醇的研究进展[J].生物工程学报,2008,24(11):1851-1859.
[9]Li Liang,Liu Xueying,Wang Qingwei,et al.Pharmacokinetics,tissue distribution and excretion study of resveratrol and its prodrug 3,5,4-tri-O-acetylresveratrol in rats[J].Phytomedicine,2013,20:558-563.
[10]He Hui,Chen Xijing,Wang Guangji,et al.High-performance liquid chromatography spectrometric analysis of transresveratrol in rat plasma[J].Journal of Chromatography B,2006,832:177-180.
[11]张瑞,汪电雷,张弦,等.高效液相色谱法测定大鼠血浆中白藜芦醇含量及其药物代谢动力学[J].安徽中医学院学报,2010,29(5):56-58.
[12]Elisabeth Wenzel,Tomislav Soldo,Helmut Erbersdobler,et al.Bioactivity and metabolism of trans-resveratrol orally administered to Wistar rats[J].Molecular nutrition&Food research,2005,49:482-494.
[13]Thomas Walle,Faye Hsieh,Mark H,et al.High absorption but very low bioavailability of oral resveratrol in humans[J].Drug Metabolism and Disposition,2004,32(12):1377-1382.
[14]Lin Shiuan-Pey,Chu Pei-Ming,Shang-Yuan Tsai.Pharmacokinetics and tissue distribution of resveratrol,emodin and their metabolites after intake of polygonum cuspidatum in rats[J].Journal of Ethnopharmacology,2012,144:671-676.
[15]Lai Xiaojuan,Zhang Liang,Li Junsong,et al.Comparative pharmacokinetic and bioavailability studies of three salvianolic acids after the administration of Salviae miltiorrhizae alone or with synthetical borneol in rats[J].Fitoterapia,2011,82:883-888.
[16]Lu Yang,Chen Xiaolan,Du Shouying,et al.The in situ and in vivo study on enhancing effect of borneol in nasal absorption of geniposide in rats[J].Archives of Pharmacal Research,2010,35(5):691-696.
[17]Lu Yang,Du Shouying,Chen Xiaolan,et al.Enhancing effect of natural borneol on the absorption of geniposide in rat via intranasal administration[J].Biomedicine&Biotechnology,2011,12(2):143-148.
[18]中华人民共和国药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010.
[19]吴淳,高静雯,姚美村,等.天然冰片对大鼠细胞色素P450四种亚型活性的影响[J].中国临床药理学与治疗学,2013,18(2):121-127.
[20]Zhang Rong,Mi Suiqing,Wang Ningsheng.Effect of borneol on cytochrome P450 3A enzyme and midazolam pharmacokinetics in rats[J].European Journal of Drug Metabolism and Pharmacokinetics,2013,38(3):159-169.
[21]吴庆知,高秋华.冰片对胰岛素透粘膜吸收的促进作用研究[J].华中科技大学学报:自然科学版,2001,A01:41-44.
[22]赖筱娟,刘汉清,李俊松,等.丹酚酸提取物中3种成分的大鼠肠吸收特性及冰片对其吸收的影响[J].药学学报,2010,45(12):1576-1581.

