1.1类新药QR02001体内抗凝血活性研究
张轶涵,柳力,陶慧,陈勇,葛建
(1.湖北省中药生物技术重点实验室(湖北大学),湖北省生物资源绿色转化协同创新中心(湖北大学),湖北武汉430062;2.武汉启瑞药业有限公司,湖北武汉430062)
0 引言
作为第2代噻吩并吡啶类衍生物,硫酸氢氯吡格雷(以下简称氯吡格雷)比噻氯吡啶具有更好的安全性[1],阿司匹林联合氯吡格雷是目前临床抗血小板治疗的金标准[2].但两药合用导致的出血发生率增加、以及日益受到关注的阿司匹林和氯吡格雷抵抗,使得其抗血小板治疗难以满足人们的期望,因此如何在更有效抑制血小板活化的同时不增加出血并发症的发生率,是目前此领域研究的热点问题[3].氯吡格雷经过长期的临床用药,具有丰富的临床使用基础,该药物需在体内经过两步代谢,产生活性代谢物而发挥药效,但氯吡格雷结构上的甲酯易被水解形成无效产物,其85%经过肝脏羧酸酯酶hcE1代谢成无效代谢物,只有15%经CYP450酶代谢(两步代谢,先代谢为硫内酯)成活性代谢物发挥药效[4].因此其有效活性产物低,临床使用剂量高,一般临床使用维持剂量为75 mg/d[5].由于CYP2C19基因在人群中具有多态性,尽管CYP2C19酶占人体肝微粒的含量较小,但其酶缺陷在亚洲人中高达15%~23%[6].而CYP2C19在氯吡格雷代谢中占主要地位,在两步代谢中分别占约45%和20%,因此CYP2C19酶缺陷是产生氯吡格雷抵抗的主要原因[7].对于以上问题,我们对甲酯部分进行结构改造以提高此部分结构稳定性,减少其代谢为无效产物,将氯吡格雷一级代谢产物硫内酯与具有天然抗血小板聚集活性的化合物形成酯,以避开CYP2C19酶的代谢过程,解决氯吡格雷抵抗问题.同时该化合物进入体内水解成氯吡格雷的活性代谢物和天然抗血小板聚集活性的化合物,两者均具有抗血小板聚集活性,能够达到提高药效的目的.
本研究中,我们对QR02001进行全面抗凝血活性的研究,判断其在针对上述问题进行结构优化后,是否具有较强的抗凝血活性以及降低出血风险的预期.
1 材料与方法
1.1 药品与试剂 本研究所用试剂如下:枸橼酸钠(国药集团化学试剂,批号:20120509)、戊巴比妥钠(西亚试剂,批号:U48297)、生理盐水(辰欣药业股份有限公司,批号:12032520723)、硫酸氢氯吡格雷(湖北楚盛威化工有限公司,批号:20120908123)、QR02001化合物(武汉启瑞药业有限公司,批号:20120902301)、角叉菜胶(上海源叶生物科技有限公司,批号:YY13756-1)、ADP(Sigma,批号:078 K7001)、肝素(国药集团化学试剂,批号:20120612),除硫酸氢氯吡格雷和QR02001化合物为药用级别外,其余试剂均为分析纯.
1.2 实验动物 Wistar大鼠,雄性,200~250 g,合格证号:11400700066538,购于北京维通利华实验动物技术有限公司;昆明小鼠,雄性,20~25 g,合格证号:42000500005074,购于武汉大学动物实验中心.饲养条件:自由饮食饮水,5只/笼饲养,12 h/12 h光/暗周期调节,温度(23±1)℃恒温,湿度适宜,普通级动物房饲养,自取回后,适应性饲养一周,并于实验开始前3天进行适应性灌胃,每周测量2次动物体重.本研究内开展的所有动物实验均经过武汉启瑞药业有限公司动物伦理委员会审批.
1.3 仪器与设备 血小板聚集仪(北京普利生仪器有限公司,型号:LBY-NJ4),台式高速离心机(Thermo Fisher,型号:Pico17),计时器.
1.4 方法
1.4.1 QR02001对ADP诱导大鼠血小板聚集作用的影响 Wistar大鼠,雄性,体重200~250 g,购回给予基础饲料适应一周,根据体重随机分为5组:溶媒对照组、硫酸氢氯吡格雷组(5 mg/kg)、QR02001(0.5 mg/ kg)组、QR02001(1.5 mg/kg)组、QR02001(5 mg/kg)组,每组8只.给药前晚禁食12 h.上午8:30 9:00灌胃给药,给药1 h后正常进食.给药4 h后,将大鼠用戊巴比妥钠(60 mg/kg)腹腔注射麻醉,进行腹主动脉取血,全血用3.8%枸橼酸钠溶液(体积比1∶9)抗凝[8],室温3 000 r/min离心5 min;将上清转移至新的离心管中,得到PRP(富血小板血浆);沉淀部分继续室温、3 000 r/min离心10 min,此次离心上清转移至新的离心管中,得到PPP(贫血小板血浆).PRP用血细胞计数仪计数血小板的数量,用PPP血浆稀释至血小板密度为3×108个/mL[9].实验开始前将血小板聚集仪先开机,仪器预热30 min,待温度升高至37℃时开始实验,加入样品预热1 min后,加入诱导剂ADP(终浓度为10 μmol/L)诱导血小板的聚集反应,测定5 min内的最大聚集率.血小板聚集抑制率/%=(阴性对照最大聚集率-给药组最大聚集率)/阴性对照最大聚集率×100.
1.4.2 QR02001对角叉菜胶致KM小鼠血栓形成的影响 雄性昆明小鼠100只,体重20~25 g,购回给予基础饲料适应一周,根据体重随机分为5组,每组20只,分为溶媒对照组、硫酸氢氯吡格雷组(10 mg/kg)、QR02001(2.5 mg/kg)组、QR02001(5 mg/kg)组、QR02001(10 mg/kg)组.给药前晚适当禁食.上午9:30 10:00灌胃给药,连续给药5 d,对照组小鼠灌胃给予等体积的0.5%CMC-Na;在第3天给完药物1 h后,各组小鼠用1.5%的角叉菜胶(用生理盐水配制)0.1 mL/10 g背部皮下注射[10-12],记录小鼠注射角叉菜胶48 h后小鼠黑尾发生率及黑尾长度[13].
1.4.3 QR02001对大鼠颈动静脉旁路丝线法致血栓形成的影响 Wistar大鼠,雄性,体重200~250 g,购回给予基础饲料适应一周,根据体重随机分为5组:空白溶媒组、硫酸氢氯吡格雷组(5 mg/kg)、QR02001(0.5 mg/kg)组、QR02001(1.5 mg/kg)组、QR02001(5 mg/kg)组,每组8只,给药前晚禁食12 h,给药后4 h按体重以60 mg/kg剂量的1%戊巴比妥麻醉后,颈部剃毛,背位固定手术台上,用75%酒精消毒皮肤,并分离右颈总动脉及左颈外静脉.在PE50导管的中段放入一根长8 cm的丝线.以肝素-生理盐水溶液(50 U/ mL)充满PE50导管.当PE50导管的一端插入左颈外静脉后,由PE50导管准确地注入肝素(5 IU/kg)抗凝,然后再将PE50导管的另一端插入右颈总动脉.打开动脉夹,血液从右颈总动脉流至PE50导管内,返回左颈外静脉.开放血流15 min后中断血流,迅速取出丝线称重,总重量减去丝线重量即得血栓湿重[14].按如下公式计算各药的血栓形成抑制率:

1.4.4 QR02001对大鼠断尾出血时间的影响 Wistar大鼠雄性,体重200~250 g,购回后给予基础饲料适应一周,根据体重随机分为5组:溶媒对照组、硫酸氢氯吡格雷组(5 mg/kg)、QR02001(0.5 mg/kg)组、QR02001(1.5 mg/kg)组、QR02001(5 mg/kg)组,每组8只,给药前晚禁食12 h,上午8:30 9:00灌胃给药,给药后正常进食,给药4 h后,用剪刀自鼠尾尖部0.5 cm处剪断,鼠尾置于滤纸上,自血液流出时开始计时,到血流自然停止时为止,所经历时间计为出血时间,出血时间超过60 min的,以60 min计算[15].
1.4.5 统计方法 数据均以mean±sem表示,采用SPSS(Statistical Product and Service Solutions V19.0)进行单因素方差分析(One-way ANOVA)结合组间两两比较,P值<0.05被认为有显著性差异.
2 结果
2.1 QR02001对ADP诱导大鼠血小板聚集作用的影响 图1各剂量组最大聚集率中可以看出,氯吡格雷(5 mg/kg)组最大聚集率为(32.8±3.35)%,较空白对照组有极显著降低;QR02001(0.5 mg/kg)组为(43.9±1.53)%、QR02001(1.5 mg/kg)组为(37.2±2.10)%、QR02001(5 mg/kg)组仅为(0.4±0.37)%,较空白对照组均有极显著性降低;QR02001(5 mg/kg)组与氯吡格雷(5 mg/kg)组相比有极显著差异.图2各剂量在聚集抑制率中可以看出:氯吡格雷(5 mg/kg)组血小板聚集抑制率为(38.9±6.23)%、QR02001(0.5 mg/kg)组为(18.3±2.85)%、QR02001(1.5 mg/kg)组为(30.7±3.92)%、QR02001(5 mg/kg)组为(99.2±0.68)%,与空白对照组相比均有极显著性差异;QR02001(5 mg/kg)组与氯吡格雷(5 mg/kg)组相比有极显著差异.
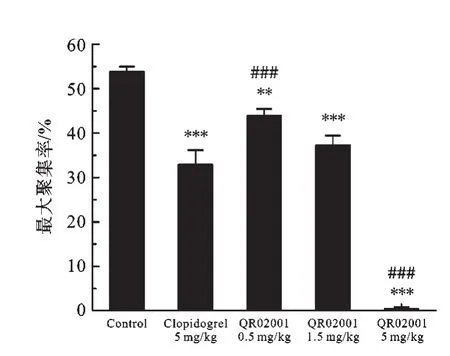
图1 各剂量组最大聚集率
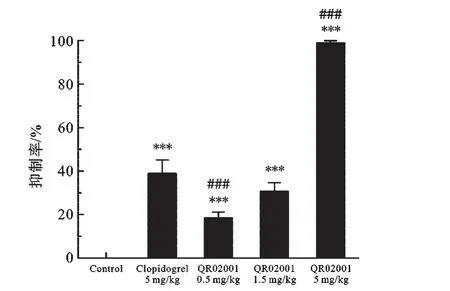
图2 各剂量组聚集抑制率
2.2 QR02001对角叉菜胶致KM小鼠血栓形成的影响 图3各剂量组的小鼠黑尾长度中可以看出:氯吡格雷(10 mg/kg)组小鼠黑尾长度为(10.4±0.97)cm、QR02001(2.5 mg/kg)组为(13.5±1.43)cm、QR02001(5 mg/ kg)组为(10.7±1.41)cm、QR02001(10 mg/kg)组为(7.2± 1.49)cm;与空白对照组相比,各剂量组均表现出极显著性降低;与氯吡格雷(10 mg/kg)组相比,QR02001(10 mg/kg)组表现出显著性降低.
2.3 QR02001对大鼠颈动静脉旁路丝线法致血栓形成的影响 图4各剂量组的血栓抑制率中可以看出:氯吡格雷(5 mg/kg)组平均血栓抑制率为(44.8±5.31)%、QR02001(0.5 mg/kg)组为(38.3±4.15)%、QR02001(1.5 mg/kg)组为(45.8±4.58)%、QR02001(5 mg/kg)组为(55.4±3.70)%;QR02001(5 mg/kg)组与氯吡格雷(5 mg/kg)组相比有极显著差异.
2.4 QR02001对大鼠断尾出血时间的影响 图5各剂量组的出血时间中可以看出:氯吡格雷(5 mg/kg)组的出血时间为(32.2±2.63)min、QR02001(0.5 mg/kg)组为(30.5±2.84)min、QR02001(1.5 mg/kg)组为(33.7±2.15)min、QR02001(5 mg/kg)组为(35.78±0.65)min;与空白对照组相比,QR02001(0.5 mg/kg)组有显著性增加,氯吡格雷(5 mg/kg)组、QR02001(1.5 mg/kg)组、QR02001(5 mg/kg)组具有极显著增加;氯吡格雷(5 mg/kg)组与QR02001各剂量组间并无显著性差异.
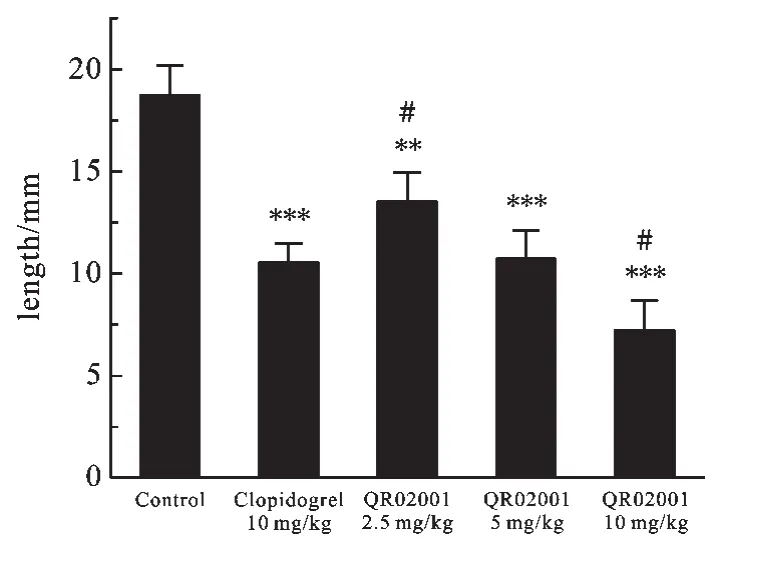
图3 各剂量组的小鼠黑尾长度
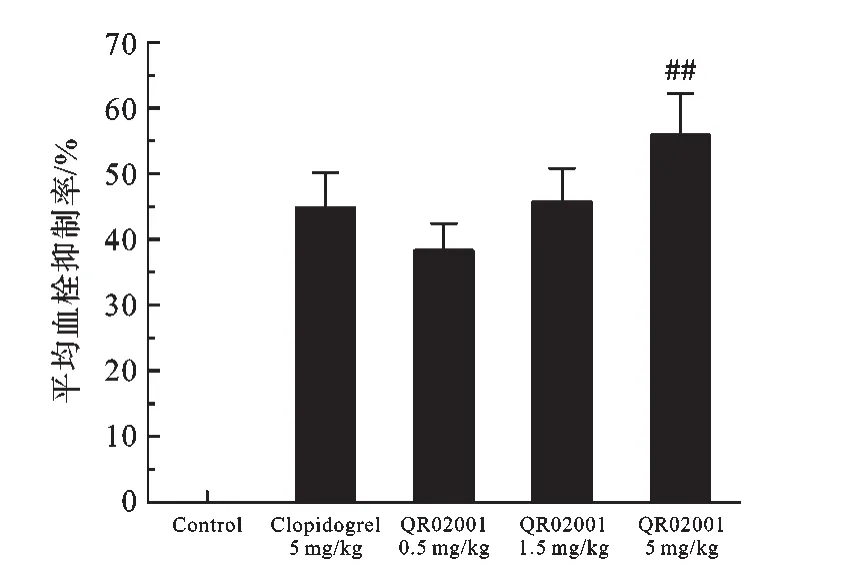
图4 各剂量组的血栓抑制率#P<0.05,##P<0.01,###P<0.001,QR02001与氯吡格雷相比.
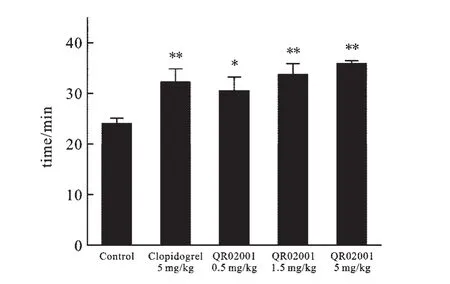
图5 各剂量组的出血时间*P<0.05,**P<0.01,***P<0.001,给药组与空白对照相比.
3 讨论
实验结果证实,1.1类新药QR02001抗凝血活性显著优于同等剂量下的硫酸氢氯吡格雷.推测该结果为,QR02001在进入体内后经过血液中的酯酶水解成两个具抗血小板聚集活性的物质,从而提高了抗凝血活性,也解决了氯吡格雷生物利用度低的问题;且QR02001只需经过CYP450酶的一步代谢,成功避开CYP2C19酶代谢,有可能解决氯吡格雷抵抗的问题.针对于一般的抗凝血药物来讲,较好的抗凝血活性均伴随着较大的出血风险,但在本研究中发现:在同等剂量下,QR02001的抗凝血活性显著优于硫酸氢氯吡格雷,但其出血时间较硫酸氢氯吡格雷并无显著性增加.结合前期的抗凝血活性与hERG钾离子通道心脏安全性研究结果显示,QR02001化合物的抗凝血活性高,出血时间与阳性药相当,且无心脏毒性.因此,本研究采取的技术策略在理论层面与实际操作层面都是可行的.
与QR02001相比,国内其他同类型抗凝血药物的研发过程中,也采用到了更改化合结构来达到解决氯吡格雷生物利用度低和氯吡格雷抵抗的目的.例如:江苏(南京)威凯尔研发的新化合物维卡格雷就是采用了这一手段,其通过拼接氯吡格雷和普拉格雷部分基团,来实现避开CYP2C19酶的代谢,直接代谢为活性化合物而发挥药效.但是氯吡格雷和普拉格雷两种药物均具有较大的出血风险,两种药物的基团拼接是否会增加出血风险需要进一步验证.
在完成QR02001前期抗凝血活性的研究后,后期需要进一步明确QR02001体内的代谢途径、生物利用度等相关信息,确定QR02001是否解决了氯吡格雷抵抗的问题.
[1]Quinn M J,Fitzgerald D J.Ticlopidine and clopidogrel[J].Circulation,1999,100(15):1667-1672.
[2]Jacobson A K.Platelet ADP receptor antagonists:ticlopidine and clopidogrel[J].Best Pract Res Clin Haematol,2004,17(1): 55-64.
[3]Angiolillo D J.Pharmacology of emerging novel platelet inhibitors[J].Am Heart,2008,156:S10-S15.
[4]NiitsuY,Sugidachi A,Ogawa T.Repeat oral dosing of prasugrel,anovel P2Y12 receptor inhibitor,results incumulative and potent antiplatelet and antithromboticactivity inseveral anima lspecies[J].Euro Phmar J,2008,579:276-278.
[5]刘新兵,冯六六,黄红漫,等.不同剂量氯吡格雷对急性冠脉综合征并肾功不全患者血小板聚集率的影响[J].心血管康复医学杂志,2009,18(3):264.
[6]Sugidachi A,Ogawa T,Kurihara A,et al.The greater in vivo antiplatelet effects of prasugrel as compared to clopidogrel reflect more efficient generation of its active metabolite with similar antiplatelet activity to that of clopidogrel’s active metabolite[J]. Journal of Thrombosis and Haemostasis,2007(5):1545-1551.
[7]张禹,于淑梅.常用抗血小板药物的临床应用[J].中国临床医药研究杂志,2008,14(179):1-2.
[8]谢立,张林.氯吡格雷的合理应用及进展[J].中国药师,2008,11(12):1516-1519.
[9]李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:496-497.
[10]Hansra P,Moran E L,Fornasier V L.Carrageen an-induced arthritis in the rat[J].In flammation,2000,24(2):141-152.
[11]Bekemeier H,Hirschelmann R,Giessler A J.Carrageenin-induced thrombosis in rats and mice:a model for testing antithrombotic substances[J].Agents and Actions,1985,16(5):446-451.
[12]Hagimori M,Kamiya S,Ymaguchi Y,et al.Improving frequency of thrombosis by altering blood flow in the carrageenan rat tail thrombosis model[J].Pharm Res,2009,60:320-323.
[13]刘彦霞,郭豫.角叉菜胶致血栓动物模型制备及在功能食品评价中的应用[J].食品工业,2012,33(8):87-89.
[14]魏伟,吴希美,李元建,等.药理实验法学[M].北京:人民卫生出版社,2010:1068-1086.
[15]Kihara H,Koganei H.Antithrombotic activity of AT-1015,a potent 5-HT2 A receptor antagonist,in rat arterial thrombosis model and its effect on bleeding time[J].European Journal of Pharmacology,2001,433:157-162.

