薄荷愈伤组织诱导与分化研究
蔡 健,马同富,2*
(1.阜阳师范学院 生物与食品工程学院 阜阳 236037; 2. 抗衰老中草药安徽省工程技术研究中心 阜阳 236037)
薄荷( Mentha haplocalyx Brip.) 为唇形科薄荷属,是一种多年生宿根性芳香草本植物,是世界上三大香料之一、常用中药之一,贸易量在1 万吨左右[1-2]。所以大力开发利用这一植物资源很有必要[1-3]。安徽省阜阳市是我国薄荷主产区,最高达到1 万多hm2,约占全国的1/4。但由于繁殖材料携带母体病毒和薄荷连年种植等原因,导致薄荷品种严重退化,薄荷产量和原油质量逐年下降。利用组织培养创造体细胞无性系变异,是作物品种改良的一条行之有效的技术途径。运用组织培养技术快速繁殖脱毒苗、优质苗已成为薄荷生产上的迫切需求,而薄荷离体培养愈伤组织诱导与分化是组织培养研究中的一个重要内容[4-10]。本研究以薄荷茎段为外植体,研究培养基、激素水平对诱导、增殖培养的影响;以叶片为外植体,探讨叶片的愈伤组织诱导;以茎段、叶片和叶柄为外植体材料,比较不同外植体的愈伤组织诱导率。
1 材料与方法
1.1 试验地点与材料
试验在阜阳师范学院生物技术应用研究所生物组培室和阜阳市农业科学院组织培养中心进行,试验材料为阜阳市农业科学院培育的“阜油9 号”薄荷品系。
1.2 试验方法
1.2.1 外植体的消毒
外植体采回后,先用流水冲洗10 min,其中,茎段需要用刷子刷洗几遍。然后都在超净台上用70% 酒精处理30 s,再对外植体消毒。消毒后均用无菌水冲洗4-5 遍。
1.2.2 培养条件培养条件是光照强度1 000 Lx,光照时间14 h/d,培养温度25 ℃,pH 值调至5.8-6.0。
1.2.3 愈伤组织诱导
1.2.3.1 叶片的愈伤组织诱导
以叶片为外植体,叶片切成(0.5 cm×0.5 cm)的方块。每瓶接种4 块外植体,重复3 次。培养期间,每周观察记录外植体的形态变化,30 d 后统计愈伤组织诱导率。
愈伤组织诱导率=(产生愈伤组织的外植体块数/接种的外植体块数) ×100%
愈伤组织诱导天数为外植体接入培养基开始到外植体边缘长出肉眼可见的淡黄色愈伤组织为止的天数。
1.2.3.2 不同外植体的愈伤组织诱导率比较
对薄荷叶片、叶柄、茎段先用70%酒精消毒30 s,再用0.1% HgCl2+ Tween80 消毒20 min,切成0.5 cm 小段,叶片切成(0.5 cm ×0.5 cm) 小块,接种在以下培养基上: (1) MS + 0.05 mg/L BA +0.01 mg/L NAA; (2) MS + 0.1 mg/L BA +0.01 mg/L NAA;(3) MS + 0.5 mg/L BA + 0.1 mg/L NAA;(4)MS + 1.0 mg/L BA + 0.1 mg/L NAA。每一处理10 瓶,每瓶接种5 个外植体,重复10 瓶。培养期间,每7 d 观察记录外植体的形态变化,30 d后统计愈伤组织诱导率。愈伤组织分化率=( 分化出不定芽的愈伤组织块数/愈伤组织总数) ×100%。
1.2.4 继代培养
1.2.4.1 嫩茎的继代增殖培养
以GA3、BA、KT 为三个因素进行正交试验L9(3)。选用由茎段培养获得的一致的无菌苗在9 种培养基上继代培养,每种培养基接种20 个,每瓶2个,重复3 次。30 d 后统计其增殖率、增殖倍数。
增殖率=( 分化出不定芽的芽数/接种的总芽数) ×100%;
增殖倍数=( 每次继代培养中增殖后的芽数/接种芽数) ×100%。
1.2.4.2 愈伤组织的继代培养
采用正交设计L9 (3),选取绿色紧密的愈伤组织,切成0.5 cm × 0.5 cm 的小块,每种培养基接种10 瓶,每瓶2 个,重复3 次,30 d 后,统计其愈伤组织分化率。
2 结果与分析
2.1 愈伤组织诱导
2.1.1 叶片愈伤组织诱导
薄荷叶片接种以后,依培养基中的激素配比不同,各组合都程度不同地形成愈伤组织,其诱导率、时间各不相同。据实验观察,接种4 d 后,叶片明显变厚且呈水渍状,6 d 后在组织块形成层表面形成愈伤组织。愈伤组织有的表面整齐,颜色呈深绿色,质地坚硬,28 d 愈伤组织细胞增生块肿大,肿大部分为白色,形成的这一类愈伤组织整体增殖较慢。另一部分组织块形成的愈伤组织表面凹凸不平,为泡状细胞团,浅绿色,同时,还有黄绿色,白色等愈伤组织的形成,其质地都较松散,形成的这一类愈伤组织整体增殖较快。
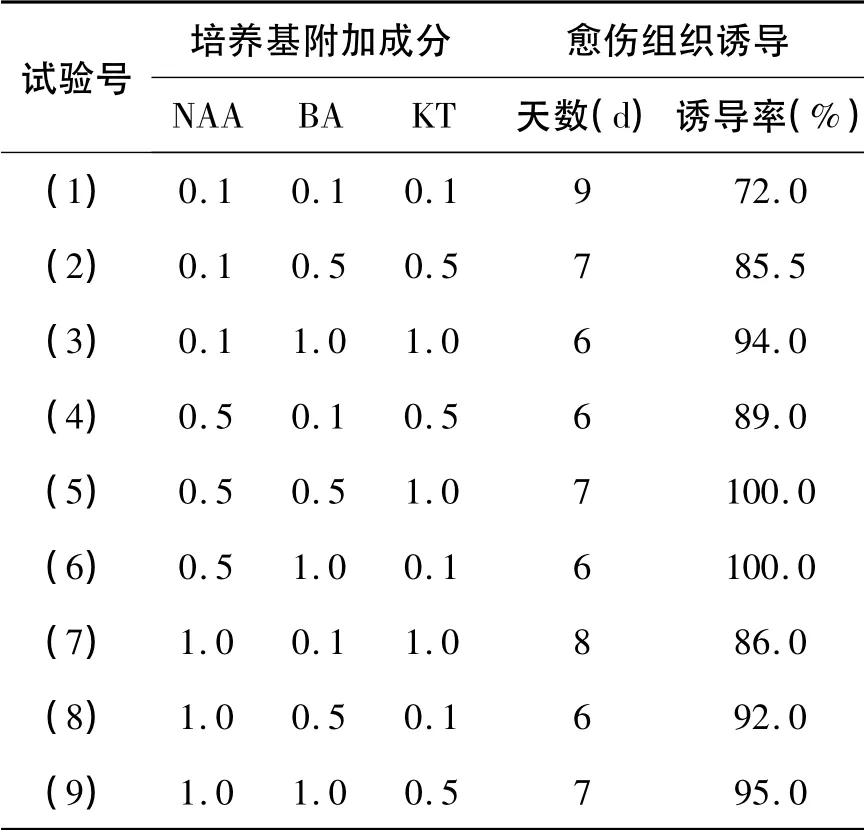
表1 叶片愈伤组织诱导试验结果
由表1可知,第6 种培养基MS +1.0 mg/L BA+0.1 mg/L KT + 0.5 mg/L NAA 的愈伤组织诱导效果最好,诱导率高达100%,诱导时间最短,仅为6 d。第1 种培养基( MS + 0.1 mg/L BA +0.1 mg/L KT + 0.1 mg/L NAA) 的愈伤组织诱导率最低,为72%,而且诱导的时间也较长,为9 d。第5 种培养基( MS + 0.5 mg/L BA + 1.0 mg/L KT + 0.5 mg/L NAA),虽然也能获得最高的诱导率(100%),但与没有加KT 的对照培养基对比(MS + 0.5 mg/L BA + 0.5 mg/L NAA),其愈伤组织容易老化,呈黄褐色,不利于继代培养和分化培养。第2-4 种培养基虽然诱导时间短,但愈伤组织诱导率不高。第7-9 种培养基的诱导时间较长、但其愈伤组织的诱导率较高。
2.1.2 激素对诱导率的影响
BA 和NAA 对愈伤组织的诱导率存在着显著的作用,而KT 的作用不显著。当NAA 浓度为0.1 mg/L,1.0 mg/L 时对诱导率的影响差别不大,但当NAA 浓度为0.5 mg/L 时,可显著地提高愈伤组织的诱导率。BA 为0.1 mg/L 浓度时,愈伤组织的诱导率低,BA 为0.5 mg/L、1.0 mg/L 浓度时显著地提高愈伤组织的诱导率,因此可推测最佳激素组合(5)和组合(6)较好。因为KT 的价格昂贵,在考虑降低成本的前提下,得出最佳组合应为组合(6)。
2.1.3 不同外植体愈伤组织诱导比较
取薄荷新生枝的中部叶片,去除新生枝叶片部分后即得所需叶柄。试验过程中,将经过消毒的幼叶、叶柄接种在不同的培养基上,7 d 后,幼叶的主脉最先长出愈伤组织,继而切口处逐渐愈伤化,愈伤组织自两端形成,并向中间发展,直至整个组织;20 d 后,愈伤组织已覆盖整个叶片; 叶柄在接种15 d 后,其一端开始出现黄绿色紧密的愈伤组织,有的叶柄两端出现愈伤组织,但其愈伤组织的增殖较慢。

表2 不同外植体的愈伤组织诱导率
从表2中可以看出,在附加BA 和NAA 的4 种培养基中,愈伤组织诱导率都在72%以上,第3 种培养基即MS + 0.5 mg/L BA + 0.1 mg/L NAA对幼叶、叶柄和茎段都具有很高的愈伤组织诱导率,分别为100%、88%和87%,而且愈伤组织的长势也最好,培养1 个月时能达到1.0 cm 大小,其中幼叶的愈伤组织最大可达1.5 cm 。第4 种培养基MS + 1.0 mg/L BA +0.1 mg/L NAA 对三者的诱导效果次之,其愈伤组织的长势也较好,培养1 个月后,愈伤组织基本能达到0.9 cm 左右。第1 种培养基MS + 0.05 mg/L BA + 0.01 mg/L NAA对幼叶、叶柄和茎段的愈伤组织 诱 导 率最低,愈伤组织长势也最差,叶柄和茎段的愈伤组织体积均低 于0.5 cm。第1-2 种培养基所得愈伤组织的诱导率和愈伤组织长势均差于其它两组。总的来看,幼叶在4 种培养基上是三类外植体中诱导效果最好的,不仅愈伤组织诱导率高,长势旺,而且愈伤组织出现也最早。此外,4 种不同培养基上形成的愈伤组织的类型不相同,叶片的愈伤组织呈绿色紧密状,叶柄的愈伤组织呈黄绿色紧密状,茎段的愈伤组织呈淡黄色松软状。
2.2 继代培养
BA、KT 和GA3正交试验的结果表明细胞分裂素、生长素对植物器官分化、生长发育有着极其重要的影响。第9 种培养基即MS + 1.5 mg/L GA3+ 1.0 mg/L BA + 0.5 mg/L KT 对薄荷幼茎的增殖效果最好,其增殖率高达83%,增殖倍数为4.7。第7 种培养基MS + 1.5 mg/L GA3+ 0.2 mg/L BA + 1.0 mg/L KT 的增殖效果最低,其增殖率仅为51%,增殖倍数为2.5。第6 种培养基MS +1.0 mg/L GA3+ 1.0 mg/L BA + 0.2 mg/L KT 虽然能获得很高的增殖倍数(4.6),但其增殖率却只有75%。第8 种培养基MS + 1.5 mg/L GA3+0.5mg/L BA + 0.2 mg/L KT 的增殖率(80%) 高,但增殖倍数仅为3.5。第1-5 种培养基对薄荷幼茎的增殖率和增殖倍数均不明显。试验过程中发现嫩茎基部总有一定的愈伤组织,增殖芽就是从愈伤组织中长出。

表3 薄荷茎段增殖培养试验结果
从表3中可以看出,试验所安排的三个因素对薄荷嫩茎增殖率的影响均无显著性差异。BA 的浓度对试验结果影响最大。GA3、BA、KT 三种激素对增殖率的影响以BA 最为明显,随着BA 浓度的增大,薄荷嫩茎的增殖率也增大。GA3的浓度对薄荷嫩茎与BA 的变化趋势相似,也是随着GA3浓度的增大,其增殖率增大,但变化的幅度相对较小。随着KT 浓度的增大,薄荷幼茎的增殖率开始是呈下降趋势,当浓度达到某一临界值时,其增殖率则呈缓慢上升趋势,KT 浓度临界值为0.5 mg/L。
3 小结与讨论
3.1 小结
以增殖倍数和增殖率作指标探讨了薄荷增殖培养的效果。综合各项指标,最佳增殖培养基应为:MS + 1.0 mg/L BA + 0.1 mg/L KT + 0.5 mg/L NAA。
以叶片、叶柄、茎段为外植体诱导愈伤组织时,诱导率都达72%以上,高的可达100%。但三者的愈伤组织质地呈现明显的差异,以茎段诱导的愈伤组织质的松软,颜色黄绿; 叶片诱导的愈伤组织质地紧密坚硬,颜色深绿,更有利于愈伤组织的分化,最适的诱导培养基为MS + 1.0 mg/L BA + 0.1 mg/L KT + 0.5 mg/L NAA。愈伤组织20 d 继代一次,转入分化培养基愈伤组织一直没有分化。
3.2 讨论
3.2.1 关于嫩茎增殖过程中芽的起源问题
在嫩茎增殖培养过程中,嫩茎基部总有一定的愈伤组织,所增殖的芽从愈伤组织中长出,很容易让人认为是从愈伤组织分化出来的。本试验将此类愈伤组织切成块,继续培养,却未见有芽的分化,而带嫩茎的愈伤组织块上则又有不定芽的增殖。表明可能是嫩茎中的生长激素可以促进愈伤组织分化出不定芽;或者并不是愈伤组织分化出了不定芽,而可能是由嫩茎生长发育形成的,即嫩茎基部的隐芽的生长,这有待今后组织学方面的研究来验证。
3.2.2 关于组织培养中愈伤化的问题
在本试验中,不管是嫩茎的增殖培养,还是无菌苗的生根培养,苗的基部一般都易肿大愈伤化。前者不利于嫩茎的生长,后者则会影响移栽成活率。在降低了培养基中的激素浓度后,试验结果,仍然都有愈伤组织,虽然在继代培养中存在着激素的累积作用,但也不排除薄荷的内源激素生长素水平可能较高。目前,薄荷内源激素水平测定的研究很少,特别是在组织培养方面。原因有待于从内源激素方面作进一步探讨。
3.2.3 玻璃化的问题
玻璃化现象在植物组织培养中普遍存在,在实验过程中,所采的已萌发的顶芽褐化现象严重,一方面褐化的发生与外植体组织中所含的酚类化合物多少和多酚氧化酶活性有直接关系,而且在生长季节都含有较高的酚类物质; 另一方面,也可能与消毒有关,因为幼嫩的材料容易受到化学消毒剂的伤害,而受伤害程度会直接影响褐化,如消毒后的嫩叶和叶柄有的接种第2 d 即出现褐化,几天后死亡。为了减轻褐化,则应选用新生枝的中部的叶片和叶柄,顶芽应选粗的并切长些。
3.2.4 展望
现在世界上几乎所有地区均在开展植物组织培养的研究和应用,大部分是研究植物的再生和快速繁殖。薄荷的研究也不落后,其组织培养报道越来越多,但能否进行大量繁殖,有三个关键问题:无菌苗的获得、繁殖速度和生根移栽。目前在这些方面的研究虽然已经取得了一定的进展,但在生产上实行工厂化育苗仍有许多限制因素。如生产成本高,优良株系少等。今后的研究如在愈伤组织的分化、人工种子的生产实用化方面取得一定的进展,则薄荷芽的生产可以由种芽大量提供,如豆芽菜的生产一样,不受季节约束,占地面积小,而且管理方便,生产成本大大降低。同时愈伤组织的分化利于建立薄荷的再生体系,为薄荷的遗传改良研究打下基础。
[1]王栋章,赵国芳,张祖饶,等. 中国薄荷生产与贸易[M].南京:江苏科学技术出版社,1992.
[2]王云萍,叶愈青,付龙庚,等.药材薄荷贮藏期间质量变化初步分析[J].时珍国医国药,2000,11(8):745-746.
[3]孙明海,周传申等.薄荷栽培及其加工技术[J].作物种植,1999,9:20-21.
[4]刘 军,郝玉兰. 美国薄荷的组织培养与植株再生[J].内蒙古科技与经济,2011,21:83-85.
[5]李延红. 薄衙茎段诱导愈伤组织的研究[J]. 北方园艺,2008,10:163-165.
[6]郭晓恒,刘 涛.亚洲薄荷的快速繁殖及炼苗[J].安徽中医学院学报,2010,29(6):59-61.
[7]张泽宏,王兵丽等.薄荷组织和细胞培养的研究进展[J].漳州师范学院学报( 自然科学版),2013,3:93-95.
[8]师素云,练兴明等.薄荷离体培养愈伤组织诱导与植株分化[J].江苏农业科学,2000,6:27-28.
[9]汪茂斌,马宗新,赵 红,等.薄荷品种提纯途径及程序[J].安徽农业科学,2000,28(2):235-236.
[10]臧玉琦,吴涛等.薄荷茎尖生长点离体培养[J].中国农学通报,1998,1:47-73.

