植入性门静脉主干癌栓兔模型建立及评估
张 雯, 李 说, 颜志平, 罗剑钧, 刘清欣, 瞿旭东, 王建华
肝细胞肝癌(HCC)是临床最常见恶性肿瘤之一,发病率居全球恶性肿瘤第6位,死亡率居第3位[1];在国内的发病率仅次于肺癌占第2位。HCC起病隐匿,发现时通常已无法手术切除。伴有门静脉癌栓(PVTT)患者易并发上消化道出血、顽固性胸腹水等,预后极差,其自然病程仅为2.7~4个月;门静脉主干癌栓(MPVTT)形成是影响HCC患者预后的独立因素[2-3]。
动物模型是研究疾病病理生理机制,评价临床治疗效果及安全性的基础。目前已成功建立HCC动物模型,如Buffalo大鼠HCC模型、新西兰大白兔肝移植VX2肿瘤模型[4]等,但目前仍缺乏可重复地用于病理机制及疗效研究的HCC PVTT动物模型。本实验旨在建立稳定的可用于评估疗效的植入性MPVTT动物模型,并为后续实验研究打下基础。
1 材料与方法
1.1 材料
1.1.1 实验动物与瘤株 本实验已获得复旦大学附属中山医院动物伦理委员会批准。取健康新西兰大白兔27只,体重1.8~2.2 kg,雌雄不限。3只为荷瘤兔,其余随机分为对照组(A组,10只)和实验组(B组,14只)。实验前所有兔均称重。采用VX2瘤株。1.1.2 主要仪器及器械 64排螺旋CT(LightSpeed VCT,美国通用公司)、显微手术器械与普通手术器械包 (我院动物实验室)、5-0/6-0血管缝线(上海浦东金桥医疗器械厂)。
1.2 实验方法
1.2.1 动物麻醉与母瘤建立 常规消毒后,肌内注射氯胺酮-地西泮混合液(按4︰2比例配制,注射量为1.5 ml/kg)麻醉动物。自液氮罐取出VX2瘤株,复苏后PBS液冲洗、离心、弃上清液,加入DMEM高糖培养液稀释,取1 ml注入兔后腿背侧皮下成瘤,2~3周待肿瘤长至直径约2.0 cm时备用。
1.2.2 MPVTT模型建立 荷瘤种兔麻醉后,固定、消毒铺巾,取瘤体近边缘鱼肉样无坏死区。用眼科剪将瘤块修剪成约1.0 mm×1.0 mm×8.0 mm的瘤长条,头端用缝线固定,穿入18 G针头内,浸泡于DMEM培养液,置于冰盒上备用。实验组兔麻醉后,仰卧位固定、消毒铺巾,剑突下逐层开腹,充分显露、游离门静脉主干,置入保护线;用6-0血管缝线在门静脉主干前壁缝直径约2 mm荷包,用已备好的带瘤条注射器经荷包中央将瘤条注入门静脉腔内,然后轻轻提起远端保护线阻断血流、退针,同时收紧荷包并打结,外拉瘤条缝线,确保瘤块固定于门静脉主干内壁;确认无活动性出血后,撤除保护线、关腹(图1)。对照组兔仅开腹,在门静脉主干前壁作2 mm荷包缝合。术后对所有兔连续用抗生素3 d,预防感染。
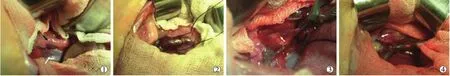
①开腹,暴露门静脉,白箭头为下腔静脉,黑箭头为门静脉,表面有脂肪组织及胰腺组织包绕;②分离门静脉,置入保护线;③门静脉前壁作荷包缝合(白箭头);④将瘤条经荷包中央注入门静脉后收紧荷包并打结(箭头示瘤条预留缝线)图1 MPVTT建模过程
1.2.3 观察指标 观察动物术后精神、活动、进食、大便情况,体重变化及存活期。术后每周行胸腹部CT平扫和增强CT检查,观察MPVTT癌栓生长及转移情况。将数据传至工作站重建,测量癌栓长短径。三维多平面重建(3D-MPR)门静脉,获取门静脉横断位、矢状位及冠状位图像。
1.2.4 大体标本及病理学检查 术后2周CT检查后处死对照组A1、A2号兔和实验组B1~4号兔;术后4周处死对照组A3、A4号兔和实验组B5~8号兔。解剖观察MPVTT与周围脏器关系及转移情况。取癌栓(包括门静脉)、肝脏、部分肺组织,放入4%多聚甲醛溶液固定,送复旦大学医学院病理教研室作病理检查。剩余兔观察生存时间。
1.3 统计学方法
采用SPSS13.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示。
2 结果
2.1 术后动物生物学行为改变及生存时间
所有实验兔手术均成功,无手术相关死亡。对照组兔除了术后第1、2天食欲减退、活动减少外,饮食活动无异常;无消瘦、腹泻及恶液质出现,体重随着随访期延长而增加,A5~10号兔术后第35天平均体重为(2.08±0.17)kg;所有兔生存良好。实验组兔术后第1、2天食欲减退、活动减少,约3周开始出现腹泻、食欲减退、体重下降,约5周出现恶液质,B9~14号兔术后第35天平均体重为(1.48±0.19) kg,生存时间为 35~48 d,平均(41.7±4.7) d。
2.2 影像学检查结果
术后第1周多排螺旋CT检查显示,实验组兔门静脉主干内均见小充盈缺损,成瘤率达100%,瘤栓随时间延长逐渐增大,并出现强化(术后第1周至第5周MPVTT最大横径平均值分别为3.1、5.6、12.5、19.6、40.3 mm)。第3周部分兔门静脉周围侧支循环形成,部分出现肝内转移,癌栓延伸至部分门静脉左右分支;肝内转移灶随时间延长逐渐增大增多,门静脉癌栓向肝内延伸。第5周部分兔出现肺转移,后腹膜及肠系膜淋巴结转移(图2)。对照组兔门静脉主干局部稍狭窄,余未见异常。
2.3 大体标本及组织病理学检查
2.3.1 大体标本 实验组术后第2周,门静脉主干局部稍膨胀,肝内门静脉分支未见癌栓,肝肺未见转移灶。第4周门静脉主干周围粘连,门静脉主干被肿瘤组织占据,明显向外周突出,周围侧支血管形成,门静脉腔内见米黄色癌栓组织,与门静脉管壁粘连,癌栓向门静脉分支延续;肝脏内散在多个大小不等转移结节;自然死亡兔明显恶液质,肝内密布大小不等转移结节,门静脉结构显示不清,肝门巨块肿瘤与周围肝脏、胃壁、肠壁、系膜粘连,并向间隙浸润。5/6兔(83.3%)肉眼可见肺内多发转移结节,3/6兔(50.0%)见血性腹水,2/6兔(33.3%)见肠系膜转移结节,1/6兔(16.7%)见腹壁转移结节(图3)。对照组门静脉局部少许粘连,门静脉主干局部狭窄,余未见异常。
2.3.2 组织病理学表现 实验组术后2周镜下显示门静脉管腔内见巢状形态不规则肿瘤细胞,呈异型性,细胞核深染,大且不规则。部分节段的门静脉内膜上见单层肿瘤细胞黏附,与内皮细胞紧密结合,内皮细胞层保持相对完整。肝组织内有散在小灶状肿瘤细胞分布,肺内未见转移灶。术后第4周,癌栓与门静脉管壁分界不清,紧靠血管面的肿瘤细胞核大,多倍体核多见,排列紊乱;中央区域有坏死。肿瘤细胞侵蚀门脉管壁,破坏门静脉管壁内膜结构,中膜受到肿瘤推挤,部分弹力纤维被肿瘤破坏,紧贴肝实质侧的弹力纤维相对完整,在弹力纤维内可见较多肿瘤细胞形成的癌巢。肝组织内有多个片状肿瘤巢,中央见坏死;肺内散在多灶瘤巢。自然死亡后,门静脉主干结构无法找到,被大量肿瘤组织及坏死组织代替;肝组织被大片肿瘤细胞占据,中央伴大片坏死无结构区;肺内多灶瘤巢,部分中央有坏死(图3)。对照组未见异常。
3 讨论
PVTT是HCC常见病理表现,发生率高达30%~60.2%[5-7],不仅是HCC恶性程度高、易转移、预后差的主要原因,也是提高晚期HCC疗效的重要障碍[8-10]。当PVTT累及门静脉主干,堵塞了肠道血液回流,肝脏缺血和门静脉高压加重,患者多在短期内死于肝功能衰竭或食管胃底静脉破裂出血[9-11]。Okazaki等[12]报道提示,伴有MPVTT的HCC患者5年生存率为0%~6%。
3.1 MPVTT模型建立
目前已建立多种诱发性HCC动物模型,但这些模型的PVTT发生率均不高。Lindsay等[13]曾尝试用致癌剂化学诱导法建立猕猴HCC PVTT模型,实验2.5年后建立首例猕猴HCC模型,10年共建立34例HCC模型,其中14例存在经门静脉系统播散转移,可见静脉内癌栓,癌栓形成率仅为35%(14/40)。这是迄今为止唯一类似人HCC PVTT大型动物模型。然而,由于猕猴属于珍稀动物,价格昂贵,模型操作复杂,制作周期长,这一模型无法得到推广。Genda等[14]报道将高转移性 HCC细胞株 Li7和 KYN-2注入肝实质内,可在血管内形成癌栓,但未发现MPVTT。
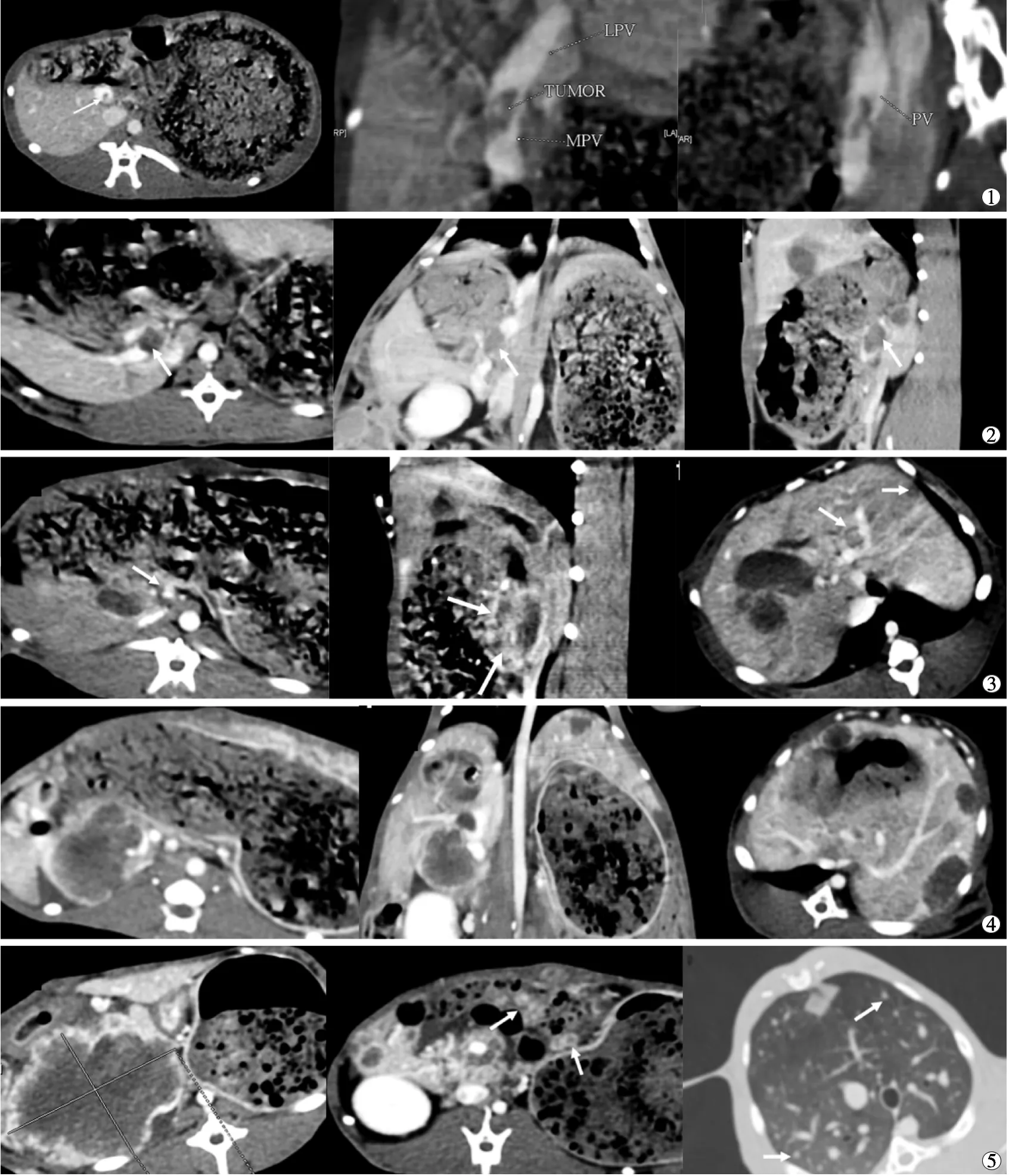
图2 PVTT植入后不同时间多排螺旋CT表现
VX2肿瘤是源于Shope病毒致乳头瘤恶变形成的上皮细胞恶性肿瘤,属于鳞状细胞癌,具有较高的肝、肺转移性,且血供丰富类似于HCC,目前已广泛用于种植性HCC模型实验研究。万智勇等[15-16]采用B超引导穿刺或开腹直接穿刺门静脉,经3 F微导管向门静脉内注射0.5~1.0 mm3VX2肿瘤组织块,门静脉内成瘤率分别为89%和94%。进一步作ABS-丙酮门静脉铸型研究提示,植入性PVTT早期由门静脉小分支供血,后期为肝动脉和门静脉双重供血,这一结果也与人 HCCPVTT血供相符[17-18]。范伟等[19]报道采用开腹切开门静脉主干前壁,通过将VX2肿瘤块缝在血管内壁建立MPVTT模型,成瘤率达100%,但由于是手术缝合,无法避免部分肿瘤组织暴露在门静脉管壁外,因此较早发生门静脉管壁外浸润。
本实验采用开腹门静脉前壁荷包缝合,然后经荷包中央注入VX2瘤条,通过将瘤条悬挂在门脉内壁的方法制作MPVTT模型,成瘤率达到100%;术后4周癌栓仍位于门静脉管腔内生长,且有沿管腔铸型性延伸趋势,避免了上述方法的缺点,较好地模拟癌栓血管内生长方式;实验组兔平均生存期为(41.7±4.72) d,与范伟等[19]的报道基本吻合,但明显低于褚朝顺等[20]报道的VX2肝内移植性肿瘤模型平均生存期(55.56±2.28)d,并且较早发生多发转移。分析其原因,在于瘤条植入在门静脉主干生长,肿瘤细胞不停地脱落并转移,加上3周后门静脉主干完全阻塞引起的门静脉高压等,这也从另一方面印证了MPVTT是HCC易于产生肝内播散病灶、预后极差的主要原因之一[21-22]。
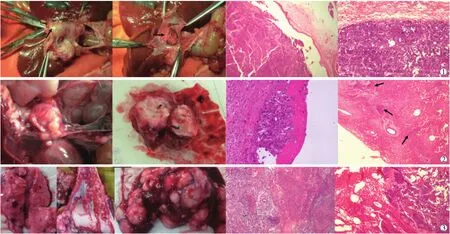
图3 大体标本及病理学检查结果
3.2 影像学评估
目前临床上诊断PVTT主要依靠影像学手段[23-24]。本实验采用增强螺旋CT扫描,在癌栓植入1周检出率(敏感性)就达100%,与2周及4周病理学检查结果对照,准确率(特异性)同样达到100%;3D-MPR能充分显示门静脉主干及一二级分支;不仅如此,CT横断面扫描及3D-MPR结果均可以显出门静脉主干完全阻塞后特有的周围侧支血管建立;随着实验进展,癌栓显示出管腔内膨胀性生长甚至管壁外浸润等特点,这也与临床上CT鉴别癌栓与血栓的结果相符。
3.3 MPVTT生长方式
本实验同样证实悬挂于门静脉血液中的瘤条可以存活并生长形成附壁栓子,这一方面说明肿瘤组织可直接从血液中汲取营养,另一方面也印证了HCC PVTT 形成之“营养学说”[25],即门静脉血液中富含肠道吸收的营养物质,胰腺分泌的胰岛素、胰高糖素等促生长激素促进肿瘤细胞生长,是HCC PVTT好发的原因之一;术后2周内PVTT均无动脉期强化,提示早期癌栓尚无动脉参与供血,当生长超过4周后增强CT检查时出现动脉期癌栓边缘强化,这进一步说明随着PVTT体积增大,动脉同样参与了癌栓供血,这一结果也与文献报道[7,26]相似。
本实验制作的MPVTT模型细胞学类型及生长模式虽与人HCCMPVTT存在差异,但血供类型、肝内播散及门静脉主干闭塞后病理改变等与人HCC MPVTT有许多相似之处,且成瘤率高,因此可用于实验评价不同治疗方法对MPVTT的疗效。
本实验成功建立稳定的可供影像学客观评价的MPVTT动物模型,为进一步评价不同治疗方法对MPVTT的疗效打下基础。结合病理结果,本实验也证实增强多排螺旋CT及3D-MPR对诊断及监测PVTT生长和转移有良好价值。
[1]Llovet JM,Bruix J.Novel advancements in the management of hepatocellular carcinomain 2008[J].JHepatol,2008,48:S20-S37.
[2]Minagawa M,Makuuchi M.Treatment of hepatocellular carcinoma accompanied by portal vein tumor thrombus[J].World J Gastroenterol,2006,12:7561-7567.
[3]Llovet JM,Bustamante J,Castells A,et al.Natural history of untreated nonsurgical hepatocellular carcinoma:Rationale for the design and evaluation of therapeutic trials[J].Hepatology,1999,29:62-67.
[4]Newell P,Villanueva A,Friedman SL,et al.Experimental models of hepatocellular carcinoma[J].JHepatol,2008,48:858-879.
[5]Fujii T,Takayasu K,Muramatsu Y,et al.Hepatocellular carcinoma with portal tumor thrombus:analysis of factors determining prognosis[J].Jpn JClin Oncol,1993,23:105-109.
[6]Esnaola NF,Mirza N,Lauwers GY,et al.Comparison of clinicopathologic characteristics and outcomes after resection in patients with hepatocellular carcinoma treated in the United States,France,and Japan[J].Ann Surg,2003,238:711-719.
[7]Tsai TJ,Chau GY,Lui WY,et al.Clinical significance of microscopic tumor venous invasion in patients with resectable hepatocellular carcinoma[J].Surgery,2000,127:603-608.
[8]刘清欣,颜志平,李 说,等.125I粒子条联合门静脉支架及化疗栓塞治疗原发性肝癌合并门静脉癌栓[J].介入放射学杂志, 2009,18:593-595.
[9]Luo J,Yan Z,Liu Q,et al.Endovascular placement of iodine-125 seed Strand and stent combined with chemoembolization for treatment of hepatocellular carcinoma with tumor thrombus in main portal vein[J].JVasc Interv Radiol,2011,22:479-489.
[10]宁海波,刘 哲,卢海明,等.手术切除与射频消融对原发性肝癌合并Ⅰ型门静脉癌栓的临床疗效观察[J].中华肝胆外科杂志,2013,19:593-596.
[11]Yeh JL,Peng YC,Tung CF,et al.Clinical predictors of large esophagogastric varices in patients with hepatocellular carcinoma[J].Dig Dis Sci,2002,47:723-729.
[12]Okagaki M,Higaohihara H,Shinjo H.Chemoemboligation [A].In:Livraghi T,Makwuchi M,Buscarini L,eds.Diagnosis and Treatment of Hepatocellular Carcinoma[M].London:Greenwich Medical Media,1997:307-326.
[13]Lindsay CK,Sinha CC,Thorgeirsson UP.Morphological study of vascular dissemination in a metastatic hepatocellular carcinoma model in the monkey[J].Hepatology,1997,26:1209-1215.
[14]Genda T,Sakamoto M,Ichida T,et al.Cell motility mediated by Rho and Rho-associated protein kinase plays a critical role in intrahepatic metastasis of human hepatocellular carcinoma [J].Hepatology,1999,30:1027-1036.
[15]万智勇,冯敢生,余宏建.兔移植性肝癌伴门静脉癌栓模型的制作[J].临床放射学杂志, 2003, 22: 517-520.
[16]万智勇,冯敢生,梁惠民,等.兔移植性肝癌门静脉癌栓的微血管结构与血供[J].中国医学影像技术,2005,21:187-190.
[17]Saftoiu A,Ciurea T,Gorunescu F.Hepatic arterial blood flow in large hepatocellular carcinoma with or without portal vein thrombosis: assessment by transcutaneous duplex Doppler sonography[J].Eur JGastroenterol Hepatol,2002,14:167-176.
[18]Llovet JM,Bustamante J,Castells A,et al.Natural history of untreated nonsurgical hepatocellular carcinoma:rationale for the design and evaluation of therapeutic trials[J].Hepatology,1999,29:62-67.
[19]范 伟,罗世樵,李崇燕,等.兔移植性门静脉癌栓模型的建立及生物学特性[J].现代医药卫生, 2005, 21: 1626-1628.
[20]褚朝顺,苗 毅,奚春华,等.兔局限性肝肿瘤模型的建立[J].肝胆外科杂志, 2004, 12: 381-382.
[21]Zhou L,Rui JA,Wang SB,et al.Risk factors of microvascular invasion,portal vein tumor thrombosis and poor post-resectional survival in HBV-related hepatocellular carcinoma[J].Hepatogastroenterology,2014,61:1696-1703.
[22]Cha C,Fong Y,Jarnagin WR,et al.Predictors and patterns of recurrence after resection of hepatocellular carcinoma[J].J Am Coll Surg,2003,197:753-758.
[23]Lencioni R,Caramella D,Sanguinetti F,et al.Portal vein thrombosis after percutaneous ethanol injection for hepatocellular carcinoma:value of color Doppler sonography in distinguishing chemical and tumor thrombi[J].AJR Am J Roentgenol,1995,164:1125-1130.
[24]Tublin ME,Dodd GD 3rd,Baron RL.Benign and malignant portal vein thrombosis:differentiation by CT characteristics[J].AJR Am JRoentgenol,1997,168:719-723.
[25]李哲夫,陈孝平.原发性肝癌并发门静脉癌栓的研究进展[J].齐鲁医学杂志,2008,23:182-186.
[26]Uraki J,Yamakado K,Nakatsuka A,et al.Transcatheter hepatic arterial chemoembolization for hepatocellular carcinoma invading the portal veins:therapeutic effects and prognostic factors[J].Eur JRadiol,2004,51:12-18.

