抗原负载DC-CIK细胞治疗晚期视网膜母细胞瘤的疗效及其安全性
常晓雯,王 军,孙岩峰,苗丽霞,袁海莲,刘红艳,李彦珊,杨新吉,张向兰,刘秋玲,
抗原负载DC-CIK细胞治疗晚期视网膜母细胞瘤的疗效及其安全性
常晓雯1,王 军2,孙岩峰2,苗丽霞2,袁海莲2,刘红艳2,李彦珊2,杨新吉3,张向兰2,刘秋玲1,2
目的 观察抗原负载的树突状细胞(dendritic cell, DC)与细胞因子诱导的杀伤细胞(cytokine induced killer, CIK)共培养 (Ag-DC-CIK)细胞对晚期视网膜母细胞瘤(retinoblastoma, RB)的疗效及其安全性。方法 收集武警总医院2011-01至2014-01确诊为晚期RB的26例患儿资料,其中13例采用Ag-DC-CIK细胞回输联合常规治疗方案治疗(联合组);其余13例仅采用常规治疗方案治疗(常规组)。对比分析两组患儿资料,观察Ag-DC-CIK细胞治疗的疗效及安全性。结果 联合组患儿共接受67疗程134次Ag-DC-CIK细胞治疗。联合组2例D期患儿均获保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿2例获手术机会;常规组2例D期患儿均未获保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿仅1例获手术机会。联合组治疗后外周血中CD3+、CD4+、CD4+/CD8+、CD3+CD56+T淋巴细胞比例较治疗前明显升高(均P<0.05),CD8+T淋巴细胞比例较治疗前明显降低(P<0.05);常规组治疗前后外周血中上述细胞比例均无明显变化。在细胞回输过程中,仅1例次出现发热,体温37.8 ℃,未经处理恢复正常。所有患儿的血生化、肝肾功能及心电图在细胞治疗后与常规组比较,均差异无统计学意义。结论 Ag-DC-CIK细胞治疗晚期RB安全、有效。
细胞因子诱导的杀伤细胞;树突状细胞;视网膜母细胞瘤;化疗;安全性
视网膜母细胞瘤(retinoblastoma,RB)是婴幼儿时期最常见的眼内恶性肿瘤。目前,RB的治疗采用以化学减容治疗及局部治疗为主,联合手术、放射治疗的综合性疗法。但对于晚期RB患儿,单纯化学药物治疗(简称化疗)往往难以控制病情,而局部治疗又不是其适应证。而且,随着化疗时间的延长,化疗的疗效明显降低,长期化疗还会引起骨髓抑制、耳毒性、肾毒性等不良反应,并可能继发第二肿瘤,大剂量化疗还会导致肿瘤的多药耐药。因此,寻找一种安全、有效的治疗方法,辅助化疗及局部治疗,挽救晚期患儿的生命及视力,已经成为我国RB治疗中亟待解决的问题。
近年来,以DC和CIK为基础的肿瘤细胞免疫治疗越来越多地应用于临床。并且证实二者具有协同作用,共同培养后其抗肿瘤作用明显增强[1,2]。用负载肿瘤抗原的DC与CIK(Ag-DC-CIK)细胞联合应用,不仅能够刺激机体产生针对这一抗原的细胞毒T淋巴细胞(cytotoxic lymphocyte, CTL),特异性杀伤含有这些肿瘤抗原的肿瘤细胞,而且能增加CIK细胞的扩增数量及特异杀伤作用。目前,仅见部分Ag-DC-CIK细胞治疗成人肿瘤的临床报道[3]。笔者主要分析Ag-DC-CIK细胞治疗晚期RB的疗效及其安全性。
1 对象与方法
1.1 对象 选择武警总医院2011-01至2014-01确诊为晚期RB的住院患儿,共计26例。其中13例采用Ag-DC-CIK细胞回输联合常规治疗方案治疗(联合组);另外13例仅采用常规治疗方案治疗(常规组)。常规组联合应用化疗及手术治疗,联合组在常规治疗基础上加用Ag-DC-CIK细胞治疗。两组患儿的基本情况见表1。全部患儿治疗前1个月均未行抗肿瘤治疗且未使用免疫增强药物,开始治疗前患儿心电图、心肌酶、肝肾功能、血常规均无明显异常。本治疗经医院伦理委员会审查批准,治疗前均取得患儿监护人同意并签署知情同意书。
诊断标准:眼外期患儿根据临床表现、眼眶增强核磁共振/CT诊断,眼内期患儿尚需结合眼底检查、眼部B超诊断,行手术治疗的患儿根据术后病理确诊。全部患儿进行脑脊液、骨髓细胞学、全身骨扫描检查后明确分期。
分期标准:眼内分期采用IIRC法[4];术后病理显示肿瘤已侵犯球外视神经、筛板或CT/MRI等影像学检查肿瘤已侵犯眼球外视为眼外期;CT/MRI检查、脑脊液、骨髓细胞学、全身骨扫描检查提示远处组织或器官受累均视为远处转移期。分期为眼内D期、E期、眼外期、远处转移期的患儿,以及复发RB患儿均视为晚期病例。疾病分期以一只眼纳入统计,双眼发病者以分期较重眼纳入。
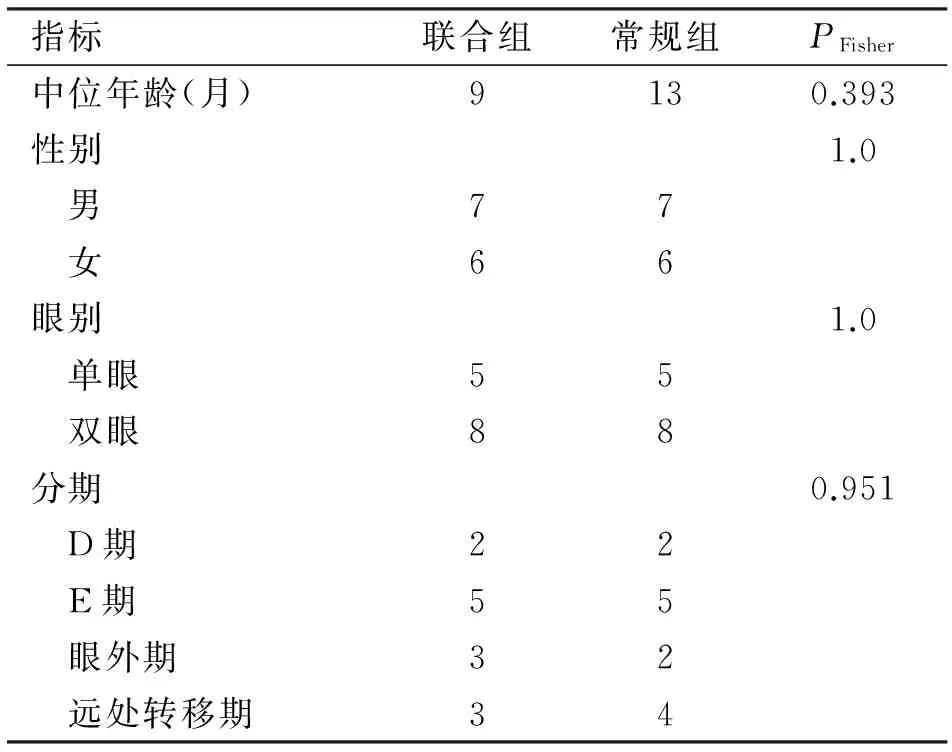
表1 两组晚期视网膜母细胞瘤患儿一般资料 (n=13)
1.2 方法
1.2.1 细胞制备 联合组患儿依据体重于化疗前1 d抽取静脉血10~35 ml,肝素抗凝后送实验室,无菌条件下分离并收集单个核细胞,在多种细胞因子(GM-CSF、IL-4、10%自体血浆的Alys-505)的培养液中进行培养扩增,按肿瘤细胞与DC比例为3∶1,加入Y79冻融抗原,第6天加入TNF-α促进DC成熟,第7天收获Y79冻融抗致敏的成熟DC细胞,第8天收获成熟的CIK细胞。将制备成熟的Ag-DC细胞与CIK细胞共培养(DC与CIK数量比为1∶10),每两天补充0.5%的自体血浆、1000 U/ml IL-2、100 ng/ml GM-CSF的Alys-505培养液,第5~7天收获Ag-DC-CIK细胞备用。
1.2.2 细胞回输 经细菌、真菌、支原体、内毒素及细胞活性检测合格后,于化疗开始第14天静脉隔日分2次回输给患儿,每次回输前30 min给予抗过敏处理,21 d为一疗程。
1.2.3 常规治疗方案 均应用VEC方案化疗(长春新碱1.5 mg/m2,第1天;依托泊苷150 mg/m2,第1、3天;卡铂560 mg/m2,第1天)。其中眼内D、E期给予6~8疗程化疗,眼外期、远处转移期患儿根据病情变化延长至9~12疗程。E期以上患儿根据患儿肿瘤控制情况及全身情况,行眼球摘除术或眶内容物剜除术,术后第10天继续常规化疗。D期患儿先给予2~3周期化疗观察疗效,根据病情决定眼摘或继续保眼化疗,眼摘者术后根据病理决定化疗周期。
1.2.4 疗效和安全性评价
1.2.4.1 D期患儿保眼情况及眼外期、远处转移期患儿手术情况 眼内期患儿每周期治疗前均行眼底镜、眼部超声检查,每2个疗程结束或临床症状示疾病进展时行眼眶增强CT/MRI检查,必要时行全身骨扫、PET/CT检查。根据病情变化决定是否手术治疗,随访结束时,观察眼内D期患儿保眼及眼外期、远处转移期患儿获手术机会情况。
1.2.4.2 生存情况 通过电话长期随访,全部病例随访至2014-12-31,记录两组患儿的总生存期(overall survival, OS)。治疗结束完全停药后,患儿定期回院接受全面复查,明确肿瘤有无复发、转移。复查时间为:治疗结束后3个月内每月复查1次;如无复发或进展,可延长复查时间至每3个月1次,连续3次;后延长至6个月1次,连续2次;最后延长至1年1次,总随访时间为5年。绘制两组患儿的生存曲线,比较两组患儿生存时间变化。
1.2.4.3 外周血T淋巴细胞亚群检测 联合组患儿治疗前1 d及治疗结束后1周采集外周血2 ml,以肝素抗凝后24 h内送检,采用流式细胞术检测外周血T淋巴细胞亚群。
1.2.4.4 对化疗耐受力的改变 观察两组患儿治疗后外周血三系变化及恶心呕吐发生情况。不良反应分为基本耐受及难以耐受两级,每疗程前后均进行评价,每疗程中发生1次外周血三系任意一系降低或发生恶心、呕吐即视为异常,至随访结束时,统计整个治疗过程中异常情况出现的次数,并将两组数据进行统计分析。对于外周血三系变化,基本耐受指低于正常值下限,高于需进行输注红细胞、血小板、注射粒细胞刺激因子的上限,其中输注悬浮红细胞上限为血红蛋白低于60 g/L,输注血小板上限为血小板低于20×109/L,注射粒细胞刺激因子上限为中性粒细胞绝对值低于0.5×109/L;难以耐受指外周血三系严重降低,有严重的贫血及发生出血、感染的可能,需输注红细胞、血小板、注射粒细胞刺激因子治疗,并进行严密观察。对于恶心呕吐情况,基本耐受指每日恶心呕吐次数不多于3次,可以少量进食,无水、电解质、酸碱平衡紊乱;难以耐受指每日恶心呕吐次数超过3次或进食后即恶心呕吐,随时可能或已经存在水、电解质、酸碱平衡紊乱,需补液治疗并进行严密观察。
1.2.4.5 安全性评价 每个疗程前后均行血常规、血生化、肝肾功能及心电图检查。随访结束时统计其发生的次数,并进行统计分析。每次细胞回输过程中监测生命体征,每次细胞回输前后半小时检测体温变化,发生不良反应随时记录。

2 结 果
2.1 近期疗效 联合组患儿共接受67疗程134次Ag-DC-CIK细胞治疗。最少2个疗程,最多10个疗程。回输细胞数(5~60)×109/L,平均27.3×109/L。回输时间4.0~8.5 h,平均5.8 h。
2.1.1 D期患儿保眼情况及眼外期、远处转移期患儿手术情况 联合组D期2例均获保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿中2例获手术机会。常规组D期2例均未获得保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿中仅1例获手术机会。
2.1.2 生存情况 联合组随访时间4~35个月,平均23.31个月;常规组随访时间10~39月,平均23.54个月。无失访病例,联合组中3例在随访过程中死亡,4例因家属放弃治疗后死亡,其余随访均存活。常规组中3例在随访过程中死亡,5例因家属放弃治疗后死亡,其余均存活。两组患儿总生存情况见图1,其中联合组患儿1年生存率为92.3%;常规组为84.6%,两组比较,差异无统计学意义(P=0.8421)。
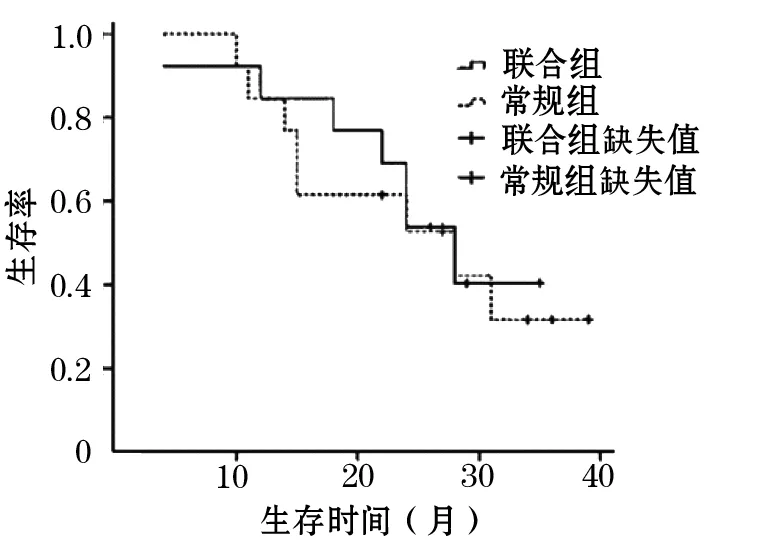
图1 两组视网膜母细胞瘤患儿生存曲线
2.1.3 治疗前后T淋巴细胞亚群的改变 两组治疗前外周血中T淋巴细胞比例均无统计学差异。联合组治疗后外周血中CD3+、CD4+、CD4+/CD8+、CD3+CD56+T淋巴细胞比例较治疗前升高(均P<0.05);联合组治疗后外周血中CD8+T淋巴细胞比例较治疗前明显降低(P<0.05);常规组治疗后外周血中CD3+、CD4+、CD4+/CD8+、CD3+CD56+、CD8+T淋巴细胞比例变化均无统计学差异(表2)。

表2 两组视网膜母细胞瘤患儿治疗前后外周血免疫细胞比较 (n=13;±s)
注:与治疗前比较,①P<0.05;与常规组比较,②P<0.05
2.1.4 对化疗耐受力改变 联合组患儿在化疗后中性粒细胞、血红蛋白、血小板减少及恶心呕吐情况较常规组明显减轻,且差异有统计学意义(均P<0.05,表3)。
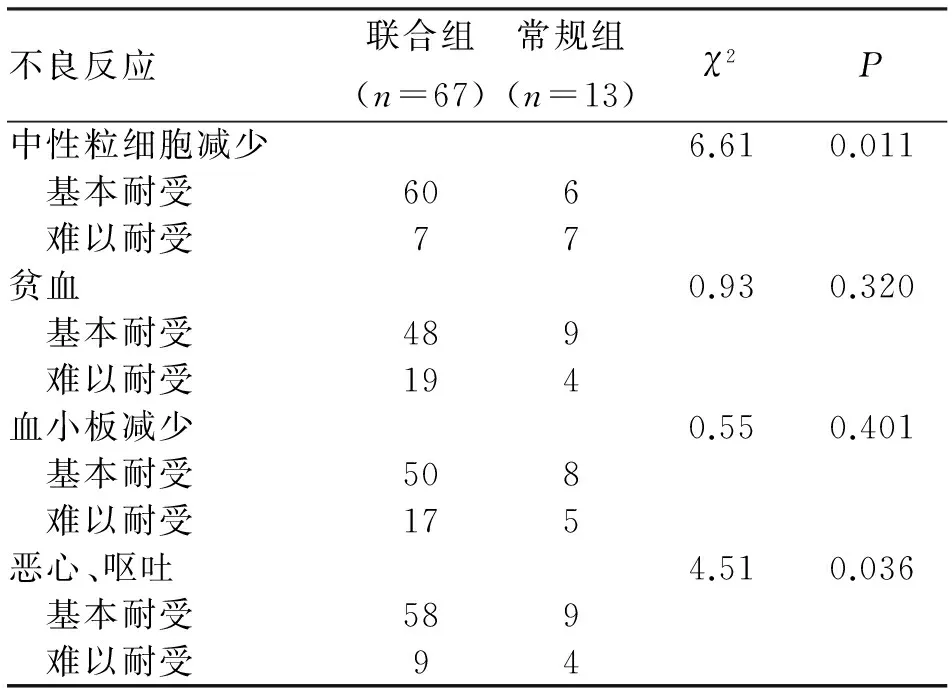
表3 两组视网膜母细胞瘤患儿化疗后常见不良反应发生情况
2.2 安全性评价 联合组患儿在细胞回输过程中及回输后,仅1例出现短暂发热,体温37.8 ℃,可自行降至正常,无严重不良反应。所有患儿的血生化、肝功能及心电图在细胞治疗后与常规组比较差异均无统计学意义(表4),两组患儿治疗后均未出现肾功能损害。
表4 两组患儿治疗后生化及心电图异常人数的比较 (n=13)
3 讨 论
近年来,随着治疗技术的不断发展,以化学治疗联合放疗、局部治疗的综合治疗方法大大改善了RB患儿的预后,使其生存率获得了明显提高。但是,由于长期化疗存在严重的不良反应,随着化疗时间的延长,患儿机体耐受力降低,加之长期化疗造成肿瘤多药耐药的发生,晚期RB患儿的预后仍然较差。
肿瘤生物治疗因具有高效、低毒的特点,越来越多地受到研究者的重视[5,6]。本课题组的前期细胞水平试验证明Ag-DC-CIK较CIK及DC-CIK对RB细胞有更好的杀瘤效果,并且其与化疗具有协同作用[7,8]。目前,免疫细胞治疗多用于肿瘤负荷降低后,配合常规治疗方法使用,能够有效杀灭肿瘤残留病灶[9]。但也有研究显示,免疫细胞治疗在最初配合常规治疗尤其是化疗,可以改善患者的预后、提高其生存质量、缩短化疗的周期、与化疗具有协同作用[10,11]。
本组资料中,联合组D期2例患儿均获保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿2例获手术机会;常规组D期2例患儿均未获得保眼机会,初诊时无手术机会的4例眼外期、远处转移期患儿仅1例获手术机会。表明Ag-DC-CIK细胞治疗可以为晚期患儿争得手术机会,对于D期患儿可能提高其保眼治疗的概率。
本研究中,联合组2例在随访过程中死亡,3例因家属放弃治疗后死亡,8例均存活。常规组中3例死亡,4例因家属放弃治疗后死亡,6例均存活。Ag-DC-CIK细胞治疗费用昂贵,家属难以按照疗程坚持治疗,加之部分患儿病情加重后家属放弃治疗,造成病死率仍较高,细胞治疗的疗效难以完全显现。其次,Ag-DC-CIK细胞为终末期细胞,对于肿瘤负荷大的晚期患者,其疗效也很有限。
联合组患儿在治疗后外周血中参与免疫调节、监视、杀伤靶细胞的CD3+、CD4+、CD4+/ CD8+、CD3+CD56+T淋巴细胞比例较治疗前明显升高,而参与免疫抑制的CD8+T淋巴细胞比值明显降低。而常规组治疗前后外周血中各免疫细胞均无明显变化。证明常规治疗联合Ag-DC-CIK细胞治疗可以增强患儿的免疫功能,提高机体抗肿瘤的能力。这与成人肿瘤的研究结果相似[12]。
联合组患儿在细胞回输过程中及回输后,仅1例次出现短暂发热,体温37.8 ℃,可自行降至正常,没有发生其他严重不良反应。所有患儿的血生化、肝肾功能及心电图在细胞治疗后与常规组相比未见明显变化,提示Ag-DC-CIK细胞治疗安全性良好。
综上所述,本研究将Ag-DC-CIK联合常规治疗应用于晚期RB患儿,不仅具有较好的安全性,而且有效改善了患儿的免疫功能,增强了患儿对化疗的耐受能力,降低了化疗的不良反应。但其所激发的免疫应答能维持多长时间,其对D期患儿保眼情况及眼外期、远处转移期患儿提供手术机会的概率有多大,均需要扩大样本含量,延长观察时间进行长期随访来进一步观察总结。由于细胞治疗费用昂贵,患儿及其家庭难以坚持应用,加之病例样本较小,因此,很难判断Ag-DC-CIK细胞治疗能否改善患儿的预后。
[1] Zhan H L, Gao X, Pu X Y,etal. A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokine-induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma [J]. Chin Med J (Engl), 2012, 125(21):3771-3777.
[2] Yang L, Ren B, Li H,etal. Enhanced antitumor effects of DC-activated CIKs to chemotherapy treatment in a single cohort of advanced non-small-cell lung cancer patients [J]. Cancer Immunol Immunother, 2013, 62(1): 65-73.
[3] 苏 毅,易 海,范方毅,等.荷载自体白血病抗原的DC-CIK细胞预防急性髓细胞性白血病自体造血干细胞移植后复发的临床研究[J].中国输血杂志,2010,23(12):1024-1028.
[4] Linn Murphree A. Intraocular retinoblastoma: the case for a new group classification [J]. Ophthalmol Clin North Am, 2005, 18(1): 41-53.
[5] Chen R, Deng X, Wu H,etal. Combined immunotherapy with dendritic cells and cytokine-induced killer cells for malignant tumors: a systematic review and meta-analysis [J]. Int Immunopharmacol, 2014, 22(2): 451-464.
[6] Jkel C E,Hauser S,Rogenhofer S,etal.Clinical studies applying cytokine-induced killer cells for the treatment of renal cell carcinoma [J]. Clin Dev Immunol, 2012,2012: 1-7.
[7] Wang Y F, Kunda P E, Lin J W,etal. Cytokine-induced killer cells co-cultured with complete tumor antigen-loaded dendritic cells, have enhanced selective cytotoxicity on carboplatin-resistant retinoblastoma cells [J]. Oncol Rep, 2013, 29(5): 1841-1850.
[8] Liu Q, Wang Y, Wang H,etal. Tandem therapy for retinoblastoma: immunotherapy and chemotherapy enhance cytotoxicity on retinoblastoma by increasing apoptosis [J]. J Cancer Res Clin Oncol, 2013, 139(8): 1357-1372.
[9] 刘清池,张慧敏,张玉娜,等. DC-CIK细胞清除微小残留白血病的临床研究[J].中国肿瘤生物治疗杂志,2013,20(4): 398-403.
[10] Ren J, Di L, Song G,etal. Selections of appropriate regimen of high-dose chemotherapy combined with adoptive cellular therapy with dendritic and cytokine-induced killer cells improved progression-free and overall survival in patients with metastatic breast cancer: reargument of such contentious therapeutic preferences [J]. Clin Transl Oncol, 2013, 15(10): 780-788.
[11] 张俊萍,毛光华,史天良,等.DC-CIK联合化疗治疗晚期非小细胞肺癌的临床疗效[J].中国肿瘤生物治疗杂志,2011,18(4): 424-429.
[12] 龚 奕,陈幸华,张 曦,等.急性髓细胞白血病患者DC-CIK治疗后T细胞亚群动态变化的临床观察[J].2012,25(2):112-114.
(2015-03-02收稿 2015-05-19修回)
(责任编辑 武建虎)
Efficacy and safety of co-cultured autologous tumor antigen-loaded dendritic cells and cytokine-induced killer cells combined with routine therapy in the treatment of advanced retinoblastoma
CHANG Xiaowen1, WANG Jun2, SUN Yanfeng2, MIAO Lixia2, YUAN Hailian2, LIU Hongyan2, LI Yanshan2, YANG Xinji3, ZHANG Xianglan2, and LIU Qiuling1, 2.
1.Graduate School of Anhui Medical University, Hefei 230032, China; 2. Department of Pediatrics, 3. Department of Orbital Disease Research Institute,the General Hospital of the Chinese People’s Armed Police Forces, Beijing 100039, China
Objective To evaluate the clinical efficacy and safety of co-cultured autologous tumor antigen-loaded dendritic cells (DC) and cytokine-induced killer cells (CIK) (Ag-DC-CIK) combined with routine therapy in the treatment of advanced retinoblastoma (RB). Methods 26 patients suffering from RB who were diagnosed as advanced RB in the General Hospital of the Chinese People’s Armed Police Forces between December 2011 and December 2014. 13 patients received Ag-DC-CIK combined with routine treatment (combination group). The other patients received routine therapy (routine group). Results The combination group totally received 67 cycles (134 times) Ag-DC-CIK therapy. At the end of the follow-up, all patients in combination group who suffered D got the opportunity of reserving eyes; 2 out of 4 patients who lost the opportunity of operation had surgery eventually. All the group D patients of routine group underwent enucleation. 1 out of 4 patients who lost the opportunity of operation had surgery eventually. CD3+, CD4+, CD4+/CD8+and CD3+CD56+proportion in the combination group was higher than in another group, CD8+proportion in the combination group was lower than in the routine group, and the difference was statistically significant (P<0.05). Only one patient had a fever (37.8 ℃) during the therapy, and could return to normal itself. Both groups of patients’ hepatorenal function, blood biochemistry and ECG had no statistically significant differences. Conclusions Ag-DC-CIK combined with routine therapy in the treatment of advanced RB is efficient and safe.
cytokine-induced killer cells; dendritic cells; retinoblastoma; chemotherapy; safety
首都特色临床应用研究(Z121107001012055)
常晓雯,硕士研究生,E-mail:cxwgxdy@163.com
1.230032 合肥,安徽医科大学研究生学院;100039 北京,武警总医院:2.儿科,3.眼眶病研究所
刘秋玲,E-mail:wj670@vip.sina.com
739.7

