某医院2011-2014年临床分离革兰阴性杆菌分布及耐药性分析
黄永高,陈然峰,孙 龙
某医院2011-2014年临床分离革兰阴性杆菌分布及耐药性分析
黄永高,陈然峰,孙 龙
目的 探讨医院感染革兰阴性杆菌的种类分布及耐药现状,为临床控制感染、合理使用抗生素提供科学依据。 方法 收集我院2011-01至2014-12临床住院患者送检标本,进行细菌鉴定和耐药性分析。结果 连续4年临床分离非重复革兰阴性杆菌共12 437株,肠杆菌科细菌6243株,占50.2%;非发酵菌5920株,占47.6%。主要检出菌中不动杆菌属2626株,占21.1%;铜绿假单胞菌2412株,占19.4%;肺炎克雷伯菌2093株,占16.8%;大肠埃希氏菌1049株,占8.5%。临床标本来源以呼吸道为主,其次为泌尿系统;脑外康复科以及ICU为感染高危科室。连续4年多重耐药细菌监测发现产ESBLs大肠埃希菌、肺炎克雷伯菌分别为(64.9%、64.3%、62.1%、55.4%)、(50.1%、47.7%、43.4%、45.7%)均呈现下降趋势。碳青霉烯类耐药大肠埃希杆菌、肺炎克雷伯菌分别为(0.8%、1.5%、1.3%、2.6%)、(17.4%、30.8%、27.1%、34.1%),呈逐年上升趋势。广泛耐药不动杆菌属4年平均检出率为40.3%。结论 临床分离病原菌以革兰阴性杆菌为主,多重耐药细菌上升趋势明显;医院应合理规范使用抗生素,减少耐药菌产生。同时,应加强细菌耐药监测,重视感染患者的隔离及护理,预防多重耐药菌导致的医院感染暴发流行。
细菌耐药监测;革兰阴性杆菌;多重耐药菌;药敏试验;碳青霉烯酶
革兰阴性杆菌为医院感染的主要病原菌。由于不同地区抗菌药物使用情况不同,细菌耐药性也有较大差异。及时准确地掌握医院病原菌流行情况及耐药趋势,有利于指导临床合理用药。为此,笔者连续4年对本院住院患者革兰阴性杆菌病原菌分布情况及药物敏感性进行回顾性分析。
1 材料与方法
1.1 材料 收集我院2011-01至2014-12住院患者送检各类临床标本中分离的革兰阴性杆菌,并剔除同一患者同一部位重复菌株。标本采集及菌种鉴定按照《全国临床检验操作规程》第3版进行[1]。
1.2 方法
1.2.1 细菌鉴定和药敏试验 细菌分离纯化后按要求配制成0.5麦氏菌悬液,用美国BD Phoenix 100全自动细菌鉴定药敏分析仪完成细菌鉴定及药敏分析。补充药敏试验采用K-B药敏纸片法,血培养仪为美国BD BACTEC9240。药敏纸片及MH干粉均为Oxoid 产品。
1.2.2 细菌耐药检测 按临床实验室标准化学会(Dinical and Laboratory Standards Institute,CLSI)推荐的纸片筛选法和双纸片确证试验检测大肠埃希杆菌、肺炎克雷伯菌、奇异变形杆菌产超广谱β内酰胺酶(ESBLs)。碳青霉烯类耐药肠杆菌科细菌(carbapenem-resistant enterobacteriaceae,CRE)定义为对亚胺培南、美罗培南或厄他培南任一种药物耐药者。广泛耐药菌株(extremely-drug resistant, XDR)定义为对除黏菌素和替加环素外其他抗菌药物全耐药者[2]。
1.2.3 质控菌株 以大肠埃希杆菌ATCC 25922、铜绿假单胞菌ATCC 27853和肺炎克雷伯菌ATCC 700603作为质控对照,药敏结果参照2013年CLSI推荐标准判读[3]。
1.3 统计学处理 细菌药敏资料统计采用世界卫生组织(WHO)推荐WHONET5.4 软件完成。
2 结 果
2.1 病原菌种类及来源分布 我院近4年住院患者标本中共分离非重复革兰阴性杆菌12 437株,其中肠杆菌科细菌6243株,占50.2%,非发酵菌5920株,占47.6%。连续4年细菌检出排名基本相同分别为不动杆菌属21.1%,铜绿假单胞菌19.4%,肺炎克雷伯菌16.8%,大肠埃希杆菌8.5%(表1)。菌株来源分布以痰液等呼吸道标本为主,具体分布:痰液5590株(44.9%),咽拭子1441株(11.6%),尿液2547株(20.5%),血液1178株(9.5%)(表2)。

表1 某医院2011-2014年分离12 437株革兰阴性杆菌构成情况
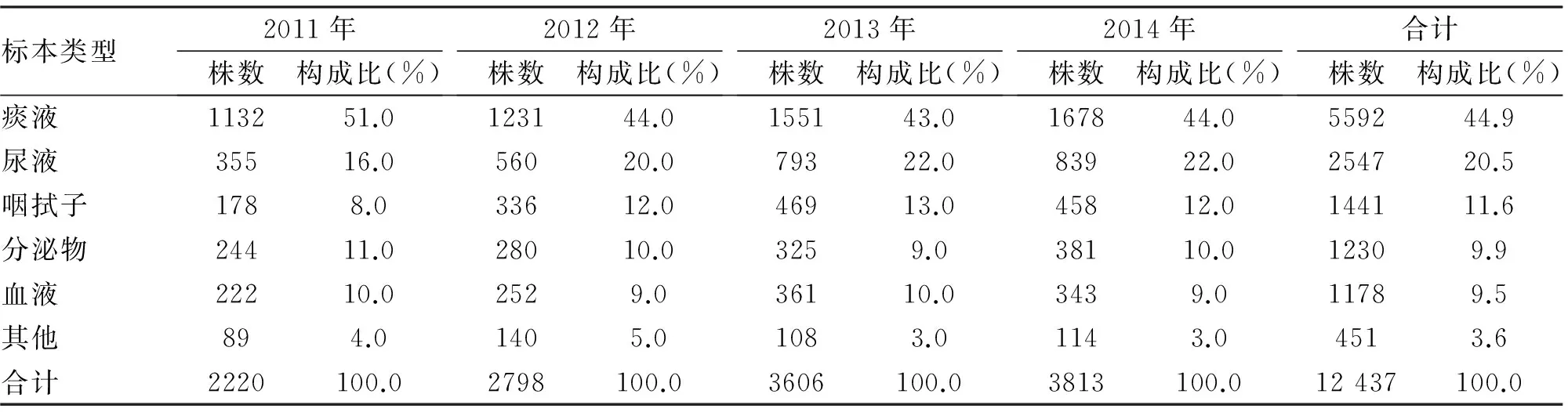
表2 某医院2011-2014年12 437株细菌在各类临床标本中的分布及构成情况


表3 某医院2011-2014年主要肠杆菌科细菌对抗菌药物的耐药率 (%)
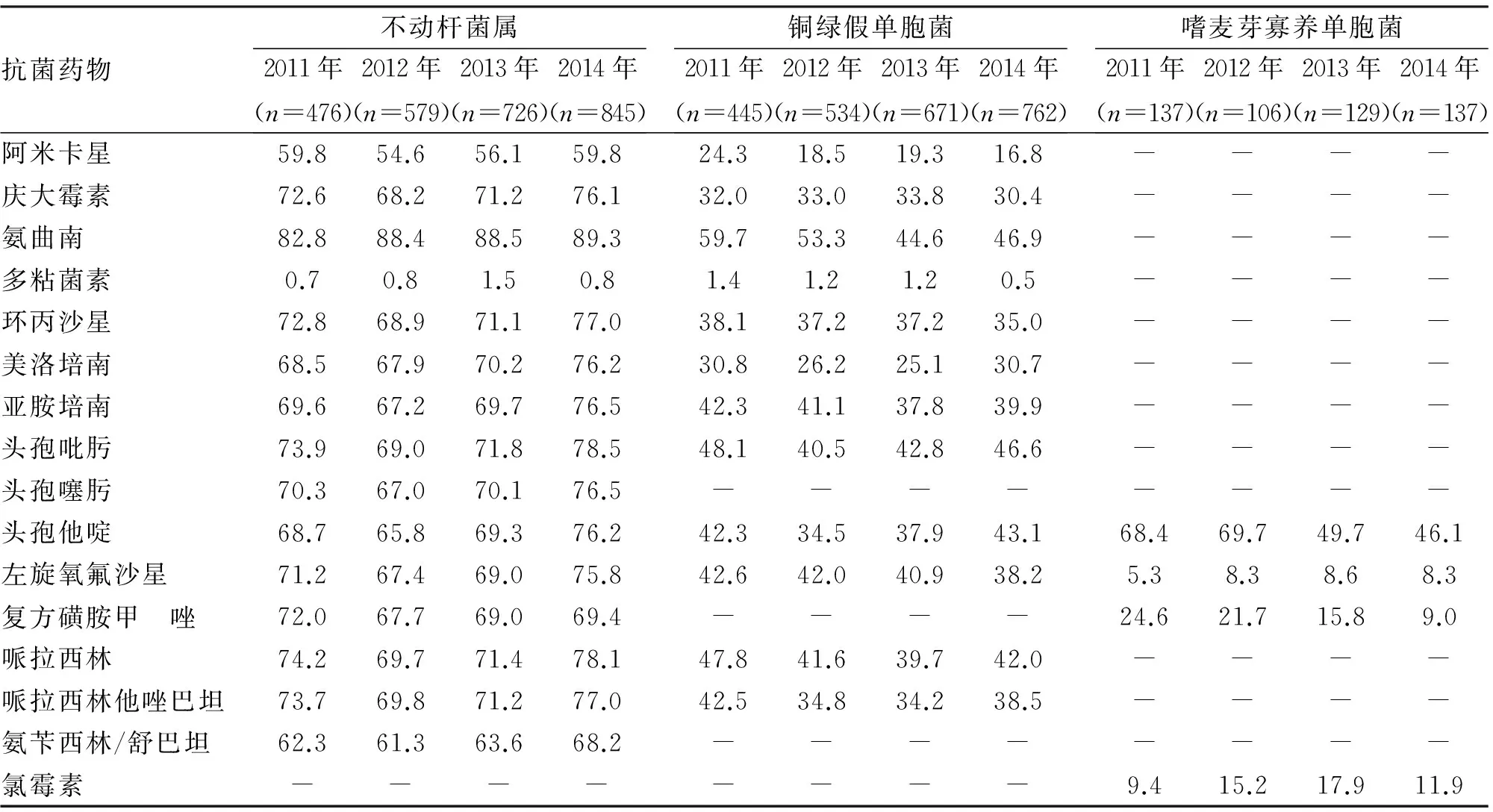
表4 某医院2011-2014年主要非发酵菌对抗菌药物的耐药率 (%)
2.3 多重耐药革兰阴性杆菌检测 连续4年监测产ESBLs肺炎克雷伯菌、大肠埃希氏菌,2011年最高分别为50.1%和64.9%以后呈逐年递减趋势,变形杆菌最高为27.2%呈逐年上升趋势(表5)。耐碳青霉烯类肠杆菌科细菌(CRE)肺炎克雷伯菌、大肠埃希杆菌检出率最高分别为34.1%、2.6%,上升趋势明显。革兰阴性杆菌中对全部测试的抗菌药物(除多黏菌素和替加环素外)均耐药的XDR株主要存在于肺炎克雷伯菌、铜绿假单胞菌和不动杆菌中,其中XDR不动杆菌40%检出率维持在较高水平高于CHINET细菌耐药性监测[4,5],XDR肺炎克雷伯菌检出率平均为1.6%,XDR铜绿假单胞菌呈逐年下降趋势(表6)。
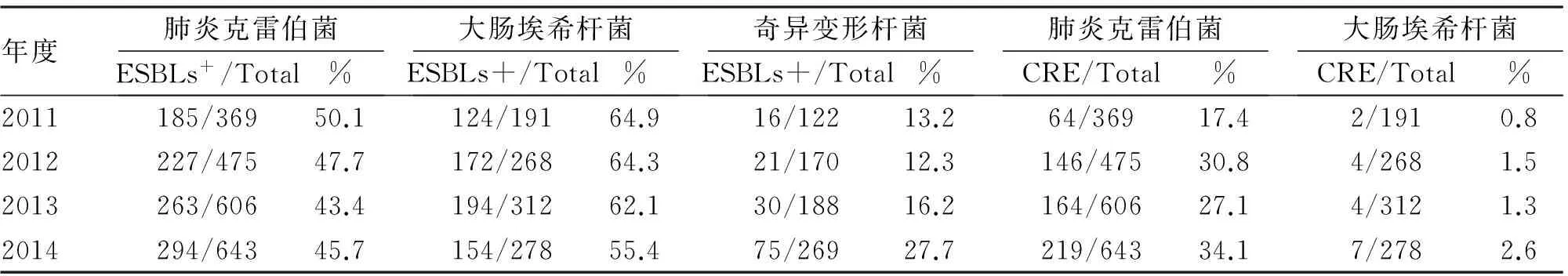
表5 某医院2011-2014年产ESBLs肠杆菌及碳青霉烯耐药肠杆菌检出情况
注:由于变形杆菌对亚胺培南自动化仪器法与纸片法耐药率存在一定差异未统计。

表6 某医院2011-2014年广泛耐药阴性杆菌的检出情况
3 讨 论
从2011-2014年统计数据中分析,临床分离阳性菌株标本主要以呼吸道标本为主占54%,超过多数医院30%~40%送检比例[2]。其原因可能是我院以脑外伤康复患者为主,占全院病员50%,这部分患者中又以气管切开、插管、长期住院、免疫力低下患者多见,气管切开破坏呼吸道原有结构、插管又极易导致耐药菌定植,以上均为肺部感染危险因素[6-7]。同时,痰液等呼吸道标本较易获得,临床送检率高。但呼吸道标本致病菌判断不能简单通过痰液定量培养来判断,应结合患者体征、痰涂片、肺部影像学资料、PCT、CRP等感染指标综合判断。
连续4年的细菌耐药监测提示,我院病原菌分布变化不大,但病原菌抗生素耐药率较高,多重耐药菌检出率高。肠杆菌科细菌中产ESBLs肺炎克雷伯菌(46.7%)、大肠埃希杆菌(61.6%)、奇异变形杆菌(17.3%)检出率均高于CHINET全国细菌耐药监测结果[2]。由于ESBLs能水解多种β-内酰胺类抗生素,产ESBLs肠杆菌与非产ESBLs肠杆菌耐药率相差显著。产ESBLs肠杆菌轻中度感染首选含酶抑制剂复方制剂,哌拉西林/他唑巴坦、头孢哌酮/舒巴坦钠等有较好抗菌活性,敏感率近70%。碳青霉烯类抗生素对产ESBLs肠杆菌株有高度抗菌活性,是治疗产ESBLs肠杆菌科细菌所致重症感染的最为有效和可靠的抗菌药物[8]。然而,根据医院抗生素使用情况,随着碳青霉烯类抗生素使用增加,碳青霉烯耐药肠杆菌(CRE)上升趋势明显,尤其CRE肺炎克雷伯菌由2011年17.4%上升到2014年34.1%[9],对亚胺培南、美罗培南耐药率接近30%。目前国内耐碳青霉烯类肺炎克雷伯菌以产KPC-2型碳青霉烯酶报道最多,该酶由质粒介导,可在不同克隆不同菌种间水平传播[10-12]。产KPC酶肺炎克雷伯菌几乎能水解所有β-内酰胺类抗生素(碳青霉烯类、青霉素类、头孢菌素类),表现为多重耐药甚至泛耐药,从而对院内感染控制以及治疗提出严峻挑战,应引起临床高度重视。对于非发酵菌药敏监测显示,以鲍曼不动杆菌为主的不动杆菌属耐药率最高,除多黏菌素外多数抗生素耐药率均高于50%,2014年XRD不动杆菌检出率达到42.6%。鲍曼不动杆菌为条件致病菌在体外生存能力强、定植率高、极易造成克隆播散。泛耐药不动杆菌定植在呼吸道成为机械通气相关肺炎、血流感染、术后颅内感染潜在危险因素。我院不动杆菌检出多数集中在呼吸道,血液及脑脊液标本也有发现。不动杆菌耐药机制较为复杂涉及外膜孔蛋白通透性下降、外排泵高表达、产生多种灭活酶等。轻中度不动杆菌感染治疗可选用头孢哌酮/舒巴坦,氨苄西林/舒巴坦等含舒巴坦的酶复合抑制药。对于XDR不动杆菌导致的重度感染常需要联合用药,如含舒巴坦的复合制剂联合米诺环素或阿米卡星,替加环素联合碳青霉烯类或氨基糖苷类均有报道[13-15]。铜绿假单胞菌近4年抗菌药物耐药率变化较小,头孢他啶、哌拉西林、哌拉西林/他唑巴坦、碳青霉烯类仍对铜绿假单胞菌具有较高敏感性。其中,阿米卡星耐药率低于20%,监测数据显示其体外药敏活性高于碳青霉烯类、抗假单胞菌头孢菌素及含酶抑制药复合制剂,通常作为联合用药治疗多重耐药铜绿假单胞菌导致重度感染。XDR-PA近4年监测检出率呈明显下降趋势。
针对我院感染高危人群多、病患住院时间长、长期住院患者呼吸道病原菌定植率高等特点,对这部分患者护理工作提出了更高要求。早期针对性口腔护理、规范吸痰操作,各类插管严格无菌操作,强化手卫生防止耐药菌接触传播相对于后期感染抗生素使用更具临床意义。同时,临床应根据病原学检查结果,遵循抗生素使用原则,严格规范使用抗菌药物,减少耐药菌株产生,防止和控制多重耐药菌暴发流行。
[1] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京: 东南大学出版社,2006: 715-920.
[2] 胡付品,朱德妹,汪 复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):369-378.
[3] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. Twenty-forth informational supplement,2014,M100-S24 Vol 34 No.1.
[4] 汪 复,朱德妹,胡付品,等.2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2013,13(5): 321-330.
[5] 胡付品,朱德妹,汪 复,等.2011年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5): 321-329.
[6] 马艳芳.ICU气管切开患者肺部感染的危险因素分析及干预对策[J].中华医院感染学杂志,2013,23(12): 2808-2813.
[7] 张秀英,陈禄芝,杨再良,等.脑出血患者肺部感染的危险因素分析[J].中华医院感染学杂志,2014,24(6): 1416-1417.
[8] 周 华,李光辉,陈佰义,等.中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识[J].中华医学杂志, 2014, 94(24):1847-1856.
[9] 孙 龙,武 建.肺炎克雷伯菌医院感染的临床分布及耐药研究[J].实验与检验医学,2012,30(5):478-481.
[10] Zhang R,Zhou H W,Cai J C,etal.Plasmid-mediated carbapenem-hydrolysing beta-lactamase KPC-2 in carbapenem-resistant Serratia marcescens isolates from Hangzhou, China[J]. J Antimicrob Chemother, 2007, 59(3):574-576.
[11] Wei Z Q, Du X X, Yu Y S,etal. Plasmid-mediated KPC-2 in a Klebsiella pneumoniae isolate from China[J]. Antimicrob Agents Chemother, 2007, 51(2): 763-765.
[12] Cai J C, Zhou H W, Zhang R,etal. Emergence of Serratia marcescens, Klebsiella pneumoniae,and Escherichia coli Isolates possessing the plasmid-mediated carbapenemhydrolyzing beta- lactamase KPC-2 in intensive care units of a Chinese hospital[J]. Antimicrob Agents Chemother, 2008,52(6):2014-2018.
[13] Lee N Y, Wang C L, Chuang Y C,etal. Combination carbapenem-sulbactam therapy for critically ill patients with multidrug-resistant Acinetobacter baumannii bacteremia: four case reports and an in vitro combination synergy study[J]. Pharmacotherapy, 2007,27:1506-1511.
[14] Kiffer C R,Sampaio J L, Sinto S,etal.In vitro synergy test of meropenem and sulbactam against clinical isolates of Acinetobacter baumannii[J].Diagn Microbiol Infect Dis, 2005, 52:317-322.
[15] Petersen P J, Labthavikul P, Jones C H,etal. In vitro antibacterial activities of tigecycline in combination with other antimicrobial agents determined by chequerboard and time-kill kinetic analysis[J]. J Antimicrob Chemother, 2006, 57:573-576.
(2015-04-09收稿 2015-04-24修回)
(责任编辑 岳建华)
Analysis of distribution and drug resistance of gram-negative bacilli causing nosocomial infections from 2011 to 2014 in a hospital
HUANG Yonggao, CHEN Ranfeng,and SUN Long.
Hangzhou Hospital of Zhejiang Provincial Corps,Chinese People’s Armed Police Forces,Hangzhou 310051,China
Objective To study the distribution and drug resistance of main gram-negative bacilli causing nosocomial infections in a certain hospital, so as to provide scientific basis for the infection control and reasonable use of antibiotics in clinics. Methods The main strains were collected from patients’ specimens in this hospital from 2011-2014 .The bacterial identification and drug susceptibility tests were performed and their drug resistance was retrospectively analyzed. Results A total of 12437 gram-negative isolates were collected from non- repetitive clinical specimens during the past four years,of which Enterobacteriaceae and non-fermentative Gram- negative bacilli accounted for 6243(50.2%) and 5920(47.6%), respectively. TheAcinetobacter,Pseudomonasaeruginosa,Klebsiellapneumoniae,Escherichiacoliwere the predominant species of Gram-negative bacilli,accounted for 21.1%,19.4%,16.8% and 8.5% respectively. The source of pathogenic bacteria specimens were mainly from respiratory tract and followed by urinary tract. Infection with high-risk departments were the brain injury rehabilitation department and ICU. By monitoring multi-drug resistant bacteria during four consecutive years,it was found that ESBLs-producingEscherichiacoliandKlebsiellapneumoniae(64.9%,64.3%,62.1%,55.4%),(50.1%,47.7%,43.4%,45.7%) showed a trend of decline.But carbapenem- resistantEscherichiacoliandKlebsiellapneumoniae(0.8%,1.5%,1.3%,2.6%),(17.4%,30.8%,27.1%,34.1%) had a rising trend year by year. During the past four years, the average detection rate of extensively drug-resistant Acinetobacter was 40.3%. Conclusions Most clinical isolates are Gram-negative bacilli and multi-drug resistant strains increase obviously.The reasonable clinical use of antibiotics is crucial for delay of emergence of drug-resistant strains. It is also necessary to strengthen the surveillance of drug resistance of the pathogens and prevent the spread of MDRO causing nosocomial infection.
bacterial resistance surveillance; Gram-negative bacilli; multi-drug resistant bacteria; drug susceptibility testing; carbapenemase
黄永高,本科学历, E-mail:huangyonggao008@163.com
310051,武警浙江总队杭州医院
陈然峰, E-mail:hzcrf123@163.com
R453.2;R37

