青蒿琥酯治疗晚期视网膜母细胞瘤的临床疗效与安全性
张媛媛,苗丽霞,孙岩峰,王 军,李彦珊,刘红艳,袁海莲,张向兰,杨新吉,刘秋玲,
青蒿琥酯治疗晚期视网膜母细胞瘤的临床疗效与安全性
张媛媛1,苗丽霞2,孙岩峰2,王 军2,李彦珊2,刘红艳2,袁海莲2,张向兰2,杨新吉3,刘秋玲1,2
目的 探讨青蒿琥酯治疗晚期视网膜母细胞瘤(retinoblastoma, RB)的临床疗效与安全性。方法 总结武警总医院儿科自2012-10至2014-01采用青蒿琥酯联合常规方案(联合治疗组)治疗晚期RB11例患儿的临床资料,并与同期采用常规方案(对照组)治疗的11例晚期RB患儿进行比较,分析总结青蒿琥酯治疗晚期RB的临床疗效及安全性。结果 (1)联合治疗组中4例眼内D、E期患儿中有2例成功保留眼球(50%),5例眼外期患儿中有2例获得手术机会(40%);对照组中7例眼内D、E期的患儿中仅有2例获得保眼机会(28.6%),3例眼外期患儿中有1例获得手术机会(33.3%)。两组间差异均无统计学意义(均P>0.05);(2)截至2015-02-01,联合治疗组的中位无进展生存期(progression-free survival, PFS)和中位总生存期(overall survival, OS)分别为18.2个月和21.8个月,对照组的中位PFS和中位OS分别为18.4个月和21个月,两组间比较差异无统计学意义;(3)所有患儿在给予青蒿琥酯期间均未发生过敏反应,生命体征平稳。两组不良反应的发生率无统计学差异。结论 青蒿琥酯治疗晚期视网膜母细胞瘤有一定疗效,安全性良好。
视网膜母细胞瘤;青蒿琥酯;疗效;安全性
视网膜母细胞瘤(retinoblastoma, RB)是婴幼儿时期最常见的眼内原发性恶性肿瘤[1]。欧美等发达国家RB的5年生存率达95%以上,但就全世界范围来说,5年生存率仅约50%。其主要原因是由于包括我国在内的许多发展中国家患儿就诊时大多已进入晚期,部分患者避免不了眼球摘除或眶内容物剜除术,甚至失去手术机会而死亡[2,3]。因此寻找一种新的辅助治疗方法以降低RB的致残率、病死率,提高生存率已迫在眉睫。
随着国内外学者对青蒿琥酯研究的深入,发现其对多种肿瘤细胞具有杀瘤活性[4-8]。但国内外尚未见青蒿琥酯用于治疗RB的相关报道,笔者的前期工作证实,青蒿琥酯对体外RB-Y79细胞株具有显著的杀伤活性,动物实验证实其亦可抑制RB小鼠移植瘤的生长,提高小鼠的生存率[9]。同时,青蒿琥酯长期用于疟疾治疗的经验表明,它是一种高效、低毒的药物[10]。基于青蒿琥酯以上作用及安全性,笔者将其用于治疗晚期RB患儿,观察其临床疗效与安全性。为今后临床进一步应用青蒿琥酯提供依据。
1 对象与方法
1.1 对象 选择2012-10-01至2014-01-31武警总医院儿科收治的22例经临床诊断和(或)病理诊断为晚期RB患儿的临床资料进行分析。根据治疗方案不同分为联合治疗组和对照组,每组11例,两组患儿间性别、年龄、临床分期等无统计学差异(表1),具有可比性。
1.2 分期标准 局限于眼球内的肿瘤依据International Classification of Retinoblastoma(IIRC)分期方法[11],根据影像学(眼底照片、眼部超声、眼眶增强CT、MRI)和(或)病理学诊断分为A-E期;病理诊断肿瘤侵犯眼球外(筛板和或视神经)、眼眶增强CT和MRI显示肿瘤侵犯眼球外者为眼外期;脑脊液、骨髓细胞学检查及全身骨扫描检查提示远处器官和组织受累者为远处转移期。所有患者的临床分期以一只眼纳入统计,双眼发病者以分期较重眼纳入。
1.3 治疗方法 所有患者根据临床分期不同确定治疗方案。对照组采用RB常规方案治疗,包括:(1)全身系统化疗(VEC方案)。长春新碱1.5 mg/m2,静脉推注,第1天;卡铂560 mg/m2,静脉滴注,第1天;依托泊苷150 mg/m2,静脉滴注,第1、3天。21 d为一疗程,根据分期不同疗程为6~12个疗程;(2)手术。对于病情高度进展,患眼已无希望恢复有用视力或肿瘤可能向视神经、脉络膜或眼眶浸润者,行眼球摘除术或眶内容物剜除术;(3)局部治疗。本组患者主要采用激光光凝、冷冻疗法及巩膜敷贴治疗;(4)眼动脉介入化疗。通过微导丝微导管技术将化疗药物美法仑直接送入RB侧的供血动脉-眼动脉;(5)鞘内注射。所有患儿每次化疗第1天均行鞘内注射,具体药物及剂量见表2。联合治疗组是在采用常规方案治疗的基础上,加用青蒿琥酯,具体用法为:服用琥珀酸亚铁片[4~6 mg/(kg·d)]6 h后,将青蒿琥酯按10 mg/(kg·d)配于20 ml 5%葡萄糖中缓慢静脉推注,自化疗第1天开始,连用7 d。同时,所有患者在化疗时均给予止吐、保心保肝、水化、碱化对症支持治疗。
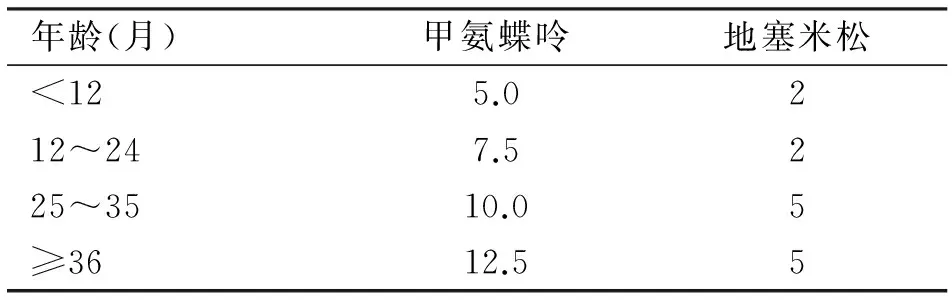
表2 不同年龄视网膜母细胞瘤患者鞘内注射剂量 (mg)
1.4 疗效评价
1.4.1 保眼及获得手术机会情况 入组病例每次治疗前均行眼底照片、眼部超声检查,每2个疗程或临床提示疾病进展时随时行眼眶增强CT和MRI检查,必要时行全身骨扫和(或)PET-CT检查。观察眼内D、E期患者保眼情况,眼外期、远处转移期患者获得手术机会情况。
1.4.2 无进展生存期和总生存期 随访截止至2015-02-01,观察所有患者的无进展生存期(PFS)和总生存期(OS)。截止随访结束时疾病未发生进展或死亡的以截尾数据纳入分析。PFS、OS通过查阅住院病历资料和电话随访确定。治疗完全结束后进行长期随访,前3个月每月1次,如无复发或进展,每3个月1次,连续2次,如仍无异常,改为6个月1次,连续2次,最后为1年1次。
1.5 安全性评价 每个疗程治疗前均行常规体格检查、实验室检查(血常规、小儿生化)、心电图、畸变耳声发射等辅助检查。所有患者每次治疗过程中观察生命体征变化。联合治疗组每次治疗期间及治疗后均行血常规[1次/(2~3 d)]检查,治疗结束后行小儿生化检查。对照组于每次治疗结束后行血常规[1次/(2~3 d)]检查,治疗1周后行小儿生化检查。
1.6 统计学处理 使用SPSS17.0统计软件进行统计分析,偏态分布的计量资料比较采用秩和检验;计数资料的比较采用Fisher确切概率法分析比较。两组间总生存期曲线描述采用Kaplan-Meier并用Log-rank法比较。均采用双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效 联合治疗组11例患儿共接受55个疗程的青蒿琥酯治疗,最少2个疗程,最多10个疗程,平均5个疗程。2例眼内D期患者中有1例(1/2,50%)避免了眼球摘除,成功保留眼球,另1例行眼动脉介入化疗2疗程后行眼球摘除术;2例眼内E期患儿中有1例(1/2,50%)保留眼球,后出现复发;另1例入院后即行眼球摘除术。眼外期的5例中有2例(2/5,40%)瘤体缩小明显,获得手术机会,成功行眶内容物剜除术,1例治疗过程中放弃治疗,2例发生远处转移后死亡。2例远处转移期中1例仅治疗2疗程后家长放弃治疗,另外1例治疗未结束时死亡。
对照组中3例眼内D期患者仅1例(33.3%)成功保留眼球,余2例最后均行眼球摘除术;眼内E期的4例患儿中仅有1例(25%)保留眼球,后发生远处转移死亡,余3例中1例复发后治疗结束随访中,1例复发后进展为眼外期,1例治疗结束随访中。3例眼外期患者中仅1例行手术治疗(33.3%),1例放弃治疗,1例疾病进展后死亡。1例远处转移期患儿放弃治疗。
随访截止至2015-02-01,两组间均无失访病例,随访率达100%。随访时间最长28个月,最短4.9个月,中位随访时间21.7个月。
对于PFS,联合治疗组中有4例截尾,最长PFS为28个月,最短为6.2个月,中位PFS为18.2个月;对照组中有4例截尾位,最长PFS为26.9个月,最短为3.2个月,中位PFS为18.4个月,两组间差异无统计学意义(P=0.8)。
对于OS,联合治疗组中有5例截尾位,最长OS为28个月,最短为8.4个月,中位OS为21.8个月;对照组中有6例截尾位,最长OS为26.9个月,最短为4.9个月,中位OS为21个月,两组间差异无统计学意义(P=0.79)。
2.2 安全性 两组均没有发生与治疗相关的致死病例,所有患者均出现了不同器官系统不同程度的不良反应,两组间比较差异无统计学意义。所有患儿均发生了血液系统、消化系统毒性。血液系统毒性主要表现为三系的降低,多发生于化疗结束后的7~14 d左右,经对症处理或随时间延长,三系均逐渐升至正常水平。消化系统毒性表现为食欲减低、恶心呕吐,随着化疗结束,恶心呕吐逐渐缓解,食欲也逐渐改善。其他不良反应还包括肝肾功异常、心肌受损。肝肾功能异常、心肌受损者经保心、保肝、碱化、水化治疗及随着化疗药的停用,各相关指标均逐渐恢复正常(表3)。
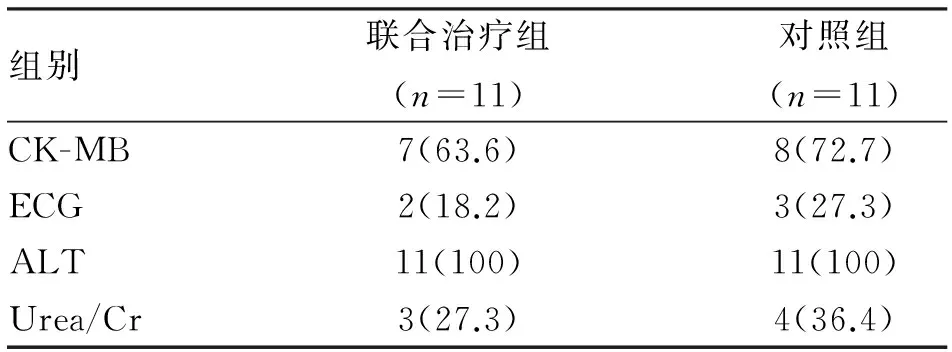
表3 两组视网膜母细胞瘤患者治疗后的 心肝肾功能异常比较 (n;%)
3 讨 论
近年来,随着医疗技术水平的不断进步,以化疗联合手术、局部治疗为主的综合治疗模式大大改善了RB患儿的预后,但这些常规治疗方案不仅会造成患儿颜面部畸形,且随着化疗时间的延长,化疗疗效会逐渐降低,长期使用还会引起肾毒性等不良反应及多药耐药性的发生[12-14]。
青蒿琥酯是青蒿素的衍生物之一,是治疗疟疾的一线药物[15,16]。随着国内外许多学者对其研究的不断深入,发现青蒿琥酯对多种肿瘤细胞都具有显著的杀伤作用,且对正常组织细胞的毒性很低[17,18]。笔者的前期工作[9]也证实(1)细胞水平:青蒿琥酯可选择性杀伤RB细胞,且呈时间、剂量依赖性;(2)动物水平:青蒿琥酯可抑制RB小鼠移植瘤的生长、提高RB小鼠的生存率。关于临床应用中,青蒿琥酯仅偶见用于成人肿瘤,且应用剂量、途径各不相同,结果也存在着显著差异。其在儿童肿瘤中的应用尚未见相关报道。
3.1 临床疗效
3.1.1 保眼率 本研究发现,两组间眼内D、E期的保眼率可能因样本量小,差异虽无统计学意义,但从结果可以看出,联合治疗组眼内D-E期患者保眼例数及所占比例均高于对照组,且D期保眼机会大于E期患者。唐松等[19]对67例(92只)RB患儿采用化疗联合局部治疗、手术等综合治疗,眼内D和E期的保眼率为 51.4%和16%。国外文献报道,E期RB患儿的非手术治疗可能会造成肿瘤的远处转移而使患儿的病死率升高[20]。本研究结果虽显示,联合青蒿琥酯可提高眼内D-E期患儿保眼率,但在治疗策略上要有所慎重,避免因保眼而造成远处转移的发生。
3.1.2 获得手术概率 该研究结果显示,联合治疗组中眼外期患儿经联合青蒿琥酯治疗获得手术机会者多于对照组,可能因样本量小,两组间比较差异无统计学意义(P>0.05),但根据临床体会,笔者认为加用青蒿琥酯治疗瘤体缩小速度及程度均优于对照组,为失去手术机会者重新创造手术机会。两组中的远处转移期患儿由于病情重,多数放弃治疗或治疗过程中因最终发生全身转移而死亡。由于样本量小,且应用疗程较短,青蒿琥酯对远处转移期 RB患者的疗效有待进一步的证实。
3.1.3 无进展生存时间和总生存时间 经统计学软件处理,联合治疗组的中位PFS(18.2个月)较对照组(18.4个月)稍短,中位OS(21.8个月)与对照组(21个月)相比稍长,但差异无统计学意义,这与笔者前期基础研究结果存在差异。分析造成这一差异的原因可能为:(1)本研究样本量小,可能存在偏倚,因此,尚需大样本的研究支持与证实。(2)临床病例不同于动物模型,其所处环境、个体化的治疗方案等诸多因素也可能是造成这一差异的原因之一。(3)苗丽云等[21]研究发现青蒿琥酯只有在大量亚铁离子存在的条件下,才会产生自由基和细胞毒作用。本研究中青蒿琥酯与化疗同时进行。大部分患者在化疗后都会出现因骨髓抑制而造成的不同程度的贫血,同时骨髓抑制还会造成铁代谢紊乱,故不仅应在青蒿琥酯使用前给予补铁,而且在化疗结束后的一定时间内也应加用铁剂,提高血红蛋白含量,进一步提高肿瘤细胞内铁的含量,可能会取得更好疗效。(4)至目前为止,青蒿琥酯仅见应用于部分成人肿瘤患者,所以本研究中青蒿琥酯所用剂量是否合适,有待进一步研究。(5)笔者的前期动物实验青蒿琥酯是通过小鼠腹腔注射,瘤体缩小十分显著,本研究中采用静脉注射的方法给药,不同给药途径产生的疗效是否存在差异,有待我们更进一步的探究。
3.2 安全性 本研究两组中所有患儿均发生不同程度的化疗后骨髓抑制、胃肠道不适。部分患儿还出现了不同程度的心肌受损、肝功能异常、肾毒性不良反应,但两组间发生率无统计学差异。根据长春新碱、依托泊苷及卡铂均可引起血液系统、消化系统毒性作用、心肌受损、肝肾功异常不良反应,考虑不良反应的发生均与此三种化疗药物有关,青蒿琥酯不增加化疗的不良作用,其安全性良好。
综上所述,青蒿琥酯可用于RB的临床治疗。青蒿琥酯联合常规方案有一定的抗肿瘤作用,但其作用不显著,因此有必要进一步加强对青蒿琥酯抗肿瘤的临床前药理研究,争取进行大样本的前瞻性随机对照临床试验以进一步明确青蒿琥酯抗肿瘤的剂量、疗程、不良反应、途径、时机、临床分期的选择及铁剂的应用。青蒿琥酯不增加化疗药物的不良作用,安全性良好。
[1] Dimaras H, Kimani K, Dimba E A,etal. Retinoblastoma[J]. Lancet, 2012, 379(4):1436-1446.
[2] Maccarthy A, Draper G J, Steliarova-Foucher E,etal. Retinoblastoma incidence and Survival in European children (1978-1997)[J]. Eur J Cancer, 2006, 42(13):2029-2102.
[3] 马京琪,黄东生,张 谊,等.244例儿童视网膜母细胞瘤临床特点[J].眼科,2011,20(2):113-115.
[4] 刘俊玲,郑智茵,虞容喜.青蒿素及其衍生物的抗肿瘤机制探讨[J].中药新药与临床药理,2006,17(2):155-157.
[5] Efferth T, Sauerbrey A, Olbrich A,etal. Molecular modes of action of artesunate in tumor cell lines[J]. Mol Pharmacol, 2003, 64(2):382-394.
[6] Sadava D, Phillips T, Lin C,etal. Transferrin overcomes drug resistance to artemisinin in human small-cell lung carcinoma cells[J]. Cancer Lett, 2002, 179(2):151-156.
[7] Efferth T, Volm M. Glutathione-related enzymes contribute to resistance of tumor cells and low toxicity in normal organs to artesunate[J]. In Vivo, 2005, 19(1):225-232.
[8] 吕翠岩,陈信义,唐炳华.青蒿素及其衍生物逆转肿瘤耐药作用初探[J].中国中医药信息杂志,2006,13(4):12-14.
[9] Zhao F, Wang H, Kunda P,etal. Artesunate exerts specific cytotoxicity on retinoblastoma cells via CD71[J]. Oncol Rep, 2013, 30(3):1473-1482.[10] Balint G A. Artemisinin and its derivatives: An important new class of antimalarial agents[J]. Pharmacol Ther, 2001, 90(2-3):261-265.
[11] Linn M A. Intraocular retinoblastoma: the case for a new group classification[J]. Ophthalmol Clin North Am, 2005, 18(1):41-53.
[12] Gobin Y P, Dunkel I J, Marr B P,etal. Intra-arterial chemotherapy for the management of retinoblastoma: four-year experience[J]. Arch Ophthalmol, 2011, 129(6):732-737.
[13] Qaddoumi I, Bass J K, Wu J,etal. Carboplatin-associated ototoxicity in children with retinoblastoma[J]. J Clin Oncol, 2012, 30(10):1034-1041.
[14] Chan H S, DeBoer G, Thiessen J J,etal. Combining cyclosporin with chemotherapy controls intraocular retinoblastoma without requiring radiation[J]. Clin Cancer Res, 1996, 2(9):1499-1508.
[15] Miller L H, Su X. Artemisinin discovery from the Chinese herbal[J]. Cell, 2011, 146(6):855-858.
[16] Amin N C, Fabre H, Blanchin M D,etal. Determination of artemether and lumefantrine in anti-malarial fixed-dose combination tablets by microemulsion electrokinetic chromatography with short-end injection procedure[J]. Malar J, 2013, 12: 202.
[17] Efferth T, Dunstan H, Sauerbrey A,etal. Theanti-malarial artesunate is also active against cancer[J]. Int J Oncol, 2001, 18(4):767-773.
[18] 孙玮辰,韩家娴,杨蔚怡,等.四种青蒿酸及青蒿B衍生物的体外抗癌作用[J].中国药理学报,1992,13(6):541.
[19] 唐 松,陆晓和,张国明,等.视网膜母细胞瘤综合治疗的临床分析[J].实用肿瘤杂志,2013,28(2):167-169.
[20] Zhao F, Dimaras H, Massey C,etal. Pre-encleation chemotherapy for eyes severely affected by retinoblastoma masks risks of tumor extension and increases death from metastasis [J].J Clin Oncol, 2011, 29(7):845-851.
[21] 苗立云,张祖贻.铁离子增强青蒿琥酯抗癌作用及改变癌细胞死亡方式研究[J].中草药,2008,39(10):1528-1532.
(2015-03-03收稿 2015-05-22修回)
(责任编辑 梁秋野)
Clinical effect and safety of artesunate in treatment of advanced retinoblastoma
ZHANG Yuanyuan1, MIAO Lixia2, SUN Yanfeng2, WANG Jun2, LI Yanshan2, LIU Hongyan2, YUAN Hailian2, ZHANG Xianglan2,YANG Xinji3, and LIU Qiuling1,2.
1. Anhui Medical University, Hefei 230032, China;2. Department of Pediatrics, 3. Department of Orbital Disease Research Institute, the General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China
Objective To study the clinical effect and safety of artesunate combined with conventional therapeutic schedule for children with advanced retinoblastoma. Methods We summarized clinical data of 11 cases who were treated with artesunate combined with conventional therapeutiy with advanced retinoblastoma as combination group between Octobor 1 2012 to January 31 2014 in the General Hospital of Chinese People’s Armed Police Forces. At the same time, 11 cases of advanced retinoblastoma with single conventional therapeutic schedule were selected as control group. The efficacy and safety were reviewed. Results (1)There were two of four(2/4,50%) cases of successfully reserved eyeball in children with intraocular D-E stage, and two cases in five(2/5,40%) received surgery opportunity with extraocular stage in combination group; two cases(2/7,28.6%) of successful reserved eyeball with intraocular D-E stage in seven patients, and one case(1/3,33.3%) received surgey opportunity with extraocular stage in three children in control group. (2)By the end of February 1,2015, the median progression-free survival and the median overall survival were 18.2 months and 21.8 months respectively in the combination group, which compared with control group(the median progression-free survival was 18.4 months and the median overall survival was 21 months), the difference was not statistically significant. (3)All patients did not show allergic reactions during the artesunate therapy and vital signs were stable. No significant difference was found in toxicity between the the two groups (P>0.05). Cnclusion Preliminary study results show that artesunate used for clinical treatment of advanced RB has certain curative effect without extra side effects.
retinoblastoma; artesunate; curative effect; safety
武警总医院院内一类(编号:WZ20130102)
张媛媛,硕士研究生,E-mail:zhangyy0534@163.com
1.230032 合肥,安徽医科大学研究生学院;100039 北京,武警总医院:2.儿科;3.眼眶病研究所
刘秋玲,E-mail:wj670@vip.sina.com
R739.7

