青蒿琥酯联合卡铂治疗视网膜母细胞瘤动物实验研究
王慧燕,苗丽霞,孙岩峰,李彦珊,刘红艳,王 军,袁海莲,张向兰,刘秋玲
青蒿琥酯联合卡铂治疗视网膜母细胞瘤动物实验研究
王慧燕1,2,苗丽霞2,孙岩峰2,李彦珊2,刘红艳2,王 军2,袁海莲2,张向兰2,刘秋玲2
目的 通过对视网膜母细胞瘤(retinoblastoma, RB)移植瘤小鼠进行青蒿琥酯(artesunate, ART)联合卡铂治疗,并与单独采用卡铂、ART治疗组分别进行比较,以观察ART联合卡铂在RB治疗中的协同作用。方法 (1)将浓度为3.5×107/ml RBY-79肿瘤细胞注入新生小鼠右眼玻璃体内,建立RB移植瘤小鼠模型。(2)将建模成功的RB移植瘤小鼠随机分为4组,实验组为ART联合卡铂组;对照组分3组,分别为卡铂组、ART组、空白对照组,对各组移植瘤小鼠分别给药,观察肿瘤变化及移植瘤小鼠生存时间,进行组间比较,并观察ART联合卡铂的协同作用。结果 (1)成功建立RB移植瘤小鼠模型,移植瘤小鼠右眼重量明显大于正常左眼(P<0.0001)。(2)与空白对照组相比,联合用药组、卡铂组、ART组移植瘤小鼠的肿瘤均明显缩小,P值分别为<0.0001,<0.0001,0.0015;联合用药组、卡铂组移植瘤小鼠生存时间明显延长,P值分别为0.0253,0.0253;ART组移植瘤小鼠生存时间较空白对照组无明显延长,P值为0.8722。(3)与ART组相比,联合用药组及卡铂组移植瘤小鼠的肿瘤均明显缩小,P值分别为0.0084及0.0015;联合用药组与卡铂组移植瘤小鼠生存时间明显延长,P值分别为0.0240,0.0239。(4)联合用药组与卡铂组相比,移植瘤小鼠的肿瘤无明显缩小(P=0.7980);移植瘤小鼠生存时间无明显延长(P=1.0000)。结论 ART、卡铂及两药联合对RB均有明显抑制作用,但ART联合卡铂对RB无协同治疗作用。
视网膜母细胞瘤;青蒿琥酯;卡铂;联合用药
视网膜母细胞瘤(retinoblastoma, RB)是婴幼儿时期最常见眼内恶性肿瘤[1,2]。目前,其主要治疗方法包括手术、放疗、化疗和局部治疗等[3],而化疗是其中最重要的治疗手段。卡铂、长春新碱、依托泊苷是最主要的化疗药物,其次还有环磷酰胺、环孢素A等[4-6]。这些化疗药物在杀死肿瘤细胞、抑制肿瘤生长的同时会给患者带来各种不良反应,包括免疫功能下降,骨髓抑制,心、肝、肾毒性等[7,8]。由于这些毒性反应,很大程度上限制了RB患者化疗药物的剂量与疗程,造成许多晚期患者的预后目前仍很差[9,10]。因此,迫切需要寻找一种既能抑制肿瘤生长、毒性反应又小的药物,用于RB患者的治疗。青蒿琥酯(artesunate, ART)是青蒿素的衍生物。近年来,越来越多的研究发现,ART除了具有较好的抗疟活性外,还具有抗多种肿瘤细胞的作用,并且具有毒性低、与常规化疗药物不存在交叉耐药、可以逆转肿瘤细胞的多重耐药性等优点[11]。本课题组的前期研究发现,ART对RB细胞株[12]、RB移植瘤小鼠均有明显杀瘤作用;体外实验中还发现,ART与常用治疗RB的化疗药物卡铂具有协同杀瘤作用[12]。但ART与卡铂在体内是否也具有协同抗RB作用,目前国内外尚未见文献报道。为此,笔者通过对RB移植瘤模型小鼠进行ART联合卡铂治疗,以观察ART在体内是否与卡铂具有协同杀瘤作用,为ART应用于临床提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验试剂 注射用ART粉针剂(桂林南药股份有限公司),注射用卡铂(山东齐鲁制药厂),多聚甲醛(St. Louis, MO, USA),OCT(Sakura)等。
1.1.2 细胞株和实验动物 (1)细胞株:人RBY-79细胞株,购自中国医学科学院基础医学研究所基础医学细胞中心。肿瘤细胞接种于完全培养基中,在温度为37 ℃,CO2浓度为5%的细胞培养箱中培养,完全培养基由90%RPMI1640(GIBCO, USA),10%胎牛血清(BRL, Merelbeke, Belgium),1%青霉素/链霉素(GIBCO, USA)以及15 mmol/L HEPES(St.Louis, MO, USA)配置而成。实验中所用的肿瘤细胞均处于对数生长期。(2)实验动物:饲养于北京生命科学研究所SPF级动物房的出生24 h内的CD1小鼠。母鼠饲养条件为室温23~25 ℃,空气湿度40%~50%,光照12 h(06:00~18:00),黑暗12 h(18:00~06:00),动物自由摄食饮水。
1.2 方法
1.2.1 建立RB移植瘤小鼠模型 选取出生24 h内的CD1小鼠20只,收集对数生长期的RBY-79细胞并制成细胞浓度为3.5×107/ml肿瘤细胞悬液,在无菌条件下,用微量注射器依次刺破新生小鼠右眼眼睑、角膜,将4 μl肿瘤细胞悬液注入小鼠右眼玻璃体内。操作过程中要避免刺破晶状体和视网膜。肿瘤建模7 d后,CO2处死小鼠,完整剖出含肿瘤组织的右眼眼球和左眼正常眼球,称重并记录。用1×PBS洗去眼球周围的血液,并在体式显微镜下拍照。随后用4%PFA 4 ℃过夜固定,1×PBS冲洗,不同浓度梯度的甲醇脱水、复水,30%蔗糖过夜沉降,OCT包埋,切片,最后运用苏木精-伊红(H﹠E)染色,显微镜下观察含肿瘤组织的右眼眼球和左眼正常眼球的细胞结构差异,确定RB移植瘤小鼠建模是否成功。
1.2.2 ART、卡铂联合用药对RB移植瘤小鼠肿瘤的影响 将48只同一天出生并确认肿瘤建模成功的新生移植瘤小鼠随机分为4组,每组12只,各组给药途径均为腹腔注射。(1)联合用药组:ART 50 mg/(kg·d),肿瘤建模成功后第3~9天连续给药,1次/d,共7 d;卡铂20 mg/(kg·d),肿瘤建模成功后第3天给药,1次/d,共1 d;(2)卡铂组:卡铂20 mg/(kg·d),肿瘤建模成功后第3天给药,1次/d,共1 d;(3)ART组:ART 50 mg/(kg·d),肿瘤建模成功后第3~9天连续给药,1次/d,共7 d;(4)空白对照组:肿瘤建模成功后第3~9天腹腔注射同等体积的生理盐水,1次/d,共7 d。用药期间密切观察各组移植瘤小鼠的生活状态,并记录各组实验小鼠的死亡数量。根据所得数据,绘制Kaplan-Meier小鼠生存曲线。用药结束后次日处死各组小鼠并称重;将肿瘤组织剖出并称瘤重。用1×PBS洗去肿瘤组织周围血液,并在体式显微镜下拍照。
1.3 统计学处理 应用Graph Prism统计软件,两组样本均数的比较采用非配对t检验,多组样本均数的两两比较采用ANOVA(Tukey检验),各组生存曲线的比较采用log-rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 成功建立RB移植瘤小鼠模型 新生小鼠右眼玻璃体内注射了RBY-79细胞后成瘤率可达100%,肿瘤建模后第6天移植瘤小鼠开始出现死亡,建模7 d内移植瘤小鼠病死率为20%(图1)。新生小鼠右眼玻璃体内注射RBY-79后第1天右眼眼球与左眼眼球相比稍突出;建模后第3天,可见右眼眼球较左眼正常眼球突出;5 d后移植瘤突出更加明显;注射7 d后,含移植瘤的右眼眼球已明显突出于眶外。建模后第7天,CO2处死移植瘤小鼠,剖出右眼和左眼,可见注射了RBY-79的右眼(图2A)明显比左眼(图2B)大,右眼眼球呈瓷白色,表面凹凸不平、血管丰富;左眼保留了眼球的完整结构。含肿瘤组织的右眼眼球重量(0.1213±0.01181)g明显高于左眼(0.01372±0.00033)g,且差异有统计学意义(P<0.0001)(图3)。HE染色示正常左眼:可见清晰完整的眼球结构,玻璃体由红染的胶原纤维和少量圆形、椭圆形、梭形或扁平型细胞组成;视网膜的完整性和连续性仍存在(图4A)。右眼可见病态眼球结构:正常眼球结构已破坏,玻璃体内充满圆形、椭圆形、多边形或不规则形的肿瘤细胞;胞核大、圆形、卵圆形或不规则形,染色深,有1~2个以上核样结构体。核内常见1~2个不规则核仁,胞质少(图4B)。

图1 各组移植瘤小鼠生存时间与生存率的关系

图2 肿瘤建模7 d后含肿瘤组织的右眼与正常左眼
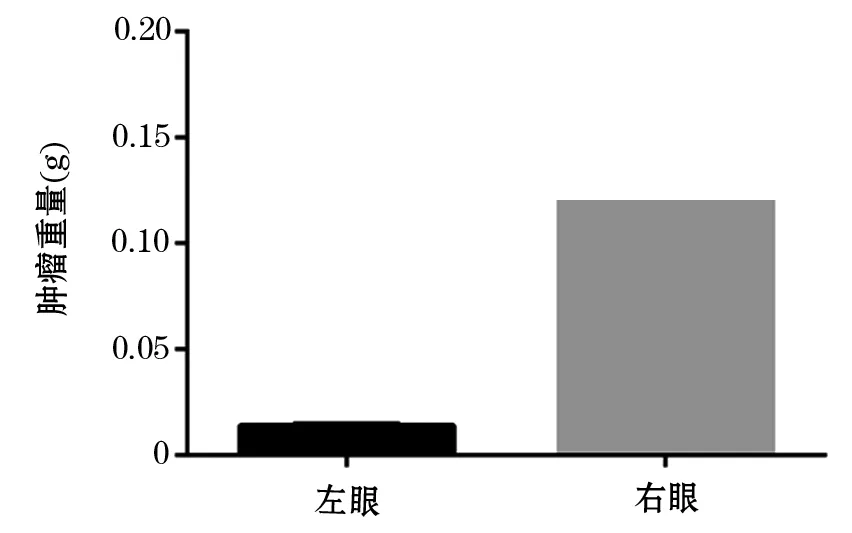
图3 含肿瘤组织的右眼与正常左眼重量比较
2.2 联合用药对RB移植瘤小鼠肿瘤生长影响 (1)联合用药组、卡铂组、ART组移植瘤小鼠的肿瘤重量均明显小于空白对照组(图5,图6,表1)(P<0.0001,P<0.0001,P=0.0015),且前两组移植瘤小鼠的生存时间与空白对照组相比明显延长(图1,P=0.0253,P=0.0253),但ART组移植瘤小鼠生存时间无明显延长(图1,P=0.8722);(2)联合用药组、卡铂组移植瘤小鼠的肿瘤均明显小于ART组(图5,图6,表1,P=0.0084,P=0.0015),移植瘤小鼠生存时间明显延长(图1,P=0.0240,P=0.0239);(3)联合用药组与卡铂组相比,移植瘤小鼠的肿瘤未见明显缩小(图5,图6,表1,P=0.7980),移植瘤小鼠生存时间未见明显延长(图1,P=1.000);(4)联合用药组、ART组、卡铂组移植瘤小鼠的体重较空白对照组均有轻微下降,但均无统计学意义,用药组间移植瘤小鼠的体重也无明显差异。

图4 含肿瘤组织的右眼与正常左眼眼球冷冻切片(HE,5×)
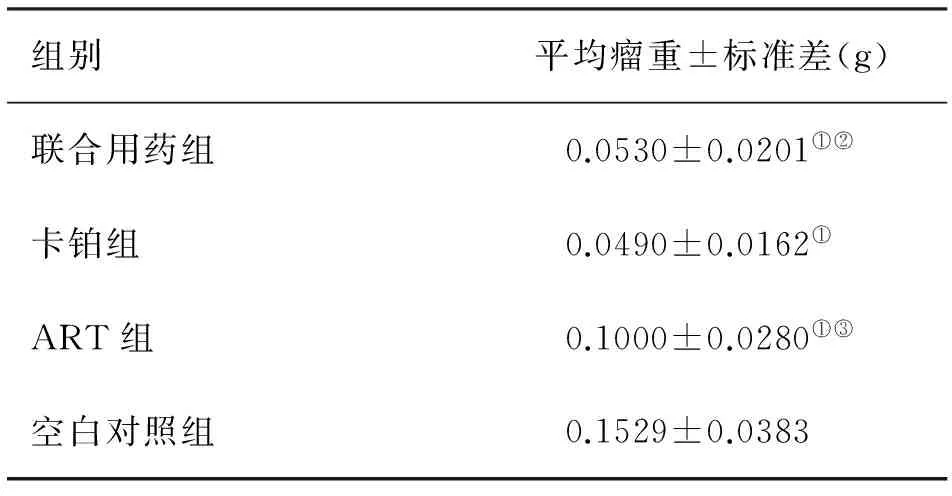
注:与空白对照组比较,①P<0.05;与ART组比较,②P<0.05;与卡铂组比较,③P<0.05
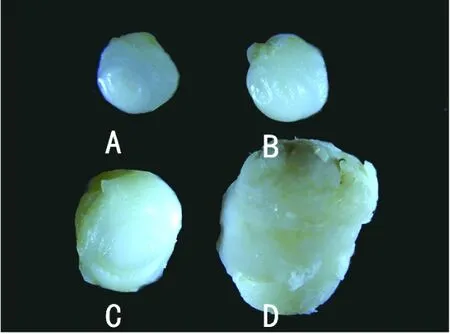
图5 各组移植瘤小鼠用药结束后外观比较
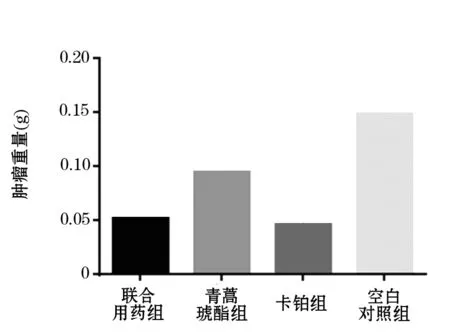
图6 各组移植瘤小鼠用药结束后肿瘤组织重量的比较
3 讨 论
既往研究发现,ART对人体多种肿瘤细胞系,或是肿瘤模型动物均有较好的抗肿瘤作用;ART对肿瘤细胞的抑制作用具有高度的选择性;ART对多重耐药的肿瘤细胞亦有显著抑制作用[13-15]。近几年来,本课题组对ART对RB的作用进行了系列研究。我们发现,ART对RB细胞株具有明显杀瘤活性,且与公认的治疗RB的化疗药物卡铂有协同抗瘤作用[12]。进一步的动物实验研究发现,ART对RB移植瘤小鼠的肿瘤具有显著杀瘤作用,初步研究认为ART对RB体内的杀瘤机制可能为抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、减少肿瘤组织新生血管的形成。ART与卡铂在体内是否具有协同抗RB作用,目前国内外未见文献报道。
本研究通过建立RB移植瘤小鼠模型,选取肿瘤建模后第3天的移植瘤小鼠进行ART联合卡铂治疗,并分别与卡铂组、ART组、空白对照组进行比较。笔者发现,注射RBY-79 3 d的移植瘤小鼠,右眼肿瘤明显突出眼眶,更符合临床晚期RB患儿的发病特点。因此,笔者选择肿瘤建模后第3天开始用药。本实验中,笔者发现卡铂、ART这两种药物均对RB移植瘤小鼠的肿瘤细胞有杀瘤作用,明显抑制肿瘤组织的生长,从而延长移植瘤小鼠生存时间;与ART相比,传统化疗药物卡铂抑制RB生长的效果更显著。卡铂、ART联合用药对RB移植瘤小鼠肿瘤组织的杀瘤作用明显高于ART单独用药,但与卡铂单独用药相比,其对肿瘤的抑制作用并没有增加,所以说ART联合卡铂对RB并无明显的协同治疗作用,这与笔者前期的关于ART体外与卡铂有协同抗瘤作用的结果不一致。
笔者分析这种结果的可能原因:ART是通过抗肿瘤的活性结构-过氧化桥,对人类肿瘤细胞系产生明显的杀瘤作用。但是,ART这种抗肿瘤的活性结构稳定性极差。而卡铂,作为一种常见的铂类抗肿瘤药物,是通过其活性结构-铂分子与肿瘤细胞的DNA分子结合,改变肿瘤分子结构、破坏DNA复制、转录序列,促进肿瘤细胞凋亡,从而发挥杀死肿瘤的作用[13]。本研究中联合用药组的RB移植瘤小鼠开始给予卡铂治疗时,体内的ART可能尚未完全代谢,过氧化桥活性结构极可能会与卡铂的活性结构-铂分子相结合,最终减弱二者抑制肿瘤的作用,发挥不了协同抗肿瘤的效果。另外,大部分杀瘤药物是通过相近或相似的作用机制杀死肿瘤细胞、达到抑制肿瘤生长的治疗目的。目前,国内外对ART体内抑制肿瘤生长机制的研究还不是很清楚,如果ART、卡铂对RB移植瘤小鼠的抑制肿瘤生长的机制相同或相近,ART用药结束后,除已经被杀死的肿瘤细胞外,体内残存的大部分肿瘤细胞正处于对卡铂不敏感的细胞周期,从而发挥不了ART、卡铂的协同抗肿瘤作用。此外,两种药物的用药顺序、用药途径也可能会影响其对肿瘤的抑制作用[14]。
在以后的工作中,笔者会利用化学实验方法,进一步测试ART与卡铂在体外可能的结构相互作用;同时利用免疫荧光等技术探究ART、卡铂体内抑制RB生长的作用机理,寻找本实验中ART、卡铂联合用药对RB移植瘤小鼠不能产生协同抗肿瘤作用的原因。通过改变两种药物的用药时机、用药顺序,尝试不同的给药途径,寻求一种治疗RB的毒性反应小,肿瘤杀伤性强的联合用药方法,为ART应用于临床治疗提供实验依据。
[1] Guillermo Chantada, Paula Schaiquevich. Management of Retinoblastoma in Children: Current Status[J]. J Pediatric Drugs, 2015, 17(3):185-198.
[2] Francesco Pichi, Andrea Lembo, Mariacarla,etal. Bilateral retinoblastoma: clinical presentation, management and treatment[J]. International Ophthalmology, 2013, 33(5):589-593.
[3] Murphree A L, Villablanca J G, Deegan W F,etal. Chemotherapy plus local treatment in the management of intraocular retinoblastoma[J].Arch Ophthalmol-chic, 1996, 114(11):1348-1356.
[4] Kaliki S, Shields CL, Shah SU,etal. Postenucleation adjuvant chemotherapy with vincristine, etoposide, and carboplatin for the treatment of high-risk retinoblastoma.[J]. Arch Ophthalmol, 2011, 129(11):1422-1427.
[5] Varan A, Kiratli H, Aydin B,etal. The treatment of retinoblastoma with four-drug regimen including cisplatin, etoposide, vincristine, and cyclophosphamide[J]. Pediat Hematol Onc, 2012, 29(6):529-537.
[6] Veal G J, Boddy A V. Carboplatin dosing in infants with retinoblastoma: A case for therapeutic drug monitoring[J]. J Clin Oncol, 2012, 30(27):3424-3029.
[7] Qaddoumi I, Bass J K, Wu J,etal. Carboplatin-associated ototoxicity in children with retinoblastoma[J]. J Clin Oncol, 2012, 30(10):1034-1041.
[8] Rajkumar Venkatramani MD, Rima Fuad Jubran MD. Retinoblastoma: Intravenous Chemotherapy[J] Clinical Ophthamic Oncology, 2015, 126(6):119-127.
[9] Antoneli C B, Steinhorst F, de Cássia Braga Ribeiro K,etal. Extraocular retinoblastoma: A 13-year experience[J]. Cancer, 2003, 98(6):1292-1298.
[10] Baroni LV, Sampor C, Solernou V,etal. Anterior segment invasion in retinoblastoma: is it a risk factor for extraocular relapse?[J]. J Pediatr Hematol Oncol, 2014, 36(8):509-512.
[11] Efferth T, Giaisi M, Merling A,etal. Artesunate induces ROS-mediated apoptosis in doxorubicin-resistant T leukemia cells[J]. PLoS One, 2007, 2(8):e693.
[12] Zhao F, Wang H, Kunda P,etal. Artesunate exerts specific cytotoxicity in retinoblastoma cells via CD71[J]. Oncol Rep, 2013, 30(3):1473-1482.
[13] Cruet-Hennequart S, Villalan S, Kaczmarczyk A,etal. Characterization of the effects of cisplatin and carboplatin on cell cycle progression and DNA damage response activation in DNA polymerase eta-deficient human cells[J]. Cell Cycle, 2009, 10(18):3043-3054.
[14] Xiong X, Sui M, Fan Wetal. Cell cycle dependent antagonistic interactions between paclitaxel and carboplatin in combination therapy[J]. Cancer Biol Ther, 2007, 6(7):1067.
(2015-03-03收稿 2015-05-21修回)
(责任编辑 张 楠)
A primary study of artesunate accociated with carboplatin on retinoblastoma in mice
WANG Huiyan1,2,MIAO Lixia2,SUN Yanfeng2,LI Yanshan2,LIU Hongyan2, WANG Jun2,YUAN Hailian2,ZHANG Xianglan2,and LIU Qiuling2.
1.Xuzhou Medical College, Xuzhou 221002,China;2.Department of Pediatrics, The General Hospital of Chinese People’s Armed Police Forces, Beijing 100039,China
Objective This study was designed to determine the combined therapeutic effects of artesunate and carboplatin in treating retinoblastoma, compared with carboplatin alone, artesunate alone and control groups after having established newborn mice retinoblastoma model successfully. Methods (1)The cell line RBY-79 in a single-cell suspension was implanted into the right vitreous body of newborn littermates to set up a retinoblastoma xenograft model.(2)Mice bearing palpable tumors were randomly divided into four independent groups after all retinoblastoma xenograft models had been established, respectively, combined group, carboplatin group, ART group and control group. Our aims were to observe and compare the tumor size and survival time of retinoblastoma newborn mice in different groups. Results (1)Retinoblastoma xenograft models of newborn mice were successfully established and a consistent and statistically significant difference was found in the tumor weight between the right and left eyes (P<0.0001).(2)①The tumor weights in combined group, carboplatin group and ART group were significantly less than that in control (P<0.0001,P<0.0001,P=0.0015), at the same time, the survival time in these the former two groups were longer (P=0.0253,P=0.0253), that in ART group was not longer(P=0.8722). ②The tumor weights in combined group, carboplatin group were significantly less than that in ART group (P=0.0084,P=0.0015), and the survival time in the two groups were longer (P=0.0240,P=0.0239). ③The tumor weight in combined group was significantly no less than that in carboplatin group and the survival time was not longer (P=0.7980,P=1.0000). Conclusions In our study, we can find that combined treatment, carboplatin and ART can significantly inhibit the growth of retinoblastomainvivo. However, ART does not significantly enhance the antitumor effects of carboplatin during the treatment.
retinoblastoma; artesunate; carboplatin; combined treatment
首都临床特色应用研究专项(Z121107001012055)
王慧燕,硕士研究生,E-mail:wangfengfeng0327@126.com
1.221004,徐州医学院研究生学院;2.100039 北京,武警总医院儿科
刘秋玲,E-mail:wj670@vip.sina.com.
R73.35

