番茄黄化曲叶病毒在湖北首次报道
汤亚飞,何自福*,杜振国,佘小漫,蓝国兵,罗方芳
(1.广东省农业科学院植物保护研究所,广州 510640;2.广东省植物保护新技术重点实验室,广州 510640)
番茄黄化曲叶病是世界范围内严重影响番茄生产的一种重要病害,已给热带和亚热带地区的番茄生产造成严重损失[1]。田间番茄染病后表现为植株矮化,叶片黄化、变小,叶片边缘向上卷曲。生长发育早期染病时,植株无法正常开花结果;后期染病,植株上部新叶表现症状,结果量减少,果实变小,失去市场价值。
番茄黄化曲叶病毒(Tomatoyellowleafcurl virus,TYLCV)是引起全球各地番茄黄化曲叶病的主要病原之一。该病毒属双生病毒科(Geminiviri-dae)菜豆金色花叶病毒属(Begomovirus)成员,其基因组仅含A 组分(DNA-A),为单链环状;该病毒由烟粉虱以持久方式传播,同时可经嫁接传播,不能经机械摩擦或种子传毒;其寄主有番茄、曼陀罗、辣椒、菜豆、烟草等[2]。TYLCV 最先在以色列发现,之后随着烟粉虱在全球范围暴发而蔓延至中东、地中海沿岸、非洲、美洲、澳洲和亚洲等多个国家和地区[3]。2006年,该病毒传入我国上海[4],之后在浙江、江苏、安徽、山东、河北、天津及北京等多个省市发生,造成严重损失[5-15]。2014年春季,湖北省武汉市田间番茄病株表现出严重的黄化、曲叶症状,疑似感染了双生病毒。为了明确引起湖北省武汉市番茄黄化曲叶病的病原种类,笔者对6份病样进行了病原分子鉴定,对代表分离物的全基因组进行了克隆及序列分析。
1 材料与方法
1.1 供试样品
6份疑似番茄黄化曲叶病的病叶片(编号分别为HB01~06)采自湖北省武汉市一个试验大棚,病株表现为植株矮缩,叶片皱缩、叶缘黄化;3 份阳性样品为本实验室通过农杆菌介导TYLCV 侵染性克隆注射接种发病的番茄叶片;2 份阴性样品为本实验室保存的健康番茄叶片。
1.2 供试番茄样品总DNA 提取
利用CTAB方法[16]提取各供试番茄叶片组织的总DNA。
1.3 PCR 检测
利用菜豆金色花叶病毒属病毒通用简并引物AV 494/CoPR[17-18],对11份供试样品进行PCR检测。
1.4 RCA扩增及酶切分析
随机挑取PCR 检测为阳性的病样HB01 和HB02总DNA,分别取1.0μL 为模板,利用TempliPhiTMRCA Kit(GE Healthcare)进行滚环扩增(rolling circle amplification,RCA),以获得病毒的全基因组。具体方法按照试剂盒说明书上的步骤进行。
RCA 反应结束后,扩增产物分别用BamH I、Hind Ⅲ、PstI限制性内切酶进行酶切。酶切反应体系为:RCA 产物2μL、内切酶1μL、10×内切酶缓冲液1μL,总酶切反应体系为10μL。在37 ℃条件下酶切2h以上,然后进行电泳分析。若某个内切酶的酶切产物为2.5~3.0kb,或同时还产生1.3 kb左右的条带,则克隆这些特异性条带。
1.5 序列分析
利用DNAStar 软件(DNASTAR Inc,Madison,USA)进行序列拼接,利用BLAST 程序进行序列相似性搜索,进一步用DNAStar的MegAlign进行序列比较分析,进化树构建采用MEGA 5.05 的邻接法(neighbor joining,NJ)。
2 结果与分析
2.1 PCR 检测结果
利用菜豆金色花叶病毒属病毒特异简并引物AV494和CoPR 进行PCR 检测,从6份表现黄化、曲叶症状的番茄病样(编号分别为HB01~06)总DNA 中均扩增到1条与阳性对照大小一致的特异片段,长度为570bp,而健康植株样品总DNA 中未扩增出任何片段(见图1)。表明6份样品中均含有菜豆金色花叶病毒属病毒。
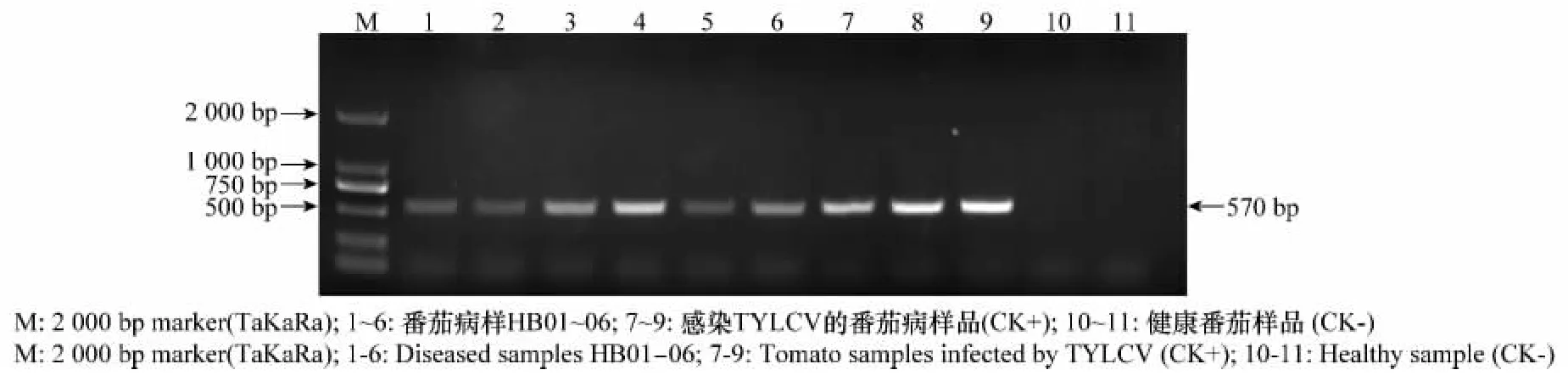
图1 番茄样品PCR 检测结果Fig.1 PCR detection result of tomato samples
2.2 病毒分离物基因组的克隆与序列分析
选取病样HB01 和HB02 的总DNA 分别进行RCA 和酶切反应,结果显示,其RCA 产物均能被BamH I切出1条约2.7kb大小的单一条带。克隆和序列测定结果表明,这2 个片段序列全长均为2 781nt,且两者的序列同源率为99.8%,即为病毒分离物DNA-A的全基因组。以HB01的全长序列代表该病毒分离物基因组,其GenBank登录号为KJ850344。
病毒分离物HB01的基因组全长序列具有单组分菜豆金色花叶病毒属成员基因组DNA-A 的典型特征,为单链闭合环状,推导编码6个ORFs。基因组病毒链含AV1基因(308~1 084nt,编码CP)和AV2基因(148~498nt,编码与病毒移动相关蛋白),互补链含有AC1基因(1 542~2 615nt,编码复制酶)、AC2基因(1 226~1 633nt,转录激活蛋白)和AC3基因(1 081~1 485nt,编码复制增强蛋白)和AC4基因(2 171~2 464nt)。在AV2与AC1之间有一个313nt的非编码区(位于2 616~147nt),其中含有与双生病毒复制起始有关的保守序列TAATATTAC[19](位于2 775~2nt)。
BLAST结果显示,与HB01DNA-A 序列有较高同源性的序列均为TYLCV 分离物DNA-A。进一步比较结果显示,HB01DNA-A与来自中国不同地区的TYLCV分离物的同源性均在97%以上,其中与来自上海(TYLCV-SH2,AM282874)、浙江(TYLCV-ZJ3,AM698117)和安徽(TYLCV-AH-HB1,FN650807)3个分离物DNA-A的同源性最高,均为99.4%。
为了分析病毒分离物HB01与已报道的各TYL-CV 分离物的亲缘关系,本文选取了来自我国不同地区的12 个分离物以及国外不同国家来源的19 个TYLCV 代表分离物,以我国台湾番茄曲叶病毒白沙分离物(TomatoleafcurlTaiwanvirus,ToLCTWV,DQ237918)为外组构建系统进化树。从该系统进化树(图1)可以看出,HB01与来自中国不同地区的12个分离物及国外的11个分离物亲缘关系较近,聚在一个分支,进一步与来自科威特的KISR分离物形成一个大的分支;而与日本Mild[Tokai]分离物、西班牙Mild[Spain7297]分离物、留尼汪岛分离物、日本Sz分离物、阿巴代分离物、伊朗分离物及阿曼Tom-48分离物等7个分离物的亲缘关系相对较远。
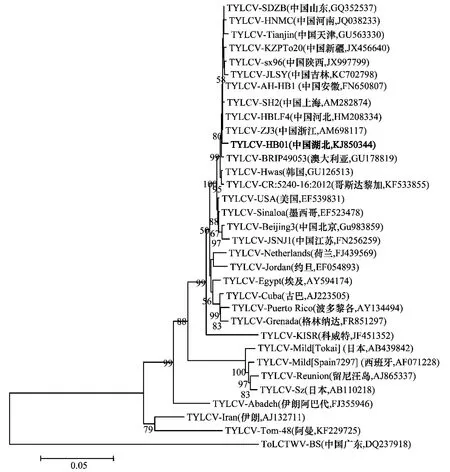
图2 HB01与其他31个TYLCV分离物的系统进化树Fig.2 Phylogenetic tree of HB01and 31isolates of TYLCV
3 讨论
虽然番茄黄化曲叶病已在我国上海、浙江、江苏、安徽、山东、河北、河南、天津、北京、吉林、陕西、广东、广西、福建、海南、云南、新疆、宁夏、重庆、辽宁、甘肃、四川等20多个省(市、自治区)相继发生,但对于湖北来说还是一个新病害。本文应用RCA 方法从来自湖北的番茄病样中扩增获得病毒分离物HB01的全基因组序列,该序列与国际上已报道的TYLCV各分离物同源性均在89%以上,其中与来自我国其他地区的TYLCV 分离物的同源率均在97%以上。因此,根据目前国际双生病毒分类方案[2],确定侵染湖北番茄的病毒分离物HB01属于TYLCV的一个分离物,这是首次在湖北省检测到该病毒。
自2006年Wu等[4]首次报道TYLCV入侵我国以来,该病毒已扩散到我国20多个省(市、自治区),并造成严重损失。本研究通过比较病毒分离物基因组序列发现,我国各地分离物的同源性在97%以上。这说明:虽然该病毒入侵我国将近10年,但其种群的遗传依然比较稳定。当然,由于该病毒在田间与其他双生病毒存在复合侵染[20],TYLCV是否会与其他病毒进行重组产生新株系或新病毒,还需要进一步监测。
近年来,湖北番茄栽培面积呈扩大趋势,尤其是高山番茄,市场效益好,发展迅速,面积逐年扩大,现已成为湖北省高山蔬菜高效栽培的主要品种之一。本研究首次在湖北番茄上发现番茄黄化曲叶病疫情,说明该病毒也开始入侵到湖北省,应引起有关部门和生产者的重视。积极采取有效的防范措施,预防与控制该病在湖北省传播、扩散和流行。
[1]Hanssen I M,Lapidot M,Thomma B P H J.Emerging viral diseases of tomato crops[J].Molecular Plant-Microbe Interactions,2010,23:539-548.
[2]Fauquet C M,Briddon R W,Brown J K et al.Geminivirus strain demarcation and nomenclature[J].Archives of Virology,2008,153:783-821.
[3]Moriones E,Navas-Castillo J.Tomatoyellowleafcurlvirus,an emerging virus complex causing epidemics worldwide[J].Virus Research,2000,71:123-134.
[4]Wu J B,Dai F M,Zhou X P.First report ofTomatoyellowleaf curlvirusin China[J].Plant Disease,2006,90(10):1359.
[5]宋晰,师迎春,张世晨,等.北京地区番茄黄化曲叶病病毒分离物测定及株系的初步鉴定[J].植物病理学报,2013,43(2):113-119.
[6]周莹,李兴红,刘建华,等.河北省番茄黄化曲叶病毒病的分子鉴定初报[J].植物保护,2010,36(1):60-64.
[7]王祥,李刚,赵黎明,等.吉林番茄黄化曲叶病毒分离物的检测及其DNA-A全基因组序列分析[J].植物保护,2014,40(2):76-80.
[8]阮涛,杨会房,杨水英,等.分离陕西泾阳番茄的番茄黄化曲叶病毒(TYLCD)的分子特征[J].农业生物技术学报,2013,21(1):97-105.
[9]金凤媚,薛俊,郏艳红,等.天津地区番茄黄化曲叶病毒DNA-A的克隆和序列分析[J].华北农学报,2011,26(1):58-62.
[10]于云奇,阮涛,杨水英,等.河南省番茄黄化曲叶病病原分子鉴定及全基因组序列分析[J].西南大学学报(自然科学版),2014,36(1):13-17.
[11]袁伟,万红建,王荣青,等.浙江省番茄黄化曲叶病毒的分子鉴定及序列分析[J].分子植物育种,2013,11(2):185-192.
[12]季英华,熊如意,程兆榜,等.江苏省番茄黄化曲叶病的病原分子诊断[J].园艺学报,2008,35(12):1815-1818.
[13]王喜刚,黄家风,都业娟.南疆温室番茄黄化曲叶病病毒种类的分子鉴定[J].植物保护学报,2013,40(3):237-242.
[14]褚栋,侯丽霞,刘国霞,等.山东省局部地区番茄黄化曲叶病毒的分子鉴定[J].山东农业科学,2010(2):13-15,19.
[15]余文贵,赵统敏,杨玛丽,等.山东、安徽两省栽培番茄烟粉虱传双生病毒的PCR 检测及序列分析[J].江苏农业学报,2009,25(4):747-751.
[16]Doyle J J,Doyle J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[17]Wyatt S D,Brown J K.Detection of subgroup Ⅲgeminivirus isolates in leaf extracts by degenerate primers and polymerase chain reaction[J].Phytopathology,1996,86(12):1288-1293.
[18]何自福,虞皓,罗方芳.番茄烟粉虱传双生病毒PCR 检测[J].中国病毒学,2004,19(1):67-69.
[19]Hanley-Bowdoin L,Settlage S B,Orozco B M,et al.Geminiviruses:models for plant DNA replication,transcription,and cell cycle regulation[J].Critical Reviews in Biochemistry and Molecular Biology,2000,35(2):105-140.
[20]张辉.侵染我国番茄双生病毒种类鉴定及致病性分析[D].杭州:浙江大学,2009:1-123.

