大蒜类似根缘细胞生物学特性及其对辣椒疫霉菌的抑制活性
廖静静,张立猛,张潇丹,郑 祥,3,焦永鸽,何霞红,朱书生,杨 敏*
(1.云南农业大学,农业生物多样性与病虫害控制教育部重点实验室,昆明 650201;2.云南省烟草公司玉溪市公司,玉溪 653100;3.云南省昭通市林业有害生物监测检验中心,昭通 657000)
辣椒疫霉菌(PhytophthoracapsiciLeonian)侵染辣椒引起的辣椒疫病是生产上一种难以防治的土传卵菌病害[1]。实践表明,利用作物轮作或间作是控制土传病害的重要方式之一[2-3],尤以利用葱属作物进行轮作或间作对土传病害的控制效果最为明显[4-6]。利用作物轮作或间作能控制土传病害可能与作物释放的化感物质对土传病菌的抑制作用有关。
研究表明,植物产生的化感物质可以通过地上部挥发、雨雾淋溶、根分泌、残体降解、种子和花粉等途径释放到环境中起作用[7]。其中根分泌是植物释放化感物质到根际土壤的主要途径,这些分泌物直接与土壤中微生物互作,为土壤微生物提供碳源、氮源和能量的同时也对某些病原真菌、细菌和线虫等具有抑制活性,从而在一定程度上达到控制土传病害的效果[8-13]。根系分泌物分为渗出物、分泌物、植物黏液、胶质和裂解物,其中也包含释放的健康组织有机物和衰老表面细胞和细胞内含物的分解产物等[14]。目前人们对葱属作物组织提取液及根系分泌物中的抑菌活性成分研究较多[15-17],但对根冠细胞脱落物及其对病原菌的抑制作用研究较少。
植物根冠细胞脱落物包括根缘细胞(border cells,BCs)和类似根缘细胞(border-like cells,BLCs)[18]。目前研究表明,BCs在脱离植物根冠之后,仍然具有多种生物学功能,例如能减少植物根系生长过程中与土壤的摩擦作用[19];BCs分泌物能螯合土壤中的铝离子,使植物免受铝危害等[20-22];BCs还能分泌产生一些蛋白、酶或抑菌活性物质等,帮助植物抵抗病原微生物的侵染[23-24];豌豆的BCs会分泌产生大量的豌豆素,保护根尖区域免受根腐丝囊霉(AphanomyceseuteichesDrechsler)的侵染[25]。目前,对葱属作物根冠细胞脱落物的种类及其是否对病原菌具有抑制活性还鲜有报道。
本文以大蒜为研究对象,分析大蒜根冠细胞脱落物的类型及其产生条件,并深入研究细胞脱落物水培液对辣椒疫霉菌的抑菌活性,以期为利用大蒜和辣椒轮作或间作控制辣椒疫病提供理论支撑。
1 材料与方法
1.1 供试菌株和植物材料
供试辣椒疫霉菌株C-1:由中国农业大学种子病理与药理实验室提供。
供试植物材料:白蒜蒜瓣,购于农贸市场。
1.2 大蒜离体根的培养
试验参照Brigham 等[23]和Hawes等[26]的 方法,略有改动。将蒜瓣去皮,2.5%次氯酸钠溶液表面消毒20min,无菌水冲洗3次。在直径15cm 的培养皿中倒入100mL 2%水琼脂,冷凝后铺一层无菌滤纸,将表面消毒后的蒜瓣依次置于滤纸片上,每皿10~12个蒜瓣。20℃恒温培养箱中黑暗培养7d获得大蒜离体根。
1.3 大蒜BLCs细胞形态及在水中的动态分散过程
利用0.5mm 直径毛细管制成U 形槽(图1),然后置于载玻片上,将大蒜离体根放置在U 形槽中,加盖盖玻片,从加液口向U 形槽中加满无菌水,利用蔡司倒置荧光显微镜分别在30、60、120、180、240、300s拍照,得到大蒜BLCs在水中随时间分散的动态情况。

图1 观察根尖BLCs在水中分散过程的装置Fig.1 The device for observing root border-like cell dispersion in water
细胞形态的观察:在U 形槽中加入无菌水稀释30 倍的Calcofluor 荧光染料染色细胞壁5~10min,在蔡司倒置荧光显微镜下利用紫外光激发后,观察细胞列(sheets of attached cells)。
1.4 大蒜BLCs最适产生条件的确定
为明确不同温湿度及根长对大蒜BLCs产生的影响,试验比较了6 个温度(10、15、20、25、30 和35 ℃)和3个水琼脂浓度(1.0%、1.5%和2.0%)条件下大蒜BLCs产生的差异。采用1.2小节的水琼脂法培养大蒜根系,培养7d后,取不同长度大蒜根(2、5、10、15、20、25 和30 mm)放置在U 形槽装置中,加无菌水,显微镜下观察根冠BLCs分散5 min后的面积,拍照记录,每处理10次重复。利用2mm×2mm 透明方格纸统计BLCs分散的面积,根据面积大小初步估计不同温度、水琼脂浓度和根长下BLCs产生及分散的情况。
1.5 大蒜BLCs水培液的制备
采用1.2小节的试验方法获得大蒜离体根。将根尖1cm 左右浸入无菌水中(最终浓度34根/mL),用移液枪将BLCs从根冠洗脱,再将细胞悬浮液10 000r/min离心1 min,弃上清液获得大蒜BLCs。大蒜BLCs用无菌水冲洗3次,最后加入200μL无菌水制成细胞悬浮液。将该悬浮液25 ℃培养0.5h和1h后取出,离心获得的上清液即为BLCs水培液。
1.6 大蒜BLCs水培液对辣椒疫霉抑菌活性的测定
1.6.1 BLCs水培液对孢子囊释放的影响
将上述培养不同时间后获得的BLCs水培液与孢子囊悬浮液(104个孢子囊/mL)各20μL滴加到凹玻片上混匀,20℃黑暗条件下保湿培养20min后在显微镜下观察空孢子囊的数量,以无菌水处理作为对照。每处理设置3次重复,共计数100个孢子囊,统计空囊率。空囊率(%)=(已释放孢子囊数目/100)×100。
1.6.2 BLCs水培液对游动孢子游动的影响
将BLCs水培液与游动孢子悬浮液(浓度为106个孢子/mL)各20μL滴加到凹玻片上混匀,在显微镜下观察共培养5、15、30、40min后游动孢子游动和休止的情况,以无菌水为对照,确定BLCs水培液对游动孢子游动的影响。
1.7 数据分析
采用Excel 2007和SPSS 17.0分析数据。
2 结果与分析
2.1 大蒜BLCs细胞类型
大蒜根冠细胞脱落物不能完全分散成单个细胞,除根冠顶端的椭圆和长椭圆形细胞彼此分散外(图2a、d),根冠两侧的长形细胞都彼此粘连,形成细胞列(sheets of attached cells)[27](图2a、b和c)。这些细胞彼此粘连与拟南芥及十字花科植物的类似根缘细胞(BLCs)的特征相近[27],因此,确定大蒜根冠细胞脱落物为类似根缘细胞(BLCs),主要由根冠顶端的椭圆和长椭圆形细胞和根冠两侧的长形细胞组成。

图2 大蒜根尖BLCs细胞类型Fig.2 Cell types of garlic root border-like cells
2.2 大蒜BLCs在水中的动态分散过程
试验结果表明(图3),大蒜根尖浸入水中后,BLCs在1min内开始迅速分散,5min时细胞已经扩展较完全。不同层面的细胞逐渐铺开,在根冠周围形成细胞列或分散的单个细胞。

图3 大蒜BLCs在水中动态分散过程Fig.3 The dynamic dispersion process of garlic border-like cells in water
2.3 大蒜BLCs产生最适条件的确定
2.3.1 温度和水琼脂浓度对大蒜根系生长的影响
试验结果表明(表1),温度是影响大蒜生根率的主要因素。15 ℃和20 ℃时大蒜生根率差异不显著,20 ℃最适于大蒜根系的生长。随着温度的升高和降低,大蒜生根率都逐渐降低,高温比低温更不适宜大蒜根系的生长。在供试的3个水琼脂浓度条件下,水琼脂浓度越高,越不适宜大蒜根系的生长。
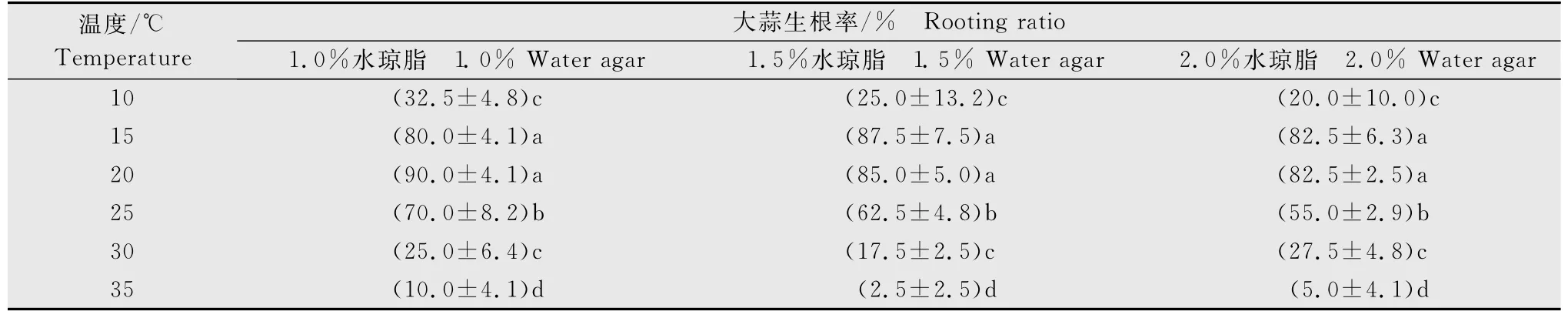
表1 不同温度和水琼脂浓度下大蒜生根率1)Table 1 The garlic rooting rate at different temperatures and water agar concentrations
同一水琼脂浓度下,不同温度对每一蒜瓣的生根数量影响显著(表2),20 ℃时每一蒜瓣的生根数最多,35 ℃时生根数最少。温度偏高或偏低时,蒜瓣生根数逐渐减少,高温对每一蒜瓣生根数的影响较低温更显著。同一温度条件下,不同水琼脂浓度对每一蒜瓣的生根数影响不显著。

表2 不同温度和水琼脂浓度条件下每一蒜瓣的生根数1)Table 2 The number of roots on each garlic bulb at different temperatures and water agar concentrations
2.3.2 温度、水琼脂浓度和根长对BLCs产生的影响
试验结果表明,不同温度、水琼脂浓度和根长组合对大蒜BLCs的分散面积存在不同的影响,根长和温度或湿度的二因素组合,以及根长、温度和湿度的三因素组合对BLCs的产生表现显著影响,而温度和湿度的两因素组合对BLCs的产生无明显影响(表3,4)。由此推测根长是影响大蒜BLCs产生的主导因素。

表3 不同温度和水琼脂浓度及根长下BLCs分散面积1)Table 3 The dispersion areas of garlic root border-like cells in water at different temperatures,water agar concentrations and root lengths

表4 不同温度、水琼脂浓度和根长组合对大蒜BLCs产生影响的多因素方差分析1)Table 4 Multivariate analysis of the influences of different combinations with temperature,water agar concentration and root length on the production of garlic BLCs

续表4 Table 4(Continued)
多重比较结果可以看出,在20 ℃、2.0%水琼脂浓度和根长25~30 mm 条件下,更利于大蒜BLCs的产生。温度过高或过低,水琼脂浓度较低且根长较短的条件下,均不利于大蒜BLCs的产生。
2.4 大蒜BLCs对辣椒疫霉的抑制活性分析
试验结果表明(表5,6),大蒜BLCs水培液对辣椒疫霉游动孢子游动和孢子囊释放的抑制活性随其在水中培养时间的增加而增强。培养1h后获得的水培液对孢子囊释放的抑制活性为27.83%,处理游动孢子40 min 后对其游动的抑制活性达到了70%以上。

表5 大蒜BLCs水培液对辣椒疫霉游动孢子游动的影响1)Table 5 The effect of garlic border-like cells hydroponic solution on zoospores swimming of Phytophthora capsici

表6 大蒜BLCs水培液对辣椒疫霉孢子囊释放的影响1)Table 6 The effects of hydroponic solution of garlic border-like cells on the release of zoospores from sporangia
3 讨论
3.1 大蒜根冠细胞脱落物为BLCs
据文献报道,高等植物根冠细胞脱落物类型主要有根缘细胞(BCs)和类似根缘细胞(BLCs)两种。Hawes认为根缘细胞是从高等植物根尖分离出来,遇水形成细胞悬浮液的一类细胞[28]。但Vicré等的研究表明,拟南芥产生的根缘细胞彼此粘连呈细胞列,遇水后不能分散成单独的细胞;其他的十字花科植物,如油菜(Brassicanapus)、甘蓝(Brassicaoleracea)和白芥(Sinapisalba)的根产生的细胞也都与拟南芥产生的细胞相似,因此将这类细胞命名为类似根缘细胞(BLCs)[29]。Driouich等总结了不同植物根冠细胞脱落物的类型,其中葱属作物小葱(Alliumschoenoprasum)产生BLCs,细胞形态为圆形,根冠两侧细胞为长形[30]。本试验的结果表明,大蒜根冠细胞脱落物遇水不能完全分散成单个细胞,且细胞形态主要为椭圆、长椭圆形和长形细胞。椭圆和长椭圆形细胞主要从根顶端分散出来,为单个的细胞,长形细胞主要从根冠两侧分散出来,一般呈细胞列排列。因此,大蒜根冠细胞脱落物为类似根缘细胞。
3.2 BCs和BLCs的产生受多种因素影响
研究表明,植物根尖BCs和BLCs的产生受多种因素的影响,包括植物种类、土壤类型、根系与土壤的物理摩擦、温度、根长、二氧化碳浓度、金属铝和硼等元素、土壤中微生物和自由水等[31]。文献报道,植物根系的生长和BCs或BLCs的产生对温度都比较敏感。Hawes和Pan的试验证明,温度过高或过低都能显著影响根系的生长和BCs的产生,在一定温度范围内,BCs能随着温度的升高而数目增多;根长也是影响BCs产生的重要因素,当根长达到一定长度后,BCs数目达到最大值,根长再增长,BCs数目不变。大豆和大麦根尖BCs的数目在根长25mm 时达到最大值[22,26]。而Vicré对BLCs的 研究发现,拟南芥随着幼苗生长5、7 和13d,根尖BLCs形成的细胞层数不同,但并没有具体的统计数据[29]。本试验研究表明,温度是影响大蒜根系生长的主要因素之一,高温和低温都不适宜大蒜根系的生长,20 ℃为其生长的最适温度。根长是影响大蒜BLCs产生的最重要的因素,20 ℃、2.0%水琼脂浓度条件下,BLCs随根长增长而增多。
3.3 大蒜BLCs水培液对辣椒疫霉菌具有一定的抑菌活性
据文献报道,植物BCs具有很强的分泌活性,能分泌蛋白、酶、抗菌物质,帮助植物抵抗病原菌侵染,免受铝毒危害等。Wen的试验结果表明大豆BCs在水中培养1h后能产生一种蛋白,帮助豌豆根尖抵抗茎基腐病菌(N.haematococca)的侵染[24]。因此,植物BCs很强的分泌物活性能调节或抑制土壤中病原微生物对根系的侵染,保护植物的健康生长。而有关BLCs细胞能否分泌活性物质还鲜有报道。Vircé证明拟南芥BLCs细胞中具有大量高尔基体,因此也具有很强的分泌活性,能分泌大量的果胶、阿拉伯半乳聚糖蛋白到细胞壁中,阿拉伯半乳聚糖能帮助BLCs与根瘤菌YAS34之间的识别并相互结合[29]。在本试验中,大蒜BLCs水培液对辣椒疫霉菌游动孢子游动和孢子囊释放具有较强的抑制活性,但BLCs水培液中的抑菌活性物质的结构和特性仍需要进一步探索。
综上所述,大蒜根系在生长过程中能产生类似根缘细胞,这些细胞也能分泌抑菌物质抑制辣椒疫霉菌的生长,表明类似根缘细胞也是大蒜释放抑菌物质的途径之一。该研究结果对利用大蒜轮作或间作控制土传病害具有指导意义。
[1]王中武,高月平.辣椒疫病药剂筛选试验[J].吉林农业科学,2013,38(4):44-45.
[2]Tang Dongsheng,Wang Bin,Mao Zhongshun,et al.Prelimi-nary study on garlic root exudates influences to the growth of pomegranate wilt pathogen(Ceratocystisfimbriata)andBacillussubtilis[J].Agricultural Science & Technology,2011,12(2):237-240.
[3]孙雁,周天富,王云月,等.辣椒玉米间作对病害的控制作用及其增产效应[J].园艺学报,2006,33(5):995-1000.
[4]金杨秀,谢关林,孙祥良,等.大蒜轮作与瓜类枯萎病发病的关系[J].上海交通大学学报(农业科学版),2003,21(1):9-12.
[5]甄洁,张桂玲,朱信涵,等.西瓜无公害生产的病虫害防治技术[J].农技服务,2007,24(7):54-55.
[6]向青松,钟亚霖,彭军,等.农业生物多样性控制烟草病虫害[J].中国农学通报,2010,26(2):208-211.
[7]张学文,刘亦学,刘万学,等.植物化感物质及其释放途径[J].中国农学通报,2007,23(7):295-297.
[8]Ren L X,Su S M,Yang X M,et al.Intercropping with aerobic rice suppressed fusarium wilt in watermelon[J].Soil Biology and Biochemistry,2008,40(3):834-844.
[9]Zewde T,Fininsa C,Sakhuja P K,et al.Association of white rot(Sclerotiumcepivorum)of garlic with environmental factors and cultural practices in the North Shewa highlands of Ethiopia[J].Crop Protection,2007,26(10):1566-1573.
[10]Abdel-Monaim M F,Abo-Elyousr K A M.Effect of preceding and intercropping crops on suppression of lentil damping-off and root rot disease in New Valley,Egypt[J].Crop Protection,2012,32:41-46.
[11]Park S,Takano Y,Matsuura H,et al.Antifungal compounds from the root and root exudates ofZeamays[J].Bioscience Biotechnology and Biochemistry,2004,68(6):1366-1368.
[12]Michel V V,Wang J F,Midmore D J,et al.Effects of intercropping and soil amendment with urea and calcium oxide on the incidence of bacterial wilt of tomato and survival of soilbornePseudomonassolanacearumin Taiwan[J].Plant Pathology,1997,46(4):600-610.
[13]Dong L,Li X,Huang L,et al.Lauric acid in crown daisy root exudates potently regulates root-knot nematode chemotaxis and distrupts Mi-flp-18expression to block infection[J].Journal of Experimental Botany,2013,65:131-141.
[14]Kuzyakov Y.Review:Factors affecting rhizosphere priming effects[J].Journal of Plant Nutrition and Soil Science,2002,165(4):382-396.
[15]张伟,廖静静,朱贵李,等.8种植物挥发物和浸提液对三七根腐病菌的抑制活性研究[J].中国农学通报,2013,29(30):197-201.
[16]廖静静,刘屹湘,杨敏,等.大蒜挥发物和浸提液对辣椒疫霉菌的抑菌活性分析[J].云南农业大学学报,2014,29(3):337-346.
[17]张万萍,赵丽.大蒜提取物和根系分泌物对3种土传性病原菌的抑菌效果[J].中国蔬菜,2012(2):66-71.
[18]Curlango-Rivera G,Huskey D A,Mostafa A,et al.Intraspecies variation in cotton border cell production:Rhizosphere microbiome implications[J].American Journal of Botany,2013,100(9):1706-1712.
[19]Bengough A G,McKenzie B M.Sloughing of root cap cells decreases the frictional resistance to maize(ZeamaysL.)root growth[J].Journal of Experimental Botany,1997,48(4):885-893.
[20]Tamás L,BudíkováS,HuttováJ,et al.Aluminum-induced cell death of barley-root border cells is correlated with peroxidase-and oxalate oxidase-mediated hydrogen peroxide production[J].Plant Cell Reports,2005,24(3):189-194.
[21]Miyasaka S C,Hawes M C.Possible role of root border cells in detection and avoidance of aluminum toxicity[J].Plant Physiology,2001,125(4):1978-1987.
[22]Pan J W,Ye D,Wang L L,et al.Root border cell development is a temperature-insensitive and Al-sensitive process in barley[J].Plant &Cell Physiology,2004,45(6):751-760.
[23]Brigham L A,Woo H H,Nicoll S M,et al.Differential expression of proteins and mRNAs from border cells and root tips of pea[J].Plant Physiology,1995,109(2):457-463.
[24]Wen F S,VanEtten H D,Tsaprailis G,et al.Extracellular proteins in pea root tip and border cell exudates[J].Plant Physiology,2007,143(2):773-783.
[25]Cannesan M A,Gangneux C,Lanoue A,et al.Association between border cell responses and localized root infection by pathogenicAphanomyceseuteiches[J].Annals of Botany,2011,108(3):459-469.
[26]Hawes M C,Lin H J.Correlation of pectolytic enzyme activity with the programmed release of cells from root caps of pea(Pisumsativum)[J].Plant Physiology,1990,94(4):1855-1859.
[27]Driouich A,Durand C,Cannesan M A,et al.Border cells versus border-like cells:are they alike?[J].Journal of Experimental Bortany,2010,61(14):3827-3831.
[28]Hawes M C,Bengough G,Cassab G,et al.Root caps and rhizosphere[J].Journal of Plant Growth Regulation,2002,21(4):352-367.
[29]VicréM,Santaella C,Blanchet S,et al.Root border-like cells of Arabidopsis.Microscopical characterization and role in the interaction with rhizobacteria[J].Plant Physiology,2005,138(2):998-1008.
[30]Driouich A,Cannesan M A,Dardelle F,et al.Unity is strength:The power of border cells and border-like cells in relation with plant defense[C]∥Vivanco J M,Baluška F,eds,Secretions and exudates in biological system,signaling and communication in plants.Springer-Verlag Berlin Heidelperg,2012:91-107.
[31]Odell R E,Dumlao M R,Samar D,et al.Stage-dependent border cell and carbon flow from roots to rhizosphere[J].American Journal of Botany,2008,95(4):441-446.

