云南切梢小蠹超氧化物歧化酶基因的克隆与序列分析
赵琰明,朱家颖,泽桑梓,赵 宁,杨 斌*
(1.西南林业大学云南省森林灾害预警与控制重点实验室,昆明 650224;2.云南省林业职业技术学院,昆明 650224)
生物体在生命活动过程中,特别是在逆境胁迫条件下会产生多种活性氧(reactive oxygen species,ROS),如超氧阴离子自由基、单线态氧、过氧化氢和羟自由基等[1]。这些活性氧具有很强的氧化能力,当他们在生物体内过量积累时可造成机体蛋白质、脂质、DNA 及其他细胞组分的严重损伤,对生物体有很大危害[2]。超氧化物歧化酶(SOD)广泛存在于生物体各组织,在机体抗氧化和免疫过程中起着重要作用。它与过氧化氢酶以及过氧化物酶共同组成了保护酶系统[3]。当机体内活性氧大量积累时,SOD 就会被大量诱导生成,催化活性氧发生歧化反应,生成水和过氧化氢[4]。它是唯一能够特异性清除超氧阴离子自由基的抗氧化酶,平衡机体的氧自由基,从而起到保护机体的作用[5-6]。超氧化物歧化酶按照金属辅基主要分为Fe-SOD、Mn-SOD 和Cu/Zn-SOD 3种,其中铜锌超氧化物歧化酶在生物体内分布相对广泛,也是目前为止研究最多的超氧化物歧化酶[7]。已有研究表明铜锌超氧化物歧化酶在生物体内有胞内形式(icCu/Zn-SOD)和胞外形式(ec-Cu/Zn-SOD)两种[8]。
云南切梢小蠹(Tomicusyunnanensis)是鞘翅目(Coleoptera)小蠹科(Scolytidae)切梢小蠹属(Tomicus)严重为害多种松树的次期性蛀干害虫[9-10]。该害虫入侵寄主后寄主会分泌树脂以抵御其入侵,但如果云南切梢小蠹的群集足够快速或者寄主本身长势比较衰弱,寄主最终会由于其抵御机制耗尽而被入侵者杀死[11-12]。对于寄主的抵御反应,云南切梢小蠹也有自己的防御机制,而且是通过调控自身防御相关基因实现的。因此,对云南切梢小蠹超氧化物歧化酶基因进行克隆分析有助于从分子水平阐释云南切梢小蠹在受到寄主抵御时自身的防御机制。本研究利用RACE 技术,首次克隆了云南切梢小蠹Cu/Zn-SOD cDNA 全长序列并进行初步分析,为探索在受到寄主抵御时云南切梢小蠹的自身防御机制提供一些基础资料。
1 材料与方法
1.1 材料
云南切梢小蠹采自云南省曲靖市沾益县九龙山林场。
1.2 方法
1.2.1 总RNA 的提取及RT-PCR
利用Trizol试剂(Invitrogen)提取云南切梢小蠹成虫总RNA。总RNA 经1%琼脂糖电泳分析其质量后,用分光光度计测定其含量。然后以提取的总RNA 为模板,用SMART RACE cDNA Amplification Kit(Clontech)试剂盒合成RACE cDNA模板。
1.2.2 SOD 基因克隆
从已构建的云南切梢小蠹转录组数据库中获得超氧化物歧化酶基因片段序列[13],根据其设计3′RACE 引 物(5′-GTTGGCTTGTGCTGTTATTGGACT-3′)和5′RACE引物(5′-GTACCACCTGGTTGACTGCTTCTTGCAGTA-3′),以合成的cDNA为模板克隆获得基因的3′和5′端序列。PCR 扩增条件为:94 ℃预变性3min;94 ℃变性30s,55 ℃退火30s,72 ℃延伸1 min,40 个 循环;72 ℃延伸10 min。PCR 扩增片段经1%琼脂糖凝胶电泳分离,用QIAquick-Gel Extraction Kit(Qiagen)回收PCR 产物,用TA 克隆法连接入pGEM®-T-easy载体(Promega),蓝白斑筛选,挑取阳性菌落进行克隆,由上海生工生物工程有限公司测序。然后将所得序列片段拼接得到cDNA 全长序列。
1.2.3 序列分析
利用NCBI上的open reading frame finder(ORF finder)搜索开放阅读框,GENETYX 软件将其翻译成氨基酸序列,并用Motifscan分析氨基酸序列中存在的结构域。利用ClustalX 1.83进行多序列比对分析,并利用MEGA 5.0软件构建NJ(neighborjoining)分子系统进化树。
1.2.4 实时荧光定量PCR
解剖云南切梢小蠹成虫分别获得新鲜的头、胸、腹、足、翅,用Trizol试剂提取获得相应部位的总RNA,并分别提取保存于-80 ℃冰箱的云南切梢小蠹幼虫、蛹、成虫的总RNA,然后将各样本总RNA定量至1μg,利用RevertAid First Strand cDNA Synthesis Kit(Thermo)反转录合成cDNA 模板。根据本次克隆获得的云南切梢小蠹SOD 基因序列设计用于荧光定量的正向引物(5′-CTGACGGAGTAGCCACGAT-3′)和反向引物(5′-ATAACAGCACAAGCCAACC-3′);根据华山松大小蠹和中欧山松大小蠹18SRNA 基因(GenBank 登录号分别为KJ507200和KJ531053)的保守序列设计正向引物(5′-TTCAAATGTCTGCCTTATC-3′)和反向引物(5′-GTGGTAGCCGTTTCTCA-3′)扩增获得云南切梢小蠹18SRNA 基因片段,以作为内参基因。实时荧光定量PCR 反应体系(10μL)为:cDNA 模板1μL,上下游引物各0.5μL,iTaqTMUniversal SYBR Green Supermix 5μL,双蒸水3μL。PCR 扩增程序为95℃预变性3min;95℃变性10s,55℃退火20s,然后读板,39个循环;最后以每5s上升0.5 ℃的速度从65~95 ℃记录熔解曲线,每个反转录样品重复3次。使用CFX96实时定量PCR仪(Bio-Rad,美国)进行检测。反应结束后,以18SRNA 为内参基因,用2-ΔΔCT 法分析云南切梢小蠹各发育阶段及不同部位SOD基因的相对转录水平[14]。
1.2.5 数据分析
不同发育阶段和不同部位的SOD 基因相对表达量数据利用SPSS软件进行One-way ANOVA 方差分析,多重比较采用Duncan法,P<0.05为差异显著。
2 结果与分析
2.1 序列分析
经过测序得到云南切梢小蠹SOD cDNA 序列全长为768bp,5′端非编码区80bp,3′端非编码区226bp,开放阅读框462bp。将其在GenBank中注册,登录号为KM278528。该基因推导的多肽序列为153个氨基酸(图1)。其推导的氨基酸序列预测理论分子量为15.8ku,等电点为5.68。Motifscan分析显示,该蛋白存在2个Cu/Zn-SOD 的特异序列(GFHIHEFGDNT42-52和GNAGGRLACAVI136-147),3个N-末端酰基化位点(NGTV14-17、NGSL30-33、NMTD96-99),1个酪蛋白激酶Ⅱ磷酸化位点(casein kinaseⅡphosphorylation site)(TDEE73-76),4个N-端酰基化位点(N-myristoylation site)(GSLKGL31-36、GCISAG54-59、GNIQAN83-88和GNAGGR136-141),2个蛋白激酶C磷酸化位点(protein kinase C phosphorylation site)(SLK32-34和TDK98-100),第1~151氨基酸区域具有铜锌超氧化物歧化酶超家族(copper/zinc superoxide dismutase superfamily)的保守结构域。

图2 云南切梢小蠹与其他昆虫SOD多序列比对Fig.2 Multiple alignment of SOD sequences fromTomicus yunnanensis and other insects
2.2 氨基酸序列相似性比对及进化树分析
同源性比对分析发现,云南切梢小蠹SOD 基因与中欧山松大小蠹(Dendroctonusponderosae)SOD基因在氨基酸水平上相似性高达93%,与赤拟谷盗(Triboliumcastaneum)也有71%的一致性。而与半翅目的点蜂缘蝽(Riptortuspedestris)、侵扰锥猎蝽(Triatomainfestans),膜翅目的丽蝇蛹集金小蜂(Nasoniavitripennis)、佛罗里达弓背蚁(Camponotusfloridanus),鳞翅目的柑橘凤蝶(Papilio xuthus)、棉铃虫(Helicoverpaarmigera),双翅目的黑果蝇(Drosophilavirilis)、家蝇(Muscadomestica)氨基酸序列一致性也均在67%~71%之间。多序列比对分析表明,不同物种甚至不同目的昆虫Cu/Zn-SOD 氨基酸序列存在多个高度保守区域。如图2所示,Cu、Zn与6个组氨酸(His)残基和1个天冬氨酸(Asp)配位,其中Cu原子分别与His44、His46、His61和His118配位,Zn原子分别与His61、His69、His78和Asp81配位。Cu、Zn共同连接His61组成“咪唑桥”结构。半胱氨酸Cys55和Cys144之间形成了Cu/Zn-SOD中唯一一对链内二硫键。
为了确定克隆获得的云南切梢小蠹SOD 与其他昆虫SOD 的系统进化关系,利用MEGA5.0将多序列比对所得结果用临位相连法(NJ)构建系统发育树。如图3所示,克隆获得的云南切梢小蠹SOD明显区别于Mn-SOD,与其他昆虫的Cu/Zn-SOD聚为一族,并且与icCu/Zn-SOD 聚在一起。
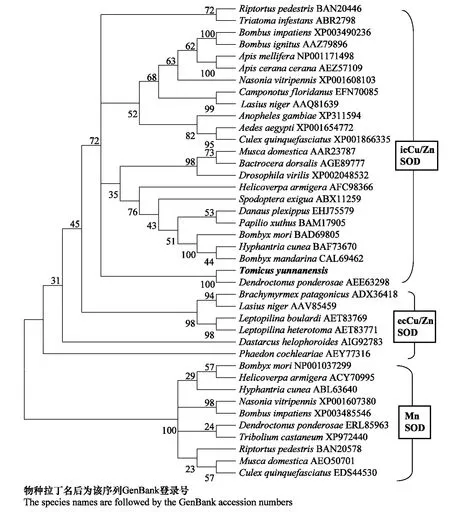
图3 云南切梢小蠹及其他物种SOD的系统发育树Fig.3 Phylogenetic tree of SODs fromTomicus yunnanensis and other insects
2.3 云南切梢小蠹SOD 基因在各发育阶段及不同部位的表达
由图4可以看出云南切梢小蠹SOD 基因在不同发育阶段均有表达,并且在蛹期相对表达量最高,显著高于幼虫期和成虫期。图5结果表明云南切梢小蠹SOD 基因在头、胸、腹、足、翅各个部位均有表达。其中SOD 基因在足部表达量最高,显著高于其他部位,在头部也有较高表达,也明显高于剩余3个部位。而在其胸部、腹部还有翅中的表达量相对都较低,并且在这3个部位中相对表达量差异不显著。

图4 云南切梢小蠹不同发育阶段SOD基因的相对表达量Fig.4 The relative expression levels of SOD gene in Tomicus yunnanensis at different developmental stages

图5 云南切梢小蠹不同部位SOD基因的相对表达量Fig.5 The relative expression levels of SOD gene in different parts of Tomicus yunnanensis
3 讨论
本研究利用RACE技术,克隆获得了云南切梢小蠹超氧化物歧化酶基因。该基因与其他昆虫SOD具有很高的相似性,这体现了不同昆虫超氧化物歧化酶在进化过程中的保守性。生物体内Cu/Zn-SOD又可分为icCu/Zn-SOD和ecCu/Zn-SOD,两者在催化歧化反应时有着相同的速率和相似的动力学常数。ecCu/Zn-SOD在N 端存在一小段信号肽,为分泌型蛋白,主要存在于组织外基质及细胞表面;icCu/Zn-SOD没有信号肽,主要存在于细胞质中[15]。通过在线软件分析发现,本次所得云南切梢小蠹SOD 基因推导的氨基酸序列并无信号肽和跨膜结构域,这些完全符合ic-Cu/Zn-SOD的结构特征。经系统发育树进一步分析表明,克隆所得的云南切梢小蠹SOD与icCu/Zn-SOD聚在一起。因此断定本研究得到的云南切梢小蠹SOD为icCu/Zn-SOD。
超氧化物歧化酶(SOD)被称为生物体抗氧化系统的第一道防线,其广泛存在于生物体各个发育阶段及不同的组织,在很多不同类型的细胞中均有表达[8]。云南切梢小蠹icCu/Zn-SOD 基因在其各个发育阶段均有表达,并且蛹期的表达量最高,与黄粉虫icCu/Zn-SOD在蛹期表达量最高一致,不过在黄粉虫幼虫中随着龄期的增加icCu/Zn-SOD 基因的表达量也增加,最终超过成虫[16]。意大利蜜蜂和中华蜜蜂SOD 基因在蛹期表达量最低[17-18],与本研究结果相反,这说明不同昆虫在不同发育阶段SOD 基因的相对表达量也不同,这可能与昆虫自身的生活习性和环境有关。本次研究发现云南切梢小蠹ic-Cu/Zn-SOD 基因在足部的表达量显著高于头、胸、腹、翅各部位。目前对于昆虫足部SOD 基因表达的相关研究较少,但已有研究表明蚌类不同组织中SOD表达强度虽然不同,却在斧足组织中表达最强,这与斧足的运动功能是相关的[19]。紫贻贝主要依靠闭壳肌实现其贝壳的开闭,是其主要的运动器官,因此其闭壳肌SOD含量较丰富[20]。云南切梢小蠹平时基本以足部爬行运动为主,极少飞行,这可能与其足部SOD基因的表达量相对较高有很大关系。
超氧化物歧化酶不仅在细胞防御活性氧机制中扮演着重要角色,同时在昆虫、脊椎动物甚至一些水产无脊椎动物发挥先天免疫功能中也起着重要的作用[21-22]。它们能增强昆虫对有毒化学物质、热压、杀虫剂还有一些微生物侵染的抵抗力[23],在昆虫生长发育和抗环境胁迫过程中起着巨大作用。在黄粉虫中,SOD 在血细胞里表达量相对较高,而在角质层和脂肪体中表达量相对较少,这可能是由于SOD参与免疫反应,而血细胞正是昆虫免疫系统的主要组成单元[16]。生命延续和抗逆性是生物体滞育期的两个最重要特征,研究发现超氧化物歧化酶在维持尖音库蚊越冬期生命体征以及增强自身抗逆性中发挥着重要的作用[24]。现在对于超氧化物歧化酶在寄主与寄生物相互作用过程中所起的作用已经有所研究。超氧化物歧化酶与由活性氧诱导的寄生虫致死有关,另外,寄生虫也能通过调控寄主的超氧化物歧化酶基因来满足自己的生存[25]。
[1]Davies M J,Dean R T.Radical-mediated protein oxidation:From chemistry to medicine[J].Quarterly Review of Biology,1999,74(1):114-115.
[2]Hermes-Lima M,Zenteno-Savin T.Animal response to drastic changes in oxygen availability and physiological oxidative stress[J].Comparative Biochemistry and Physiology,2002,133(4):537-556.
[3]Fridovich I.Oxygen is toxic![J].Bioscience,1997,27(7):462-466.
[4]唐婷,高一夫,刘艳娟,等.家蝇MdSOD3基因的鉴定及其在抵抗重金属胁迫中的作用[J].昆虫学报,2012,55(3):267-275.
[5]Mcord J M,Fridovich I.Superoxide dismutase:An enzymatic function of for erythrocuprein(Hemocuprein)[J].Journal of Biological Chemistry,1969,244(22):6049-6055.
[6]Bannister J V,Bannister W,Rotilio G.Aspects of the structure,function and applications of superoxide dismutase[J].CRC Critical Reviews in Biochemistry,1987,22(2):111-180.
[7]杨卫健,张双全.超氧化物歧化酶的研究及应用前景[J].淮阴师范学院学报,2002,1(4):82-86.
[8]Zelko I N,Mariani T J,Folz R J,et al.Superoxide dismutase multigene family:a comparison of the CuZn-SOD(SODl),MnSOD(SOD2),and EC-SOD(SOD3)gene structures,evolution,and expression[J].Free Radical Biology and Medicine,2002,33(3):337-349.
[9]Kirkendall L R,Faccoli M,Ye H.Description of the Yunnan shoot borer,TomicusyunnanensisKirkendall & Faccoli sp.n.(Curculionidae,Scolytinae),an unusually aggressive pine shoot beetle from southern China,with a key to the species ofTomicus[J].Zootaxa,2008(1819):25-39.
[10]Zhu J Y,Zhao N,Yang B.Global transcriptional analysis of olfactory genes in the head of pine shoot beetle,Tomicusyunnanensis[J].Comparative and Functional Genomics,doi:10.1155/2012/491748.
[11]Kier D K,Eugene B S,Kenneth F R.Combined chemical defenses against an insect-fungal complex[J].Journal of Chemical Ecology,1996,22(8):1367-1388.
[12]闫争亮.小蠹科害虫化学信息物质及其对侵害寄主等行为的影响[J].西部林业科学,2006,35(3):22-33.
[13]Zhu J Y,Zhao N,Yang B.Global transcriptome profiling of the pine shoot beetle,Tomicusyunnanensis(Coleoptera:Scolytinae)[J].PLoS ONE,2012,7(2):e32291.
[14]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[15]Lin Y,Vaseeharan B,Chen J,et al.Identification of the extracellular copper-zinc superoxide dismutase(ecCuZnSOD)gene of the mud crabScyllaserrataand its expression followingβ-glucan and peptidoglycan injections[J].Molecular Immunology,2008,45(5):1346-1355.
[16]Zhu J Y,Ze S Z,Stanley D W,et al.Parasitization bySclerodermaguaniinfluences expression of superoxide dismutase genes inTenebriomolitor[J].Archives of Insect Biochemistry and Physiology,2014,87(1):40-52.
[17]肖培新,吴在富,刘昭华,等.意大利工蜂不同发育时期抗氧化酶基因mRNA 表达量的变化[J].昆虫学报,2010,53(11):1202-1206.
[18]刘俊峰,刘亭亭,王欢,等.中华蜜蜂铜锌超氧化物歧化酶基因的克隆、序列分析及表达特征[J].动物营养学报,2012,24(8):1512-1519.
[19]韩庆,鲁密芳,张建平,等.池蝶蚌与三角帆蚌不同组织SOD 及EST 同工酶的比较研究[J].湖北农业科学,2013,52(15):3615-3618.
[20]刘慧慧,常抗美.紫贻贝4种同工酶的组织特异性表达研究[J].南方水产,2008,4(4):60-63.
[21]Ajonina E I,Ndjonka D,Tanyi M K,et al.Functional characterization and immune recognition of the extracellular superoxide dismutase from the human pathogenic parasiteOnchocercavolvulus(OvEC-SOD)[J].Acta Tropica,2012,124(1):15-26.
[22]Zhang D C,Cui S G,Guo H Y,et al.Genomic structure,characterization and expression analysis of a manganese superoxide dismutase from pearl oysterPinctadafucata[J].Developmental and Comparative Immunology,2013,41(4):484-490.
[23]Arbi M,Pouliliou S,Lampropoulou M,et al.Hydrogen peroxide is produced byE.colichallenged haemocytes and regulates phagocytosis,in the medflyCeratitiscapitata.The active role of superoxide dismutase[J].Developmental and Comparative Immunology,2011,35(8):865-871.
[24]Cheolho S,David L D.Catalase and superoxide dismutase-2 enhance survival and protect ovaries during overwintering diapause in the mosquitoCulexpipiens[J].Journal of Insect Physiology,2011,57(5):628-634.
[25]Bahia A C,Oliveira J H,Kubota M S,et al.The role of reactive oxygen species inAnophelesaquasalisresponse toPlasmodiumvivaxinfection[J].PLoS ONE,2013,8(2):e57014.

