单端孢菌素对几种作物病原菌的室内毒力及田间防效
杨佩文,番华彩,郭志祥,白亭亭,金桂梅,文孟良,李元广,曾 莉*
(1.云南省农业科学院农业环境资源研究所,昆明 650205;2.云南大学,昆明 650091;3.华东理工大学生物反应器工程国家重点实验室,上海 200237)
随着人类对环境、生态、安全、经济等的要求越来越高,研究开发具有良好生态行为、作用机理独特、高效、高选择性、结构新型的农药是人们追求的目标[1-2]。随着20世纪80年代生物技术的兴起,农药研究向生物与化学相结合的方向发展[3]。从天然产物中发掘生物活性化合物是新农药研究与开发的一个重要途径,包括直接从中发现农药活性化合物和对天然化合物的化学结构改造或分子修饰,进而研究开发全新结构的农药品种[4-5]。目前以天然产物为先导化合物开发的杀菌剂主要有乙蒜素、恶霉灵、肉桂酸衍生物(烯酰吗啉、氟吗啉)、吡咯类化合物(拌种咯、咯菌腈)、甲氧基丙烯酸酯类杀菌剂(嘧菌酯、啶氧菌酯)等[6]。以天然产物为先导化合物开发的杀虫、杀螨剂主要有氨基甲酸酯、拟除虫菊酯、沙蚕毒素类似物、吡咯类、新烟碱类、保幼激素类似物、双酰肼(蜕皮激素类似物)以及鱼藤酮类似物、二烯酰胺、螺螨酯、嘧螨酯、杀虫脒、灭螨醌等[7]。目前全世界应用的生物源农药品种约30种,仅Bt制剂一个品种的年销售额就达9.84亿美元,我国开发的井冈霉素至今仍然是防治水稻纹枯病的优秀农药品种[8-9]。一方面,我国是横跨热带和寒带的大国,幅员辽阔,地形多变,复杂的地形、地貌特征和气候条件孕育和保存了大量珍贵的生物资源,为人们从微生物和动植物有效成分中筛选先导化合物提供了极其有利的自然条件。另一方面,随着菌种分离、代谢产物的检测及结构鉴定技术的发展,为从天然产物中发现全新结构的先导化合物提供了有利基础[10-11]。
本项目组在开展云南山地香蕉根际和内生真菌分离及其次生代谢产物生物活性筛选过程中,获得一株对香蕉枯萎病菌具有强拮抗作用的真菌Cordana musaeAGR0073,并利用多种色谱分离技术和分离介质,结合常规化学方法,从菌株发酵液中分离纯化获得具有抗真菌活性的化合物单端孢菌素(trichothecin,TCN),这是首次从C.musae代谢产物中分离出该化合物。初步抑菌活性测定表明,单端孢菌素对香蕉枯萎病菌(Fusariumoxysporumf.sp.cubense)、香蕉炭疽病菌(Colletotrichummusae)、香蕉小窦氏叶斑病菌(Deightoniellatorulosa)等香蕉病原真菌具有良好的抑菌活性[12]。为进一步验证该化合物对一些主要作物病原真菌的抑菌活性,本研究采用孢子萌发抑制法、菌丝生长速率法和田间药效常规法,测定了其在不同质量浓度下的农用生物活性和田间防治效果,为该化合物的进一步开发和应用提供依据。
1 材料和方法
1.1 试验材料
1.1.1 供试药剂
化合物单端孢菌素由本试验室分离纯化获得。
1.1.2 供试病原菌
番茄灰霉病菌(Botrytiscinerea)、玫瑰灰霉病菌(B.cinerea)、百合灰霉病菌(B.elliptica)、三七黑斑病菌(Alternariapanax)、番茄早疫病菌(A.solani)、白菜黑斑病菌(A.brassicae)、百合炭疽病菌(Colletotrichumlilii)、辣椒炭疽病菌(C.capsici)、水稻恶苗病菌(Fusariummoniliforme)、香石竹枯萎病菌(F.oxysporum)、玉米茎腐病菌(F.graminearum)、马铃薯晚疫病菌(Phytophthorainfestans)、辣椒疫病病菌(P.capsici)、玉米小斑病菌(Bipolarismaydis)、玉米大斑病菌(Exserohilum turcicum)、水稻稻瘟病菌(Magnaporthegrisea),共16个作物病原真菌,由本实验室分离培养保存。
1.2 试验方法
1.2.1 最低抑制浓度测定[13]
1.2.1.1 分生孢子悬浮液和游动孢子悬浮液的制备
番茄灰霉病菌、玫瑰灰霉病菌、百合灰霉病菌、三七黑斑病菌、番茄早疫病菌、白菜黑斑病菌、百合炭疽病菌、辣椒炭疽病菌、水稻恶苗病菌、香石竹枯萎病菌、玉米茎腐病菌、玉米小斑病菌、玉米大斑病菌等13个病原菌由PSA 培养基培养,稻瘟病菌由燕麦培养基培养。待病原菌在培养基上长满菌丝后,用无菌水洗去气生菌丝,日光灯(400nm)照射下培养分生孢子,最后用无菌水洗下过滤得到分生孢子悬浮液。
马铃薯晚疫病菌和辣椒疫病病菌由黑麦A 培养基(RSA)培养,待菌丝长满后,加入2~3滴无菌水后用涂布器将菌丝均匀压平,放入温度25 ℃培养箱中24h培养孢子囊,最后用无菌水洗下孢子囊过滤并放入4~6 ℃冰箱2h释放游动孢子得到游动孢子悬浮液。
分生孢子悬浮液和游动孢子悬浮液浓度为10×10低倍镜下每个视野30~40个孢子为宜。
PSA 培养基:马铃薯200g,蔗糖15g,琼脂粉15g,蒸馏水1 000mL,pH 值自然。燕麦培养基:燕麦200g,蔗糖15g,琼脂粉15g,蒸馏水1 000mL,pH 值自然。黑麦A 培养基(RSA):黑麦60g,蔗糖20g,琼脂15g,蒸馏水1000mL,pH 值自然。
1.2.1.2 测定方法
采用凹玻片法测定单端孢菌素对供试病原真菌分生孢子和游动孢子最低抑制浓度(MIC)。将纯化获得的单端孢菌素用5%丙酮溶液配制成质量浓度为100mg/L的母液,置于4 ℃保存备用。
初步测定时,单端孢菌素浓度分别为20、40、60、80、100mg/L,无菌水和5%丙酮溶液为对照,每处理4次重复。测定体系为100μL,孢子悬浮液和化合物溶液各50μL等体积混合。将凹玻片在28℃培养18 h后,显微观察分生孢子和游动孢子生长情况,根据显微镜检结果,再分别逐步降低体系中单端孢菌素的浓度,能够完全抑制分生孢子和游动孢子萌发的最低药剂浓度即为MIC(即萌发率为0的最低药剂浓度)。
1.2.2 菌丝生长抑制测定
采用平皿生长速率法[14]测定供试样品对番茄灰霉病菌、番茄早疫病菌、辣椒炭疽病菌、水稻恶苗病菌、马铃薯晚疫病菌、玉米小斑病菌和水稻稻瘟病菌等7种病菌生长的抑制效果。
1.2.2.1 药剂配制
分别准确量取1 000μg/mL 的样品溶液10 mL,用无菌水倍比稀释8次,分别得到浓度为100、50、25、12.5、6.25、3.13、1.56、0.78mg/L 的溶液,用无菌水作对照。
1.2.2.2 测定方法
取各浓度药液10mL的分别倒入8瓶灭菌的培养基中(每瓶装有90 mL 培养基,药液分别被稀释10倍),混匀后将培养基倒入直径9cm 的培养皿,制成系列浓度梯度的含药培养平板,每种浓度5个重复。用直径5mm 的灭菌不锈钢打孔器在已长满菌丝的培养基上打孔。将菌丝块接种于含药平板中央,28 ℃培养。待对照平板上菌丝接近长满培养皿时,用十字交叉法(取菌落辐射生长长轴直径与短轴直径的平均值减去原菌丝块直径)测量菌落直径,计算药剂的菌丝生长抑制率。
抑制率(%)=(CK 菌落平均直径-处理菌落平均直径)/CK 菌落平均直径×100;
根据样品各浓度对数值(x)及对应的菌丝生长抑制率几率值(y)作回归分析,求出毒力回归方程(y=a+bx)和相关系数(r),根据回归方程计算出样品对病菌菌丝生长抑制的EC50和95%置信区间,以此表示样品对病菌抑制作用的强弱。
1.2.3 田间药效测定
分别开展单端孢菌素防治番茄灰霉病、番茄早疫病、辣椒炭疽病、马铃薯晚疫病、玉米小斑病和水稻稻瘟病等6个病害的田间药效试验,试验条件、试验设计和安排、调查、记录和测量方法等均按农业部药检所“农药田间药效试验准则”进行[16-19]。单端孢菌素设125、250和500mg/L 3个浓度,各试验对照药剂浓度均为500 mg/L。番茄灰霉病对照药剂为50%异菌脲可湿性粉剂(德国拜耳作物科学中国有限公司生产),番茄早疫病对照药剂为40%菌核净可湿性粉剂(吉林力生农化农药有限公司生产),辣椒炭疽病对照药剂为80%代森锰锌可湿性粉剂(四川国光农化有限公司生产),马铃薯晚疫病对照药剂为68%精甲霜·锰锌水分散粒剂(先正达作物保护有限公司生产),玉米小斑病对照药剂为70%甲基硫菌灵可湿性粉剂(山东乐邦化学品有限公司生产),水稻稻瘟病对照药剂为75%三环唑可湿性粉剂(江苏三山农药有限公司生产),对照药剂均为市售品。
2 结果与分析
2.1 最小抑制浓度测定结果
单端孢菌素对16个靶标植物病原真菌的最低抑制浓度(MIC)测定结果如表1所示。

表1 单端孢菌素对作物病原菌的MICTable 1 The minimum inhibition concentration of trichothecin to crop pathogens
测定结果显示,单端孢菌素对供试的14个病原真菌分生孢子和2个病原真菌游动孢子萌发均有较强的抑制活性,抑菌谱广,对辣椒炭疽病菌和百合炭疽病菌的抑菌活性最强,MIC 值分别为1.9和2.2 mg/L,对玉米小斑病菌和玉米大斑病菌的抑菌活性相对较弱,MIC值分别为15.1和15.5mg/L,对番茄灰霉病菌、水稻稻瘟病菌等12个病原菌抑菌活性中等,MIC值为3.0~11.2mg/L。
2.2 菌丝生长抑制测定结果
单端孢菌素对7 个作物病原真菌毒力回归方程及EC50值计算统计结果如表2所示。结果表明单端孢菌素对7 个作物病原真菌菌丝生长均有较好的抑制作用,对辣椒炭疽病菌的毒力最强,EC50为5.93 mg/L,对马铃薯晚疫病菌的毒力最弱,EC50为16.50 mg/L,对其余5 个病原菌毒力大小依次为番茄早疫病菌、水稻恶苗病菌、水稻稻瘟病菌、番茄灰霉病菌和玉米小斑病菌,其EC50分别为7.90、9.27、10.78、13.34和14.95mg/L。番茄早疫病菌、水稻稻瘟病菌、辣椒炭疽病菌、番茄灰霉病菌、水稻恶苗病菌、马铃薯晚疫病菌和玉米小斑病菌毒力回归方程的斜率依次递减,分别为1.450 5、1.373 8、1.355 3、1.300 6、1.083 9、1.080 9 和0.880 8,表明单端孢菌素对7 个病原菌的敏感性依次递减。
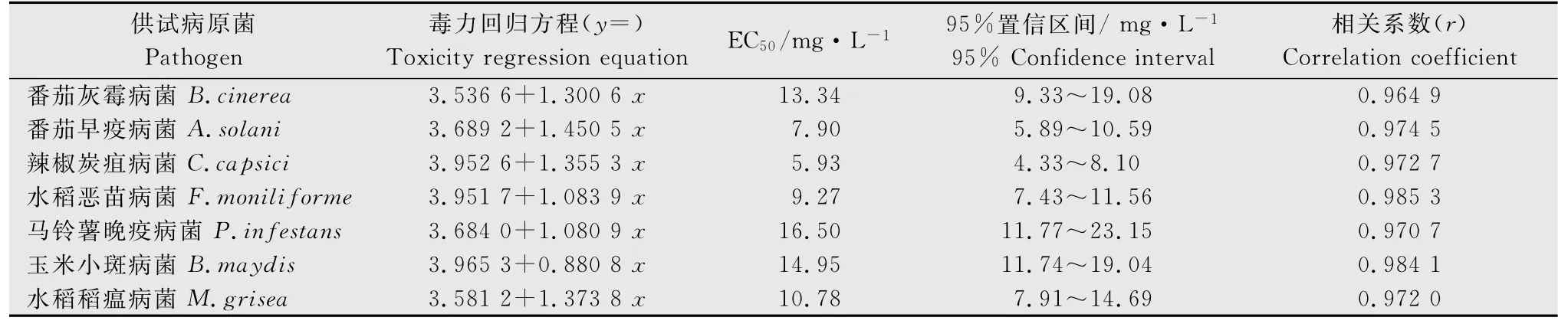
表2 单端孢菌素对7个作物病原菌菌丝生长抑制测定统计结果Table 2 Statistical results of mycelial growth inhibition activity of trichothecin to crop pathogens
2.3 田间药效试验结果
单端孢菌素对6 种作物真菌病害的田间药效试验结果如表3、表4 所示。结果表明:单端孢菌素对供试6种作物真菌病害均有较好的防治效果,不同质量浓度的防治效果之间差异显著,高浓度防效明显优于低浓度,随着浓度增加,防效增强。其中500mg/L 质量浓度对番茄灰霉病、番茄早疫病、辣椒炭疽病、马铃薯晚疫病、玉米小斑病和水稻稻瘟病的防治效果分别为78.98%、81.29%、85.28%、72.42%、78.99%和72.74%,其防治效果除低于对照药剂75%三环唑可湿性粉剂外,均高于其他对照药剂。
3 讨论
单端孢菌素是由半知真菌类等产毒真菌在特定条件下所产生的一种具有四环状12,13-环氧骨架结构的代谢产物,根据它们的化学结构划分为A、B、C、D 4 种类型,其中,A、B 型较为常见[20]。该类毒素的研究仅局限于从受病害侵染的粮食产品中分离毒素及毒素的结构分析,由于其广泛的毒性效应而应用上受到限制[21-22]。近年来的研究表明,单端孢菌素可以诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖[23]。一定剂量的粉红单端孢菌毒素在控制机体癌变等疑难病方面具有独特的功效,因而已成为医药界一种极为重要的制药材料[24]。此外,营金凤[25]测定了不同寄主来源的粉红单端孢菌株对几种重要植物病原真菌的抑菌活性,并对粉红单端孢对植物病原真菌的拮抗作用机制进行了探讨。Lawrence等从粉红单端孢菌中分离获得热稳定的抗菌物质聚端孢菌素,并明确了其对真菌的菌丝生长、孢子萌发的抑制作用[24]。本试验研究结果表明,单端孢菌素对真菌孢子萌发和菌丝生长具有较强的抑制活性,抑菌谱广,对作物真菌和卵菌病害具有良好的防治效果。鉴于其独特的生物活性,可通过化学结构改造或分子修饰,降低其毒性,进而研究开发农药品种,具有广阔的开发与应用前景。
[1]冯坚.我国新农药创制与产业化开发[J].现代农药,2005,4(3):1-9.
[2]张一宾.新农药创制方法概述[J].农药,2006,45(6):364-367.
[3]余伯阳.以生物组合化学技术发现新高效低毒天然药物先导化合物[J].中国天然药物,2007,5(3):167-173.
[4]晏仁义,陈若芸.天然产物中先导化合物的发现与优化[J].中国天然药物,2005,3(6):332-335.
[5]汤亚杰,李艳,徐小玲,等.天然活性先导化合物生物转化[J].中国生物工程杂志,2007,27(9):110-115.
[6]刘长令,李正名.以天然产物为先导化合物开发的农药品种(Ⅰ)—杀菌剂[J].农药,2003,42(11):1-4.
[7]刘长令,钟滨,李正名.以天然产物为先导化合物开发的农药品种(Ⅱ)—杀虫杀螨剂[J].农药,2003,42(12):1-7.
[8]王以燕,袁善奎,吴厚斌,等.我国生物源及矿物源农药应用发展现状[J].农药,2012,51(5):313-316.
[9]杨峻,林荣华,袁善奎,等.我国生物源农药产业现状调研及分析[J].中国生物防治学报,2014,30(4):441-445.
[10]Knight V,Sanglier J J,DiTullio D,et al.Diversifying micro-bial natural products for drug discovery[J].Applied Microbiology and Biotechnology,2003,62:446-458.
[11]王辂,褚以文.微生物来源先导化合物的研究策略[J].中国天然药物,2006,4(3):162-167.
[12]杨佩文,文孟良,李元广,等.暗双孢菌AGR0073 产生的单端孢菌素的分离纯化结构解析及其抗植物病原真菌活性[J].西南农业学报,2014,27(1):142-146.
[13]Lee J Y,Moon S S,Yun B K,et al.Thiobutacin,a novel antifungal and antioomycete antibiotic fromLechevalieriaaerocolonigenes[J].Journal of Natural Products,2004,67:2076-2078.
[14]农业部农药检定所.NY/T 1156.2-2006 农药室内生物测定试验准则—杀菌剂第2 部分:抑制病原真菌菌丝生长试验——平皿法[S].北京:中国标准出版社,2006.
[15]农业部农药检定所.GB/T 17980.19-2000农药田间药效试验准则(一)—杀菌剂防水稻叶部病害[S].北京:中国标准出版社,2000.
[16]农业部农药检定所.GB/T 17980.28-2000农药田间药效试验准则(一)—杀菌剂防治蔬菜灰霉病[S].北京:中国标准出版社,2000.
[17]农业部农药检定所.GB/T 17980.31-2000农药田间药效试验准则(一)—杀菌剂防治番茄早疫病和晚疫病[S].北京:中国标准出版社,2000.
[18]农业部农药检定所.GB/T 17980.33-2000农药田间药效试验准则(一)—杀菌剂防治辣椒炭疽病[S].北京:中国标准出版社,2000.
[19]农业部农药检定所.GB/T 17980.107-2004农药田间药效试验准则(一)——杀菌剂防治玉米大小斑病[S].北京:中国标准出版社,2004.
[20]Meneely J P,Ricci F,van Egmond H P,et al.Current methods of analysis for the determination of trichothecene mycotoxins in food[J].TrAC Trends in Analytical Chemistry,2011,30(2):192-203.
[21]Rocha O,Ansari K,Doohan F M.Effects of trichothecene mycotoxins on eukaryotic cells:a review[J].Food Additives and Contaminants,2005,22:369-378.
[22]He Jianwei,Zhou Ting,Young J C,et al.Chemical and biological transformations for detoxification of trichothecene mycotoxins in human and animal food chains:a review[J].Trends in Food Science &Technology,2010,21(2):67-76.
[23]单斌,王玮,舒剑波.单端孢菌素逆转肺癌耐药A549/DDP细胞耐药性及其机制研究[J].中国现代应用药学,2014,31(6):678-682.
[24]Lawrence L K,Richard A K,Kunz L L,et al.Therapeutic inhibitor of vascular smooth muscle cells:US,6599928B2[P].2003-07-29[2014-11-01].http://patft.uspto.gov/netacgi/nph-Parser?Sect2=HIF OFF&p=1&u=/netahtml/P.
[25]营金凤.粉红单端孢对几种重要植物病原真菌的拮抗作用及其机制[D].合肥:安徽农业大学,2009.

