链格孢、粉红单端孢通过降解果皮细胞壁导致哈密瓜病害
郑鄢燕,赵力卉,2,王宇滨,马越,赵晓燕*
1(北京市农林科学院蔬菜研究中心,北京市果蔬农产品保鲜与加工重点实验室,北京,100097) 2(沈阳农业大学 食品学院,辽宁 沈阳,110866)
哈密瓜又称厚皮甜瓜,是我国西北地区的特色水果,风味独特,香气诱人,营养丰富,深受人们喜爱,但采后病原菌导致的腐烂非常严重,其中由链格孢引起的黑斑病和粉红单端孢引起的粉霉病是重要的采后病害[1-2]。病原菌的侵染会影响果实成熟[3]、活性氧代谢[4]、抗病酶活性和抗病基因的表达[5-7]以及细胞壁微观结构变化和细胞壁成分的降解[8-9]。目前研究较多的是病害防治方法,SVETLANA等[10]研究发现不同浓度的壳聚糖均能有效抑制链格孢菌的生长。GE等[11]研究发现,硫氨酸处理会提高甜瓜H2O2含量以及过氧化氢酶(activities of catalase, CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)和谷胱甘肽还原酶(glutathione reductase, GR)的活性,诱导抗病相关酶苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)和过氧化物酶(peroxidase, POD)的活性,从而增强哈密瓜对链格孢和粉红单端孢的抵抗能力。乙酰水杨酸采前处理、草酸采后处理可提高甜瓜抗病酶PAL、POD、多酚氧化酶(polyphenoloxidase, PPO)、β-1,3-葡聚糖酶(β-1,3-glucanase, GLU)、超氧化物歧化酶(superoxide dismutase, SOD),从而减少粉红单端孢导致的哈密瓜腐烂[12-13]。病害防控技术非常重要,了解病原菌导致的哈密瓜腐烂机制同样重要,可为病害防治提供理论基础。研究表明,链格孢和粉红单端孢能分泌一系列细胞壁降解酶,这些细胞壁降解酶是病原菌克服细胞壁屏障的重要因素之一,且细胞壁降解酶活性越高其病原菌侵染能力越强[9,14]。研究发现链格孢和粉红单端孢分泌的β-半乳糖苷酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶、羧甲基纤维素酶酶活较高。扫描电镜在果蔬保藏和病原菌侵染果蔬过程中得到广泛的应用,可以观察到果蔬细胞壁降解程度和病原菌的繁殖情况[15-17]。
本研究采用扫描电镜观察链格孢和粉红单端孢侵染后病原菌增殖以及哈密瓜细胞壁降解情况,分析哈密瓜细胞壁降解酶活性和细胞壁降解后导致硬度和相对电导率等变化,探究病原菌导致的腐烂是否通过细胞壁降解酶降解哈密瓜细胞壁结构,为哈密瓜病害防治提供理论参考。
1 材料与方法
1.1 实验材料
哈密瓜,北京市海淀区彰化路果香四溢水果店;链格孢、粉红单端孢,从自然腐烂的哈密瓜中分离纯化并鉴定获得。
1.2 仪器与设备
CM-3700d台式分光测色仪,日本柯尼卡-美能达公司;A11基本型分析研磨机、T10基本型分散机,艾卡(广州)仪器设备有限公司(IKA 中国);GXH-3051便携式CO2红外线分析器,上海精密仪器仪表有限公司;UV-1800紫外分光光度仪,日本岛津公司;TA-XT Plus质构仪,英国SMS公司;HITACHI SU-8010高分辨场发射扫描电镜,日本日立高新技术公司;β-半乳糖苷酶活性检测试剂盒,北京索莱宝生物科技有限公司。
1.3 实验方法
1.3.1 实验设计
本研究分两部分实验,第一部分以链格孢为实验菌株,探讨导致哈密瓜腐烂的最佳接种方式,每个瓜接种6处,每种接种方式15个哈密瓜,每天统计发病。第二部分是根据第一部分结果,以打孔接种方式接种链格孢和粉红单端孢,接种后哈密瓜分为2组,一组用于统计发病,一组用于不同时间取样测定指标。
1.3.2 病原菌培养与接种
病原菌的培养和孢子制备参考GE等[11]方法,略有改动。链格孢和粉红单端孢接种于马铃薯蔗糖培养基(potato sucrose agar, PSA),28 ℃培养7 d进行产孢。取适量带有0.01%吐温80的无菌水倒入平板中,利用三角棒轻轻刮下病原菌表面的孢子,经4层纱布过滤除去菌丝后,置于显微镜下观察,后将菌悬液浓度调整到106CFU/mL。
损伤方式和孢子接种参考井敏敏等[7]方法。无伤接种:将100 μL菌悬液涂在圆形区域直径为2 cm的哈密瓜皮上;有伤接种:分别以打孔、画Z字、刮皮的方式在每个哈密瓜表皮制造6处损伤,打孔孔径为0.6 cm × 0.2 cm(宽×深度),Z字宽度为2 cm,刮皮区域边长为2 cm,将100 μL菌悬液涂在哈密瓜损伤处。28 ℃、85%RH的条件下贮藏7 d,每天统计发病情况并取样用于指标测定。每组处理10个瓜用于统计发病率和病斑面积,每个取样点10个瓜用于指标测定。
1.3.3 发病率和病斑面积
参考任GUO等[18]方法统计发病率和病斑面积,如公式(1)和公式(2)所示:

(1)

(2)
1.3.4 扫描电镜观察贮藏期哈密瓜的超微结构
在哈密瓜接菌处进行横向取样,取出长、宽、厚度为0.5 cm × 0.2 cm × 0.1 cm的果皮,放入2.5%戊二醛中固定24 h,送至中国农业科学院农产品加工所进行样品后续和扫描电镜观察。
1.3.5 细胞壁降解酶的测定
β-半乳糖苷酶(β-galactosidase,β-GAL)采用试剂盒测定。
多聚半乳糖醛酸酶(β-galactosidase,PG)、β-葡萄糖苷酶(β-glucosidase,β-GLU)、羧甲基纤维素酶(carboxymethyl cellulase,Cx)的测定参考曹建康等[19]方法,酶液的提取:称取5 g哈密瓜皮,经10 mL经预冷的95%乙醇、5 mL经预冷的80%乙醇、7 mL经预冷的提取缓冲液于4 ℃、12 000 r/min离心20 min。上清液即为粗酶提取液,4 ℃保存,用于测定PG、β-GLU、Cx。
粗酶液0.5 mL加入1 mL提取缓冲液,PG测定加0.5 mL、10 g/L多聚半乳糖醛酸溶液;β-GLU测定加1.5 mL、10 g/L水杨苷溶液反应;Cx测定加1.5 mL、10 g/L羧甲基纤维素钠溶液。然后37 ℃的水浴反应60 min,立即加入1.5 mL的DNS试剂终止反应,煮沸5 min,冷却后用蒸馏水定容至25 mL,在540 nm处测定其吸光度值。
1.3.6 哈密瓜贮藏期色泽的变化
哈密瓜果皮色差采用台式色差仪测量,测定距病斑1 cm处的色泽,结果表示为L*(亮度)、a*(红、绿色)、b*(黄、蓝色)。
1.3.7 呼吸、失重率、相对电导率、硬度的测定
呼吸速率的测定参考王霞等[20]方法。
失重率以贮藏前后失重差值与贮藏前质量的比值计算,如公式(3)所示:

(3)
相对电导率参考曹建康等[19]方法,取1 g距病斑1 cm处的哈密瓜皮,放入100 mL的锥形瓶中,倒入20 mL的蒸馏水,浸泡30 min后利用电导率仪测定其电导率L0,然后煮沸5 min,冷却后测定其电导率L1,以前后电导率的比值作为相对电导率。
硬度用质构仪测定,探头为0.8 cm,距病斑1 cm处测定。
1.4 数据处理
采用Microsoft Excel 2016软件对数据进行处理,处理好的数据采用Origin 2018软件绘图。采用SPSS 19.0统计软件进行数据分析,组间均值比较使用单因素方差分析(One-way ANOVA),数据表示为平均值±标准差,实验重复3次,P<0.05表示差异具有显著性。
2 结果与分析
2.1 病原菌接种方式的探索
由图1-A可知,第7天时,刮皮接种只在表面有少许菌丝,部分菌丝没有完全变为灰色;打孔接种的孔内部长满灰色丝状的链格孢;对于Z字接种,则在缝隙有极少的菌丝;将菌悬液涂在瓜皮表面的无伤接种则无菌丝出现,由此可见,打孔接种的哈密瓜发病最严重。对于发病率(图1-B)和病斑面积(图1-C),刮皮发病率第7天达到30%,病斑面积较小;打孔接种第2天开始,发病率急剧上升,第3天时发病率达到90%,病斑面积也迅速扩大,均显著高于其他接种方式;Z字接种的发病率从第2天快速增加,第7天时发病率为70%,病斑面积与刮皮相似。综上,打孔哈密瓜发病率最高;同样发病的瓜,打孔的病斑面积也最大,瓜腐烂最快,因此,后续试验采用打孔方式进行接种。
A-哈密瓜腐烂情况;B-发病率;C-病斑面积图1 不同方式接种链格孢导致的哈密瓜腐烂情况、发病率、病斑面积Fig.1 The effects of different inoculation methods on disease symptoms、disease incidence and lesion area of Hami melon caused by Alternaria alternata
2.2 接种链格孢和粉红单端孢哈密瓜的腐烂情况
第7天时,对照组打孔处有部分菌生长,但未长到孔外,也未造成明显的腐烂;接种链格孢和粉红单端孢的哈密瓜病原菌生长明显,已经侵染到孔外(图2-A)。接种链格孢和粉红单端孢的哈密瓜第4天后,发病率都达到100%,显著高于对照组(图2-B)。接种链格孢后,哈密瓜的病斑面积从第5天开始迅速扩大,第7天时病斑面积是对照组的15倍(图2-C)。接种粉红单端孢后,哈密瓜的病斑面积从第3天开始迅速扩大,第7天时病斑面积是对照组的16倍(图2-C)。2株病原菌之间比较发现,粉红单端孢引起的发病率和病斑扩增速度均高于链格孢(图2-B和2-C)。
A-哈密瓜腐烂情况;B-发病率;C-病斑面积图2 链格孢和粉红单端孢导致的哈密瓜腐烂情况、发病率、病斑面积Fig.2 The effects of Alternaria alternata and Trichothecium roseum on the disease symptoms,disease incidence and lesion area of Hami melon
2.3 哈密瓜皮超微结构的变化
由图3-A可知,在第0天时,哈密瓜皮的细胞排列非常紧密,细胞壁坚挺,细胞中无菌丝生长,表明无菌丝侵染。对照组,在第3天对照组的哈密瓜细胞壁有些许塌陷,几乎看不到菌丝生长,即随着贮藏期的增加,果实正在老化变软;到第7天时,哈密瓜皮的细胞壁降解加重,细胞塌陷明显,并且能看到少许菌丝生长(图3-B和3-E)。由图3-C和图3-F可以看出,接种链格孢的哈密瓜皮,第3天细胞已经塌陷,细胞壁被链格孢降解,并且有大量菌丝附着,但还能看到一个个细胞轮廓;到第7天时,细胞完全被降解,看不出细胞形状,长满菌丝,链格孢还增殖产生了孢子。由图3-D和图3-G可知,接种粉红单端孢的哈密瓜皮,第3天细胞大部分塌陷,有大量菌丝附着;第7天时,细胞已经完全被降解,表面完全被菌丝侵占,且菌丝生长旺盛,还导致组织破裂。电镜图也能看出粉红单端孢导致的腐烂现象比链格孢严重,这与图2统计观察的结果一致。
A-0 d;B-3 d对照;C-3 d链格孢;D-3 d粉红单端孢;E-7 d对照;F-7 d链格孢;G-7 d粉红单端孢图3 扫描电镜观察哈密瓜接种病原菌后超微结构Fig.3 SEM observation of Hami melon inoculated with spoilage fungi
2.4 贮藏期哈密瓜细胞壁降解酶的变化
由图4-A可知,在整个贮藏期,β-半乳糖苷酶的活性整体呈上升的趋势,且接种病原菌的哈密瓜皮酶活性高于对照组。前5天,接种粉红单端孢的哈密瓜皮酶活高于接种链格孢的哈密瓜皮,从第5天开始,接种链格孢的哈密瓜皮酶活高于接种粉红单端孢的哈密瓜皮,对照组哈密瓜第5天后酶活略微下降,第7天接种链格孢的哈密瓜酶活为对照组1.54倍,接种粉红单端孢的哈密瓜酶活为对照组的1.39倍。
由图4-B可知,在前6天接种病原菌的哈密瓜皮多聚半乳糖醛酸酶的酶活呈上升趋势,在第7天略有下降,对照组哈密瓜皮多聚半乳糖醛酸酶的酶活先上升后略微下降,总体来说接种病原菌组的酶活性显著高于对照组。
由图4-C可知,贮藏期间,3组哈密瓜皮的β-半乳糖苷酶均呈上升趋势,且接种病原菌组的酶活性显著高于对照组。两病原菌组比较,接种粉红单端孢的哈密瓜皮酶活高于链格孢接种组。第7天时,接种链格孢的哈密瓜皮酶活为对照组的1.39倍,接种粉红单端孢的哈密瓜皮酶活为对照组的1.58倍。
由图4-D可知,贮藏期间,对照组哈密瓜皮羧甲基纤维素酶的酶活变化呈先上升后下降趋势,在第5天有最大值。接种链格孢的哈密瓜皮羧甲基纤维素酶的酶活也呈上升趋势,第4天后缓慢上升,在第7天有最大值。接种粉红单端孢的哈密瓜皮羧甲基纤维素酶的酶活呈上升趋势,前2 d上升较快,第6天时有最大值。2个接种病原菌的处理组的羧甲基纤维素酶的酶活均高于对照组,同时,接种粉红单端孢的哈密瓜皮酶活高于链格孢接种组。
2.5 哈密瓜贮藏期色泽的变化
如表1所示,对于色差L值来说,3种处理的L值在前3 d都呈上升趋势,第3天接种链格孢的L值显著高于其他2种处理(P<0.05),表明哈密瓜表皮颜色越来越亮。接种链格孢的哈密瓜第4天~第7天有略微的变化,在第7天高于对照组10%。接种粉红单端孢的哈密瓜皮L除第3天外,均高于对照组。对于色差a值,对照组的a值在前4 d呈上升趋势,在第3天到第4天增加较快。接种链格孢的哈密瓜皮的a值在前5 d呈上升趋势,接种粉红单端孢的哈密瓜皮的a值在前6 d呈上升趋势,都在第7天显著高于对照组。对于色差b值,对照组总体呈下降趋势,第7天低于第0天。接种链格孢的哈密瓜皮的b值在前期呈缓慢下降趋势,在第7天高于对照组。接种粉红单端孢的哈密瓜皮的b值在后4 d显著高于对照组。b值越大代表黄色越深,表明病原菌的侵染会使哈密瓜更快地变黄。
2.6 哈密瓜贮藏期呼吸、失重率、相对电导率、硬度的变化
贮藏期间3个组哈密瓜的呼吸速率均呈上升趋势。对照组哈密瓜的呼吸速率,在第1天和第7天时快速增加,第2天~第6天增长趋势平缓。接种链格孢的哈密瓜的呼吸速率在前3 d与对照组无显著差异,从第3天开始增长速率高于对照组,在第7天为对照组的1.04倍。接种粉红单端孢的哈密瓜呼吸速率增长最快,显著高于其他2组,第7天是对照组的1.34倍(图5-A)。
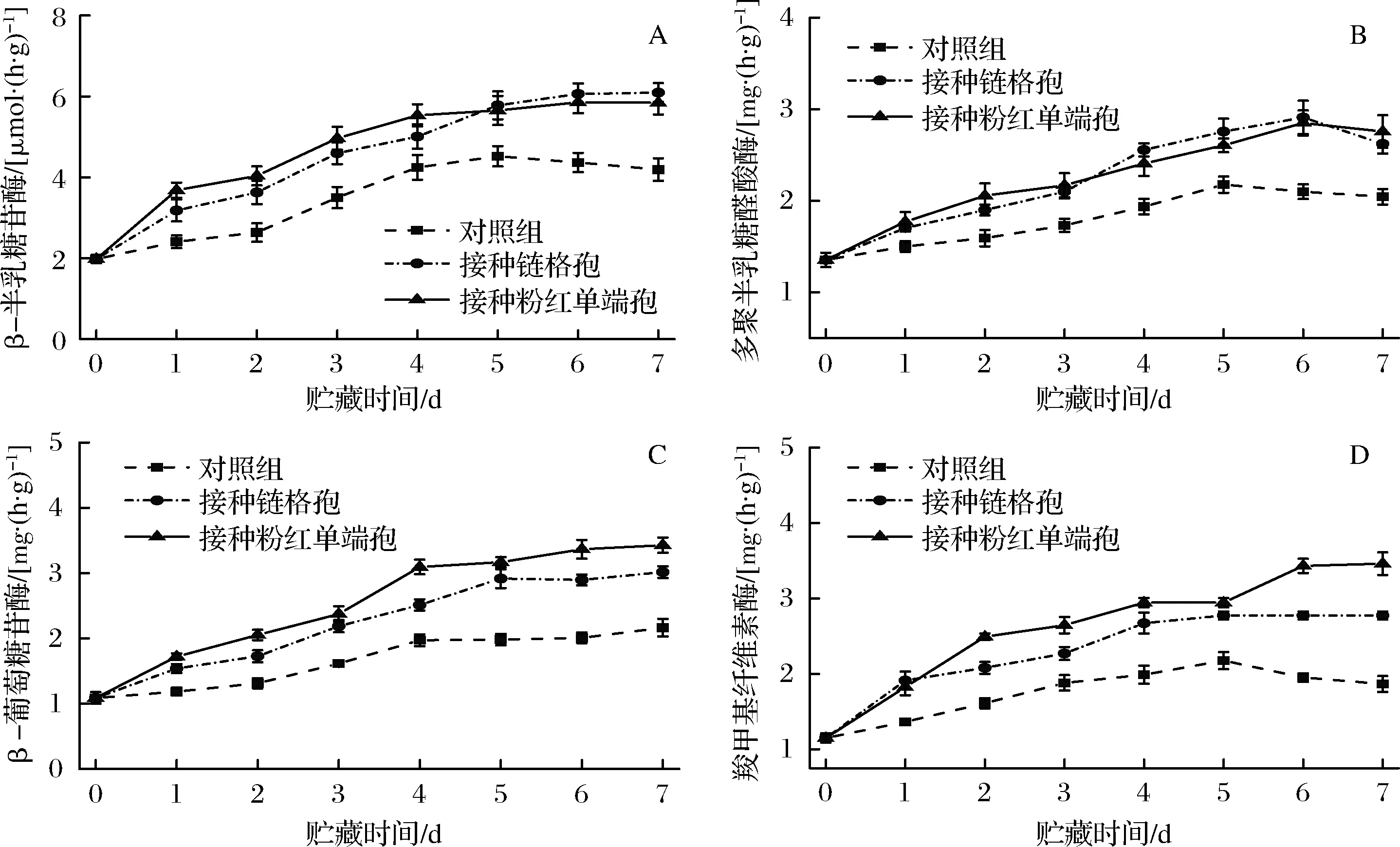
A-β-半乳糖苷酶;B-多聚半乳糖醛酸酶;C-β-葡萄糖苷酶;D-羧甲基纤维素酶图4 接种链格孢和粉红单端孢对哈密瓜β-半乳糖苷酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶、羧甲基纤维素酶活性的影响Fig.4 The effects of Alternaria alternata and Trichothecium roseum on activities of β-galactosidase,polygalacturonase,β-glucosidase and carboxymethyl cellulase of Hami melon during storage
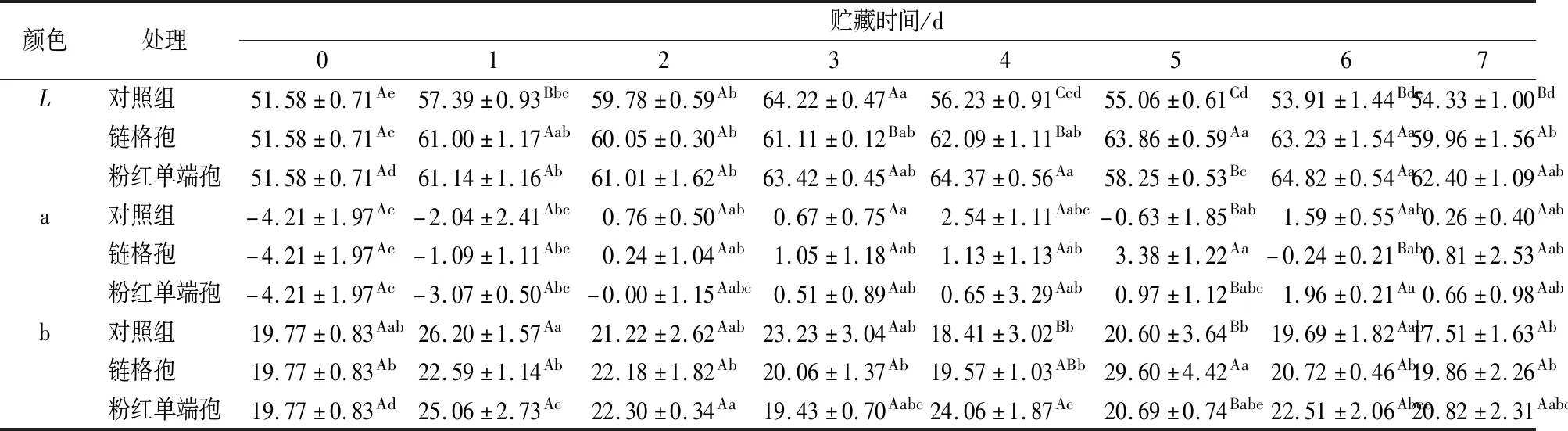
表1 接种链格孢和粉红单端孢导致的哈密瓜贮藏期色泽的变化Table 1 Changes of color of Hami melon during storage caused by inoculating Alternaria alternata and Trichothecium roseum
注:A~C表示是同一天不同处理之间的比较差异显著(P<0.05);a~e表示同一处理不同天之间的比较差异显著(P<0.05)
整个贮藏期间3组的哈密瓜失重率都呈上升趋势,接种病原菌的哈密瓜失重率显著高于对照组。接种链格孢的哈密瓜,第7天时,失重率是对照组的2倍。接种粉红单端孢的哈密瓜失重率上升最快,到第7天时,失重率是对照组的2.7倍。可见病原菌的侵染可以导致哈密瓜失重率上升(图5-B)。
在贮藏期间3组的哈密瓜的相对电导率均呈上升趋势。对照组相对电导率上升缓慢,接种链格孢的哈密瓜在第2天下降,在第4天又呈上升趋势,到第7天时有最大值,是对照组的1.2倍。接种粉红单端孢的哈密瓜相对电导率上升速率高于其他2个处理组,到第7天时有最大值,是对照组的1.3倍(图5-C)。
贮藏期间3组瓜硬度都呈下降趋势。对照组下降较为缓慢,接种链格孢的哈密瓜下降较快,在第2、4天迅速下降,最终硬度比对照组低20%。接种粉红单端孢的哈密瓜下降较快,硬度比接种链格孢的哈密瓜略低,在第2天迅速下降,最终硬度比对照组低32%(图5-D)。
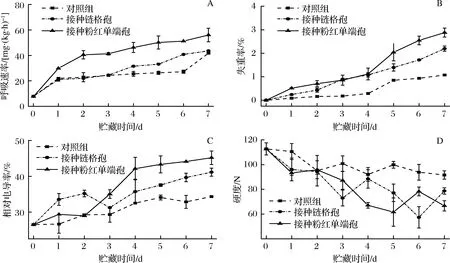
A-呼吸;B-失重率;C-相对电导率;D-硬度图5 接种链格孢和粉红单端孢对哈密瓜呼吸、失重率、相对电导率、硬度的影响Fig.5 The effects of Alternaria alternata and Trichothecium roseum on respiration,weightlessness rate,relative conductivity and firmness of Hami melon during storage
3 讨论与结论
哈密瓜由于含水和含糖量高,是天然的培养基,易受到病原微生物侵染而腐烂。损伤导致的组织破坏,给病原菌提供了重要的侵染路径。不同接种方式导致的损伤程度不同,为了探讨病原菌导致哈密瓜腐烂的最佳损伤方式,本研究以链格孢为试验菌株,探讨了打孔、画Z字、刮皮接种哈密瓜的腐烂情况,发现打孔接种哈密瓜最容易腐烂,这可能是由于打孔接种,病原菌接触面积大,有利于病原菌侵染,而且打孔损伤更深,会破坏到果肉,果肉比果皮更有利于病原菌的生长繁殖。
果蔬细胞壁主要成分是纤维素和果胶,主要功能是支撑细胞结构和保护果蔬抵御外界环境因素的侵染[20]。病原菌产生的细胞壁降解酶能使果蔬细胞壁果胶多聚体降解,破坏组织结构,减少组织细胞之间的黏性,果蔬能感知细胞壁完整性的丧失,进而激活防御信号通路,病原菌试图逃避果蔬的防御,有时利用果蔬细胞壁的新陈代谢进入细胞内部,进一步促进腐烂[21-22]。本研究采用扫描电镜观察到链格孢和粉红单端孢侵染后细胞壁发生塌陷,组织结构破裂,且粉红单端孢侵染对细胞壁降解比链格孢严重,这可能是因为粉红单端孢比链格孢更适应哈密瓜环境,能快速利用哈密瓜营养进行繁殖,电镜结果和病斑面积都能看出粉红单端孢生长更快(图2和图3);粉红单端孢产生的细胞壁降解酶高于链格孢,图4结果表明接种粉红单端孢组哈密瓜β-半乳糖苷酶、多聚半乳糖醛酸酶、β-葡萄糖苷酶、羧甲基纤维素酶高于链格孢组。李庆亮等[23]研究发现,链格孢和粉红单端孢产生的β-葡萄糖苷酶和纤维素酶在苹果病原菌致病过程中起重要作用。吴秀[24]研究链格孢对西兰花品质影响时,发现链格孢产生的纤维素酶、β-葡萄糖苷酶和果胶甲基半乳糖醛酸酶综合作用导致西兰花病害。YAN等[25]研究发现链格孢通过影响哈密瓜细胞壁代谢相关酶的活性导致组织结构的破坏,这些研究与我们结果一致。
病原菌导致果蔬病害时,果蔬色泽也会发生显著变化。链格孢引起的黑斑病和粉红单端孢引起的红粉病果蔬颜色会变黑和变红,一方面是病原菌自身的颜色导致,另一方面可能是由于病原菌破坏了细胞,液泡中的酚类底物氧化为醌,醌进一步聚合为黑色或褐色的物质,导致果皮颜色变暗。研究发现,链格孢和粉红单端孢侵染促进了哈密瓜呼吸,加速代谢活动。哈密瓜病害发生后硬度下降,是由于链格孢和粉红单端孢产生的细胞壁降解酶降解哈密瓜细胞壁,还可能由于病原菌的侵染促进了哈密瓜的成熟。细胞壁的降解导致组织内部物质释放到组织外,电导率相应升高。组织破坏以及呼吸代谢加快均会导致失重的增加。GONG等[3]发现粉红单端孢会诱导乙烯产生,促进呼吸,从而促进哈密瓜成熟,果实硬度下降。
综上,我们把链格孢和粉红单端孢引起哈密瓜病害机制用图6总结。链格孢和粉红单端孢通过细胞壁降解酶降解果皮细胞壁成分,导致细胞完整性受到破坏,并且病原菌利用哈密瓜营养成分不断生长繁殖,导致哈密瓜腐烂,哈密瓜腐烂后会使瓜皮颜色变暗,失重率、呼吸速率、电导率增加,硬度下降,并且粉红单端孢导致的腐烂现象比链格孢严重。
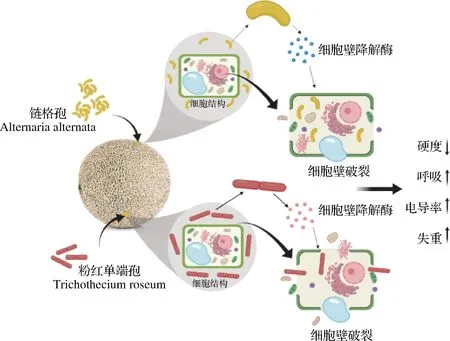
图6 链格孢和粉红单端孢导致哈密瓜腐烂机制Fig.6 Rotten mechanism of Hami melon caused by Alternaria alternata and Trichothecium roseum

