万寿菊当归多样性种植对土壤真菌多样性的影响
魏环宇,管丽蓉,2,王 扬,王海宁,刘 胜,李正科,王云月,谢 勇*
(1.云南农业大学植物保护学院,昆明 650201;2.云南开放大学化工学院,昆明 650500;3.云南省曲靖市沾益县农业局,曲靖 655331)
当归(Angelicasinensis)属于伞形花科植物,是云南山区广为栽培的中草药之一,但防治当归根结线虫病和根腐病一直是困扰当归大田生产的重要难题[1-2]。探索高效、简便、环境友好的防治方法成为农业科技工作者长期努力的目标。
合理的作物布局(allocation of crops)是农业生产取得较好经济效益、生态效益和社会效益的前提。利用农业生物多样性的原理和技术,针对不同地区作物种类、光热条件进行农作物的合理间(套)作或轮作不仅可提高复种指数、增加产出,而且可有效控制农作物病虫害[3-4]。万寿菊(Tageteserecta)是认识最早的具有开发或应用价值的杀线植物之一,有关其杀线机制方面的研究仍在深入[5-7]。利用万寿菊与其他作物轮作或间(套)作来控制多种线虫病的危害已经有了一些成功的尝试[8]。在杀线机制研究方面也有报道,普遍认为是万寿菊的根系分泌物杀死线虫或创造了有利于拮抗微生物的土壤生态环境[9-10]。然而,万寿菊与其他作物间套作来控制线虫病害的研究存在较多相互矛盾的结论[11]。因此,加快万寿菊杀线机制研究有利于万寿菊杀线活性的有效利用。
作为一种商业化色素的新来源,万寿菊的种植面积在云南日益增长,传统的区域性作物布局逐渐被打破,同时万寿菊与当归这两种作物间具有很大的作物布局重叠区,在原有生产水平和生产模式的基础上,如何充分利用有限耕地,确保较高的复种指数并实现农作物病虫害的持续控制,同时扶持万寿菊这一新兴产业的发展,成为农业科技工作者关注的科学问题。本课题组在前期研究中进行了万寿菊与当归套作控制当归根结线虫病的初步探索,发现采用合理的多样性种植方式可有效控制当归根结线虫危害,并可提高土地利用率[12]。但由于万寿菊根系分泌物具有广谱的生物活性,进行多样性种植后,不同种植方式对土壤微生物产生何种影响,其规律如何,以及多样性种植是否具有持续性等问题未见相关报道。
因此,本研究采用PCR-DGGE 技术方法,以直接从土壤中提取微生物总DNA 的方式,研究万寿菊多样性种植对当归根际土壤真菌群落的影响,初步弄清万寿菊多样性种植模式中根际土壤真菌群落的变化,为利用万寿菊多样性种植持续控制作物病虫害提供理论支持。
1 材料与方法
1.1 材料
1.1.1 田间试验设计与方法
试验材料:当归(A.sinensis)和万寿菊(T.erecta)均为曲靖市沾益县推广品种,万寿菊种子由曲靖博浩生物科技股份有限公司提供,当归种子由沾益县农业局生物资源开发技术推广站提供。万寿菊和当归育苗按常规方法进行,苗床期适时防治病虫害。
试验田位于云南省曲靖市沾益县菱角乡排坡村,海拔高度1 952m,山地土壤类型为黄壤。田间试验以当归单作为对照(A),共设置3个处理,分别为万寿菊单作(B)、万寿菊和当归轮作(C)、万寿菊和当归间作(D),除了对照当归单作的前茬作物为当归外,3个处理的前茬作物都为万寿菊。每处理3次重复,共12个小区,每小区面积100m2。周围设置当归保护行。单作模式移栽规格参照文献[13]和文献[14]的方法进行,间作模式为2行万寿菊中间间作4行当归,万寿菊与当归株距35cm。大田移栽于5月上旬进行,所有处理肥水管理完全一致,生长期间不施用任何药剂[12]。

图1 当归-万寿菊田间试验设计示意图Fig.1 Diagrammatic representation of angelica inter-planting with marigold experiment in field
1.1.2 主要仪器设备
高速冷冻离心机(德国Eppendorf 公司),DGGE 电泳仪(BIO-RAD),电泳仪(BIO-RAD),PCR 仪(Biometra),恒温水浴(上海精宏实验设备公司),凝胶成像仪LG2020型(杭州朗基科学仪器有限公司),旋蒸浓缩仪(BIO-RAD),电子天平等。
1.2 方法
1.2.1 土样采集方法
对照(当归单作)和处理(万寿菊单作、当归/万寿菊轮作、当归/万寿菊间作)分别连作当归或万寿菊一年。取样时间为前期(移栽当天)、中期(移栽后60d)和后期(移栽后120d),取样方法采用棋盘式五点取样。根据处理不同,分别从当归或万寿菊根周围在距离地表20cm处用自制土样采集器分别取根区土,将五点取的土样混匀后作为该处理的样品(约500g)。其中,间作(D)在每个取样点分别采集当归和万寿菊各10个土样经1∶1充分混匀后装袋。采集到的土壤样品带回实验室,于-20℃冰箱保存,每个处理和对照根据取样时间进行编号,即前期、中期、后期(编号1、2、3)。试验样品分别为当归单作(A1、A2、A3)、万寿菊单作(B1、B2、B3)、万寿菊/当归轮作(C1、C2、C3)、万寿菊/当归间作(D1、D2、D3);由于种植前期,即作物移栽当天,万寿菊单作与间作的前茬作物都为万寿菊,土样样品没有重复取样,因此共计采集11个样品。

表1 各处理DGGE条带数比较及当归多样性种植与当归单作的显著性分析1)Table 1 The number of DGGE bands and significance analysis between angelica diversified cropping and its monoculture patterns
1.2.2 基因组DNA 的提取和纯化
本试验采用OMEGA 公司的soil DNA Kit试剂盒方法,具体按试剂盒说明书并略作改动,提取的DNA 样品于-20 ℃保存[15-16]。
1.2.3 基因组DNA 的PCR 扩增
为提高PCR 扩增的特异性,本试验采用嵌套式PCR 扩增,方法如下。
1.2.3.1 PCR 扩增引物
选择针对真菌ITS rDNA 基因的高度可变区序列的保守引物,在正向引物ITS1F 的5′端加一段“GC夹”,以防止在DGGE中分离时DNA 的完全变性。引物序列为:ITS1F:CTTGGTCATTTAGAGGAAGTAA 和ITS4:TCCTCCGCTTATTGATATGC;ITS2:GCTGCGTTCTTCATCGATGC 和ITS 1FGC:CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCTTGGTCATTTAGAGGAAGTAA。
1.2.3.2 PCR 反应体系
第1次PCR 采用真核生物通用引物对ITS1F和ITS4,扩增序列覆盖核糖体5.8SrDNA,第1次PCR 扩增产物作为第2次PCR 扩增的模板。第2次PCR采用引物对ITS1F-GC和ITS2,扩增片段的大小约250bp。PCR扩增反应体系如下:采用20μL反应体系,组成为10×TaqBuffer with KCl 2.0μL,2.5mmol/L dNTP Mixture 1.6μL,1.0μmol/L上游引物2.0μL,1.0μmol/L 下游引物2.0μL,Taq酶(5U/μL)0.2μL,模板DNA 2.0μL,无菌双蒸水10.2μL。
1.2.3.3 PCR 反应条件与产物检测
94 ℃预变性3min;94 ℃变性30s,56 ℃退火30s,72℃延伸45s,30个循环;最后在72℃下终延伸5min。PCR 反应的产物用1.5%琼脂糖凝胶电泳检测。
1.2.4 PCR反应产物的变性梯度凝胶电泳(DGGE)分析
1.2.4.1 变性胶的制备
使用DGGE梯度胶制备装置,制备变性剂浓度从30%到50%(其中变性剂为尿素和甲酰胺组成,100%的变性剂为含7mol/L 的尿素和40%的去离子甲酰胺的混合物)的8%的聚丙烯酰胺凝胶,其中变性剂的浓度从胶的上方向下方依次递增。配制好的胶用0.45μm 的滤膜过滤,抽真空10min,4 ℃保存。100μL PCR 产物用Bio-Rad旋转蒸发仪浓缩5~6倍,用于灌制30%~50%梯度胶。具体过程为:各取15mL 30%和50%的变性胶,加600μL 的染液到50%高浓度胶中,混匀。然后,分别在30%和50%的变性胶中加入80μL 10%过硫酸铵和50μL TEMED,快速灌胶,聚合1~2h。将1×TAE 在Bio-Rad DCode mutant detect system 电泳槽中预热到65 ℃[16-17]。
1.2.4.2 PCR 样品的加样
待胶完全凝固后,将胶板放入装有电泳缓冲液的装置中,浓缩样品与等体积的loading buffer混合后,取25μL上样到8%聚丙烯酰胺30%~50%梯度变性凝胶孔中。
1.2.4.3 电泳及染色
在60V 的电压下,65 ℃电泳14h。电泳完毕后,将凝胶采用银染法染色。具体步骤为:用固定液(10%的冰醋酸)固定凝胶20min后,用去离子水清洗凝胶2次,每次2min。然后将凝胶浸泡在染色液(含0.26g硝酸银,350mL去离子水)中,放置轨道摇床上20min。取出凝胶,用去离子水清洗5s,立刻放入显影液(含5.25g氢氧化钠,1.4 mL 甲醛,350mL水)中,摇晃至条带清晰完全出现。
在凝胶成像仪中用白光拍照。观察各个土壤样品的PCR 产物经变性梯度凝胶电泳(DGGE)分离后的电泳图谱照片。
1.3 数据处理与分析
采用Quantity One 分析软件(Bio-Rad)对DGGE图谱进行条带识别和原始数据获取,通过分析样品电泳条带的多少来比较各个土壤样品真菌多样性的指标。其中,各处理不同时期的条带变化率采用如下公式计算:

主成分分析和聚类分析由软件Multibase_2014完成。显著性分析采用统计软件SPSS 19.0进行。
2 结果与分析
2.1 土壤微生物总DNA 提取及浓度测定
本试验采用土壤试剂盒提取微生物的总DNA,试验结果表明该方法可有效去除土壤中大量含有的腐植酸、色素和其他杂质,经DNA 纯度检测,样品A260/A280的比值在1.6~1.8 之间,表明所提取的DNA 纯度较高,可以满足PCR-DGGE 的需要(图2)。

图2 土壤微生物基因组DNA电泳图Fig.2 Electrophoresis of genomic DNA extracted from soil samples
2.2 基因组DNA的PCR 扩增
本试验为了提高样品所扩增片段的特异性,采用nested PCR 方法进行。具体为,首先选用真菌通用引物ITS1F和ITS4扩增土壤样品中提取的基因组总DNA,然后以PCR 产物为模板,用引物ITS1FGC和ITS2进行第2轮扩增(在引物ITS1F的5′端加一段GC夹子,以提高PCR 扩增产物在凝胶电泳中的解链温度,从而提高扩增片段的分离效果)。从图3可看出,nested PCR 扩增片段为一条300bp左右的条带,与预期大小一致。

图3 根际土壤真菌ITS区段PCR 产物的琼脂糖凝胶电泳Fig.3 PCR products of ITS region from soil samples on agarose gel
2.3 土壤样品的变性梯度凝胶电泳(DGGE)带谱分析
应用Quantity One软件对DGGE 图谱进行泳道和条带的自动识别,并完成统计分析(图4)。从表1可看出,3个多样性种植处理前期(B1、C1、D1)与当归单作模式前期(A1)的条带差异较大(P<0.05),说明万寿菊已经显著抑制了土壤真菌群体。从各处理的前期阶段看,当归单作(A)的泳道条带数量最多,达31条,后期为15条,其土壤中真菌种群数量在各个时期都是最高的。另外,从条带变化上看,所有处理的条带数到后期都低于前期的水平,这可能反映了土壤生态环境条件随季节变化而形成了不利于真菌的生存条件。值得注意的是,间作处理(D)在中期有一个明显的增高过程。相比较而言,从整个作物生长期看,多样性种植模式(C、D)的真菌群落比单作模式(A、B)的真菌群落更为稳定,条带变化率分别为-39.13%和-30.77%,而单作栽培模式(A、B)条带变化率达到-51.61%和-69.23%。
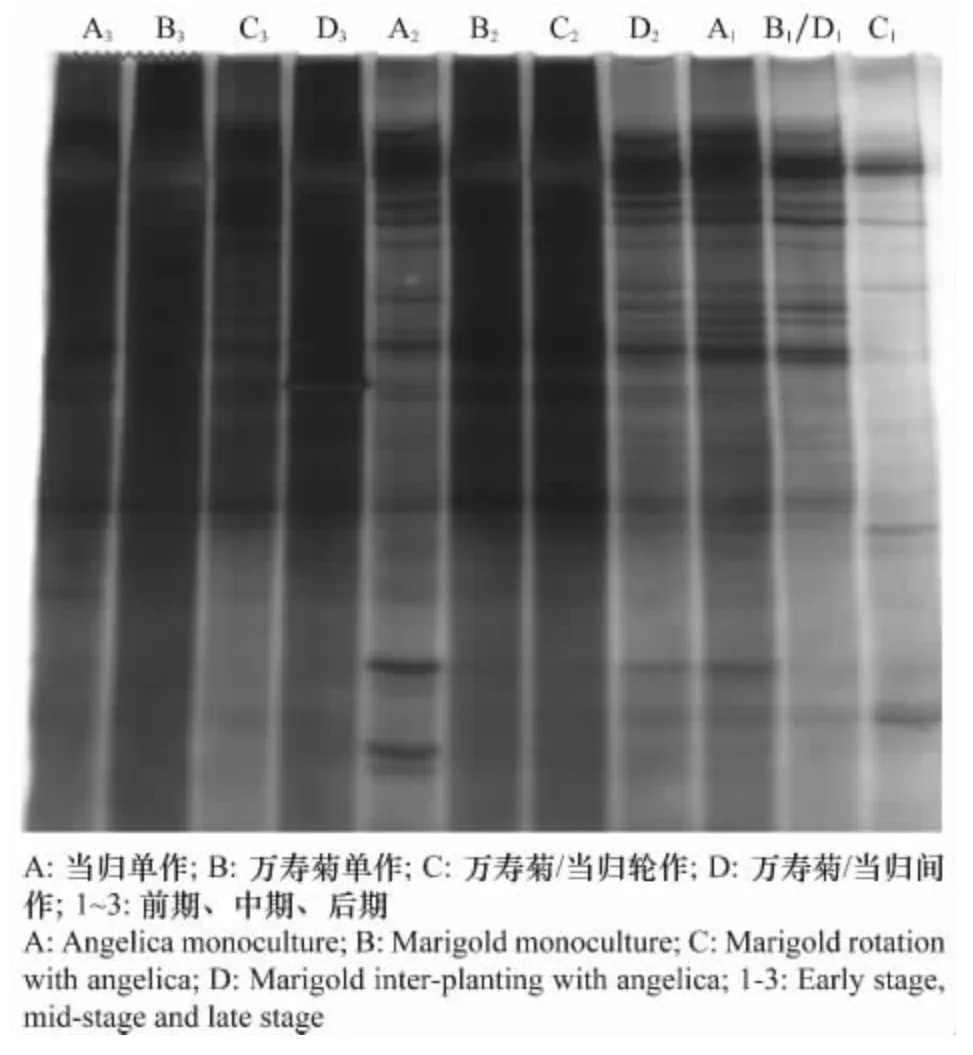
图4 各处理土壤真菌PCR-DGGE图谱Fig.4 Electrophoresis of nested-PCR products on DGGE gel
由表1还可以看出,在整个生长季节中,与前期相比,后期的条带变化率最高的是万寿菊单作(B)(-69.23%),说明在前一年种植万寿菊后,当季的万寿菊持续降低了土壤真菌多样性。说明万寿菊根系分泌物对一些土壤真菌种类产生了持续的抑制作用;当归单作处理的真菌多样性变化也较大,条带变化率为-51.61%,这也许与当归单作中前期的真菌多样性基础水平较高有关,而万寿菊/当归轮作和万寿菊/当归间作中条带变化率只有-39.13%和-30.77%。这一结果说明,与当归单作相比,采用万寿菊与当归进行间作或轮作可有效稳定土壤中的真菌群落。
2.4 不同种植模式当归土壤真菌多样性的PCA分析
对DGGE图谱进行主成分(PCA)分析,结果表明:每个处理都具有其特征性的真菌群落,尤其是当归单作的真菌种类组成与万寿菊多样性种植模式中的真菌种类组成差异较明显,说明万寿菊已经显著影响到了土壤真菌群落的组成。另外,从图5还可看出,处理内,在作物生长的不同时期,土壤真菌群落组成随季节而变化,但当归单作(A)和万寿菊单作(B)的种类差异变化较小;而万寿菊/当归间作(D)的中、后期与前期差异较大,表明万寿菊化感作用对间作处理的土壤真菌群落产生了较大的影响。

图5 各处理不同时期土壤真菌群落结构主成分分析Fig.5 PCA analysis of fungal community in soils at different growth stages
2.5 不同栽培模式下真菌群落组成的聚类分析
采用最短距离法(nearest distance)进行聚类分析和树状图构建(multibase_2014),比较各处理同一时期真菌种类组成的差异。结果表明,在同一时期,各处理间的真菌种类相似性均表现出较大差异。总体而言,对照当归单作(A)与其他处理的相似性较小,距离达到3.574 6,后期降低到2.451 4,但自始至终自成一类。这一结果表明,随土壤环境条件的变化,土壤中真菌的种类及其群体也出现了较大的变化,同时也说明万寿菊多样性种植可明显改变土壤真菌群落的组成;由图6还可看出,在整个生长期间,万寿菊单作(B)与万寿菊/当归轮作(C)真菌种类的相似性程度最高。

图6 各处理相同时期根际土壤真菌群落相似性分析Fig.6 Dendrogram of rhizosphere fungus cluster analysis at individual growth stage
3 讨论
在土壤生态领域的研究中,土壤中微生物的多样性以及微生物所产生的作用方面越来越受到关注[17-20]。土壤是各种植物赖以生存的环境,同时也是微生物良好的生存场所。合理的轮作或者间作不仅可以改变土壤的理化性质,同时对土壤微生物的多样性也有一定的影响,已有研究表明,轮作作物根系分泌的抑菌物质对土壤中寄生病原菌有一定的抑制作用,这对减少连作产生的病虫害、提高作物产量具有长远的意义[21]。吴凤芝等在研究黄瓜连作与轮作土壤微生物多样性的变化及其影响时提出轮作有利于土壤微生物种群的多样性,并可以促进和改善土壤生态环境[22]。但是也有报道称轮作对土壤的微生物多样性并非有促进作用,如娄阳洋等发现与稻田轮作后棉田中细菌的数量较棉田连作明显降低,多样性平均指数也相对略低,这也许与作物种类和栽培方式或环境有关[23]。
已有大量的研究表明,万寿菊的化感效应(allelopathy)或活性物质对包括多种真菌在内的微生物产生明显抑制作用[5,7,24-25],而且也有研究报道认为,万寿菊根系分泌物对土壤中的拮抗微生物群落产生较大影响[9-10]。本研究通过万寿菊与当归多样性种植田间试验,分析不同种植方法对土壤真菌群落的影响,结果表明,相对于当归的单作模式,万寿菊可显著影响土壤真菌群落的组成(条带变化率为-30.77%和-69.23%),说明万寿菊根系分泌物对土壤真菌可产生显著的影响。而且,PCA 分析结果也显示,不同的栽培方式可形成各自对应的真菌群落,总的趋势是降低了土壤真菌的多样性。但万寿菊的根系分泌物中是何种物质在发挥作用,这些物质对哪些土壤真菌种类有效,尤其是有益真菌变化规律是什么,以及万寿菊多样性种植模式是否具有持续性等问题还需要深入细致的研究。
[1]刘华,李正科,杨静,等.当归根腐病的病原初步研究[J].云南农业大学学报,2011,26(4):458-465.
[2]姚茹瑜,陈志星,李灶福,等.当归病原根结线虫的鉴定[J].云南农业大学学报,2010,25(1):45-48.
[3]朱有勇.农业生物多样性控制作物病虫害的效应原理与方法[M].北京:中国农业大学出版社,2012.
[4]朱有勇.遗传多样性与作物病害持续控制[M].北京:科学出版社,2007.
[5]Natarajan N,Cork A,Boomathi N,et al.Cold aqueous extracts of African marigold,Tageteserecta,for control of tomato root knot nematode,Meloidogyneincognita[J].Crop Protection,2006,25:1210-1213.
[6]Siddiqui M A,Alam M M.Studies on the nemato-toxicity of root exudates of certain species of tagetes[J].Indian Journal of Nematology,1988,18:335-337.
[7]Cannayane I,Rajendran G.Allelochemical action of certain plant extracts on eggs and juveniles ofMeloidogyneincognita(Race 3)[J].Current Nematology,2002,13:83-89.
[8]Riaz T,Khan S N,Javaid A.Effect of co-cultivation and crop rotation on corm rot disease ofGladiolus[J].Scientia Horticulturae,2009,121(2):218-222.
[9]Pudasaini M P,Viaene N,Moens M.Hatching of the root-lesion nematode,Pratylenchuspenetrans,under the influence of temperature and host[J].Nematology,2008,10:47-54.
[10]Wang K H,Sipes B S,Schmitt D P.Intercropping cover crops with pineapple for the management ofRotylenchulusreniformisandMeloidogynejavanica[J].Journal of Nematology,2003,35:30-47.
[11]Hooks C R R,Wang K H,Ploeg A,et al.Using marigold(Tagetesspp.)as a cover crop to protect crops from plant-parasitic nematodes[J].Applied Soil Ecology,2010,46(3):307-320.
[12]管丽蓉,魏环宇,董莹,等.当归/万寿菊多样性种植控制当归根结线虫病的田间效应评价[J/OL].中国科技论文在线[2014-02-26].http:∥www.paper.edu.cn/releasepaper/content/201402-525.
[13]李少锋,孙朝辉.当归高产高效栽培技术[J].云南农业,2005(4):10.
[14]活水乡农业技术服务中心.色素万寿菊栽培技术[EB/OL].[2008-07-21]http:∥www.zynw.com/lanmu2.php?lmid=10&wzid=6228.
[15]Fierer N,Breitbart M,Nulton J,et al.Metagenomic and small-subunit rRNA analyses reveal the genetic diversity of bacteria,archaea,fungi,and viruses in soil[J].Applied and Environmental Microbiology,2007,73(21):7059-7066.
[16]Steffen R J,Goksoyr J,Bej A K,et al.Recovery of DNA from soils and sediments[J].Applied and Environmental Microbiology,1998,54(12):2908-2915.
[17]罗海峰,齐鸿雁,薛凯,等.PCR-DGGE 技术在农田土壤微生物多样性研究中的应用[J].生态学报,2003,23(8):1570-1575.
[18]高玉峰,贺字典.影响土壤真菌多样性的土壤因素[J].中国农学通报,2010,26(10):177-181.
[19]刘玮,张嘉超,邓光华.不同栽培时间三叶赤楠根际微生物多样性及其PCR-DGGE分析[J].植物研究,2010,30(5):582-587.
[20]雍太文,杨文,向达兵,等.小麦/玉米/大豆和小麦/玉米/甘薯套作对根际土壤细菌群落多样性及植株氮素吸收的影响[J].作物学报,2012,38(2):333-343.
[21]Kennedy A C,Smith K L.Soil microbial diversity and the sustainability of agricultural soils[J].Plant and Soil,1995,170:75-86.
[22]吴凤芝,王学征.设施黄瓜连作和轮作中土壤微生物群落多样性的变化及其与产量品质的关系[J].中国农业科学,2007,40(10):2274-2280.
[23]娄阳洋,张海燕,翟云龙.棉花连作与稻、棉轮作土壤细菌群落结构差异分析[J].塔里木大学学报,2011,12(4):1-6.
[24]Hethelyi E,Danos B,Tetenyi P.GC-MS analysis of the essential oils of fourTagetesspecies and the anti-microbial activity ofTagetes minuta[J].Flavour and Fragrance Journal,1986(1):169-173.
[25]Gomez-Rodriguez O,Zavaleta-Mejia E,González-Hernández V A,et al.Allelopathy and microclimatic modification of intercropping with marigold on tomato early blight disease development[J].Field Crops Research,2003,83(1):27-34.

