温度、盐度、光照对蜈蚣藻丝状体生长的影响
杨 晋, 骆其君, 邱成功, 徐善良
(宁波大学 海洋学院, 浙江 宁波 315211)
温度、盐度、光照对蜈蚣藻丝状体生长的影响
杨 晋, 骆其君, 邱成功, 徐善良
(宁波大学 海洋学院, 浙江 宁波 315211)
为了研究蜈蚣藻丝状体在不同的盐度、温度、光照强度和光照周期下的生长特征,分别观察比较了5个盐度(18~46)、5个温度(10℃~30℃)、6个光照强度(500 lx~5500 lx)和6个光照周期(0L∶24D-24L∶0D)培养条件下蜈蚣藻丝状体增重量的变化。结果表明:温度实验中以20℃条件下,蜈蚣藻丝状体的相对增重率最大,为124.8%;盐度实验中以32盐度下,蜈蚣藻丝状体的相对增重率最高,为68.3%;光照强度以2500 lx条件为最佳,蜈蚣藻丝状体的相对增重率最高,为88.2%;光照周期以24L∶0D全光照条件下生长最快,蜈蚣藻丝状体的相对增重率达到197.3%。由此可见,在温度为20℃,盐度为32,光照强度为2500 lx,24 h光照的条件下,蜈蚣藻丝状体长势最好,是培育蜈蚣藻的最佳条件。
蜈蚣藻丝状体; 光照强度; 盐度; 温度; 光照周期
大型海藻不仅是海洋生态系统的生产者,还含有多种人体所必需的生理活性物质,具有重要的营养保健作用;在食品、医药卫生等诸多行业有应用[1-4]。红藻除了含有叶绿素a和b、胡罗卜素、叶黄素之外,还含有藻红素和藻蓝素;红藻中较高比例的藻红蛋白含量使得大型红藻能够充分利用叶绿素吸收很少的绿光,在水下旺盛生长,这种生存特性使红藻在海洋生态系统的能量与物质循环中具有不可替代的作用[5-8]。近年来,很多学者在红藻的生长及生化组分的研究上作了较多研究[9-12]。
蜈蚣藻(GrateloupiafilicinaC.Ag.)于红藻门(Rhodophyta)、真红藻纲(Florideophyceae)、隐丝藻目(Cryptonemiales)、海膜科(Halymcniaccae)、蜈蚣藻属(Grateloupia),为世界性的暖温带型海藻。蜈蚣藻属是海膜科内最大的一个属,全球发现大约有80余种,中国共报道32种,分布于辽宁、山东、浙江沿海,但以广东沿海为多。迄今,许多学者已对其形态分类、营养成分、生化活性物质及药用价值等方面开展了研究,并取得较大进展[13-24]。有关蜈蚣藻丝状体发育研究文献极少[25]。本文初步研究了光照强度、光照周期、温度和盐度对蜈蚣藻丝状体生长的影响,以期为今后蜈蚣藻培苗提供理论依据。
1 材料与方法
1.1 实验材料
实验材料为蜈蚣藻的自由丝状体,取培养1周后长势良好的藻体,在盐度32,温度20℃、光照12L∶12D条件下培养至指数生长期待用。
所用海水为天然海水,盐度为32,pH值为8.1。培养液为宁波大学3#营养盐母液(见表1)。1000 mL培养水体中加3#母液1 mL,并加1 mg/L氧化酯防止杂藻生长。

表1 宁波大学3#培养液配方
仪器:恒温光照培养箱4个,1000 mL三角烧瓶100个,盐度计,电子天平,离心机,筛绢,滤纸等。培养容器均以5%的HCl浸泡过夜,洗净后经120℃烘箱消毒后备用。
1.2 方法
1.2.1 试验设计
盐度实验设5个梯度,分别为盐度18、25、32、39和46,在光照2500 lx,温度20℃,光照周期12 h下进行21 d;光照强度实验设6个梯度,分别为500、1500、2500、3500、4500和5500 lx,在盐度32,温度20℃,光照周期12 h下进行7 d;光照周期也设6个梯度,分别为0L∶24D、4L∶20D、8L∶16D、12L∶12D、16L∶8D、20L∶4D和24L∶0D,在盐度32,温度20℃,光照2500 lx下进行21 d;温度实验设5个梯度,分别为10℃、15℃、20℃、25℃和30℃,在盐度32,光照2500 lx,光照周期12 h下进行14 d;每个梯度均设3个平行。
另设一组生长连续测定组,共27个培养瓶。光照强度2000 lx,光照周期为12L∶12D,温度为20℃,盐度为32。每隔3 d随机取3瓶,收集藻体称湿重,连续培养29 d。
1.2.2 试验方法
试验容器为1000 mL的三角烧瓶,培养液加至1000 mL。高盐度组用饱和NaCl溶液调配而成,低盐度组用纯净水调配,温度和光照用恒温光照培养箱控制。
将处于指数生长期的蜈蚣藻丝状体,用筛绢过滤后经点切机切碎至200~450 μm大小,将藻体充分搅拌至分布均匀后,用注射器抽取2 mL藻液,经离心后滤纸吸干水分,称量得初始湿重,取3次平均值为0.249 g。然后在每个试验瓶中用注射器加入相同的藻液2 mL开始培养。
实验结束后收集各瓶中的丝状体样品,过滤后用纯净水反复冲洗,用滤纸吸干水分后再次称其湿重。
1.3 数据处理与统计
实验数据采用SPSS21.0软件中单因子方差分析和多重比较分析,以P<0.05作为差异显著水平。
绝对增重量=试验后湿重-初始湿重
相对增重率=(绝对增重量/初始湿重)×100%
2 结果
2.1 蜈蚣藻丝状体生长曲线
蜈蚣藻自由丝状体在人工培养下,29 d内的密度变化见图1。由图1可知,接种后的1~5 d,藻体进入延缓期,生长缓慢;5 d后进入指数生长期;17 d后进入平台期。求得培养天数与藻体密度间的关系式为:
y=e-05x4-0.0007x3+0.0127x2-0.019x+0.619

图1 蜈蚣藻丝状体生物量的藻体密度曲线图

图2 不同光照强度下蜈蚣藻丝状体的生长
2.2 光照强度对蜈蚣藻丝状体生长的影响
不同光照强度下蜈蚣藻丝状体的生长情况见图2。从图2可以看出,光照对蜈蚣藻丝状体生长的影响显著(P<0.05),总体呈单峰型分布;2500 lx以下的两个光照组生长极差,相对增重率低于20%;但当光照强度达到2500 lx时,蜈蚣藻丝状体的增长量达到最大值,相对增重率高达近90%,显著高于其他各试验组(P<0.05);此后随光照强度继续增加,蜈蚣藻丝状体的绝对增长量和相对增长率都逐渐下降,5500 lx组的相对增重率不及2500 lx时的1/2。
2.3 盐度对蜈蚣藻丝状体生长的影响
不同光照强度盐度下蜈蚣藻丝状体的生长见图3。从图3可见,不同盐度下蜈蚣藻丝状体的生长也呈现单峰型;随着盐度从18提高到32,丝状体的生长也逐步提高,盐度32组达到最高峰,相对增重率达到68.3%,此后,随盐度继续升高而下降,32组的增重率显著高于其他4个盐度组,是其他组的2倍多。

图3 不同盐度条件下蜈蚣藻丝状的生长
2.4 温度对蜈蚣藻丝状体生长的影响
不同温度条件下蜈蚣藻丝状体的生长见图4。从图4可见,当温度为10℃和30℃时,蜈蚣藻丝状体出现负增长,尤以30℃组为甚;至15℃组丝状体的生长迅速增加,20℃组的绝对增长量和相对增重率长势最好,达到最大值,分别为0.155 g和124.8%;25℃时,蜈蚣藻丝状体的绝对增长量有所下降。

图4 不同温度条件下蜈蚣藻丝状体的生长
2.5 光照周期对蜈蚣藻丝状体生长的影响
不同光照周期下蜈蚣藻丝状体的生长见图5。从图5可以看出,全黑暗条件下,蜈蚣藻丝状体出现负增长,湿重下降了47.8%;从一天4 h光照至24 h全天光照,丝状体生长与光照时间呈直线正相关,得到拟合方程为:y=0.0232x-0.0857,24h光照组的增长率超过所有试验组,达到197.3%。

图5 光照周期对蜈蚣藻丝状体生长的影响
3 讨论
3.1 光照强度和光照周期与蜈蚣藻丝状体的生长
植物的生长离不开光照,蜈蚣藻丝状体也不例外。在饱和光照强度内,随着光强的增加,藻类的光合速率加快。不同的光照强度下,蜈蚣藻丝状体的生长存在明显差异。由图2可以看出,当光强为500 lx时,蜈蚣藻丝状体培养一个实验周期后重量几乎没有增加,这是因为光能自养型生物须达到光补偿点才开始生长[26],显然500 lx的光照强度刚好接近蜈蚣藻丝状体生长所需的光补偿点,光合作用产生的有机物几乎全部用于其呼吸作用所消耗,蜈蚣藻丝状体体内有机物产量无法积累,以致其几乎不生长;当光照强度为2500 lx时,蜈蚣藻丝状体的增长量达到顶峰,这说明在该光照强度下,蜈蚣藻丝状体细胞的生命活动旺盛,无论是光合作用还是呼吸作用都很强,指数生长期的持续时间长,藻的密度更大,蜈蚣藻丝状体净光合作用量最大,有机物的积累量最高,表现为蜈蚣藻丝状体的快速增长。所以,蜈蚣藻丝状体生长的最适光照强度为2500 lx,低于或高于这个值都会抑制其生长。
还可发现,光强小于2500 lx时藻体增重率小;而达到2500 lx时,藻体的增重率骤增;2500 lx后藻体增重逐渐减小。这是因为光合作用包括光反应和暗反应, 光反应受温度的影响较小, 而暗反应是一系列酶促反应过程, 受温度的影响较大,不管哪种反应受阻或速率下降, 都将会影响植物光合作用。研究表明, 当光强高于植物光饱和点后PSò部位会发生光抑制的现象。而高温胁迫又易引起光合作用下降, 植物因呼吸作用升高而造成饥饿伤害等[27]。这说明2500 lx可能是其藻体光合作用被大量激发的一个阈光强值。同时也为蜈蚣藻光饱和点光强值。因此,达到这一光强时光合速率突然增大,藻体生长急速加快。光照强度高于2500 lx之后,藻体生长受到抑制,藻体增重率缓慢降低,表现为强光照抑制作用。
藻类的生长不仅需要光,而且与光照时间的长短也密切相关。本实验中,蜈蚣藻丝状体的生长随光照时间的延长而加快。发现当光照周期为24 h(即24L∶0D)时,蜈蚣藻丝状体的增长量最大,长势最好;在黑暗下,蜈蚣藻丝状体重量不增反降。说明蜈蚣藻丝状体生长率与光照时间成正比。
植物根据其对光照时间的适应分为长日照植物(14~17 h)和短日照植物(8~12 h),以及中间性植物。中间性植物对光照长短无严格要求。所以,根据蜈蚣藻丝状体对光照周期试验结果,推测蜈蚣藻虽为大型海藻,其丝状体可能属于长日照性植物,凌晶宇等对巨藻[Macrocystispyrifera(L.)Ag]幼苗进行试验后也得出与本实验相类似的实验结果[28]。
3.2 盐度对蜈蚣藻丝状体生长的影响
蜈蚣藻为大型海水藻类,一般生长在较高盐度的海水中。图3结果证明,当盐度低于等于25时,蜈蚣藻丝状体生长受到抑制,增重缓慢;当盐度达到32时,蜈盐度蚣藻丝状体增长迅速并达到顶峰;随盐度升高至39以上时,蜈蚣藻丝状体的生长再次受到抑制。产生这一现象的根本原因与蜈蚣藻的组织细胞结构有关。多糖作为海藻的最主要成分,含量达60%左右,因此多糖构成的海藻细胞壁要比陆地植物的细胞壁厚,植物组织和细胞结构与其耐盐性是密切相关的,盐度的变化影响植物体内渗透压发生改变,进而影响到蜈蚣藻丝状体对营养盐的吸收利用。当环境盐度低于32时,蜈蚣藻丝状体处于低渗环境中,藻体吸水膨胀,只有少量的营养盐随渗透作用被藻体吸收利用,藻体生长缓慢,待渗透压达到平衡后藻体由于得不到充足的营养而停止生长;当环境盐度高于32时,蜈蚣藻丝状体处于高渗环境中,藻体细胞易大量失水从而使得代谢减慢,抑制藻体生长;当环境盐度在32附近时,藻体处于最适渗透压中,内外渗透压保持平衡,营养盐与水分的运输也保持在一个动态平衡的状态,从而可以使藻体源源不断地吸收利用培养液中的营养,延长其指数生长期的持续时间,促进了藻体营养物质的合成与积累。所以,可以认为蜈蚣藻丝状体生长的最适盐度为32左右。而且,蜈蚣藻一般生活在低潮带岩石上或石沼中,广泛分布于温带和热带水域[25],在红树林海滩,低潮带盐度可达20~35,与本实验结果相符。从图3还可知,不同盐度下生长曲线比较对称,说明蜈蚣藻对低盐度和高盐度都具有较高的敏感性。因此盐度的变化对蜈蚣藻的形成和消亡具有重要影响。
3.3 温度对蜈蚣藻丝状体生长的影响
温度是影响藻类生长和繁殖的又一重要环境因子。藻类对温度的耐受能力因种类不同而存在很大的差异,各种藻类对温度的要求不同,有其各自的适温范围,大多数藻类的适温范围较宽[29]。图4表明,蜈蚣藻丝状体的生长适温为15~25℃,最适温度为20℃。这与房历生等对切段蜈蚣藻体离体再生的实验结论一致[30]。10℃的低温和30℃高温都严重抑制了该藻的生长,在这两个温度下,蜈蚣藻丝状体的重量不增反降。有些研究者认为,对于光合自养生物而言,当超出适宜温度范围时,温度主要是通过控制物质与能量代谢过程中的酶的动力学来影响其生长。因此,在10℃的低温下,丝状体内相关酶的活性受到抑制;在30℃的高温下,相关酶由于发生了蛋白质变性而失活,从而都抑制了藻体的生长,致使其无法生长,之所以会出现重量不增反降,可能是因为在不良的温度条件下蜈蚣藻丝状体生长代谢紊乱,甚至发生藻体因死亡而分解,重量减轻。此外,超出适温范围可能使藻类出现了不同程度的质壁分离现象,而引起损害作用的发生[27]。
3.4 蜈蚣藻丝状体的培养与采收
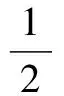
[1]李卫东, 吴 茜, 蒋 丹,等. 蜈蚣藻属海藻的应用及人工养殖前景展望[J]. 河北渔业, 2012,11(19):48-54.
[2]徐中平, 腾照军, 王 波,等. 中国海藻生产与加工利用的现状、存在问题及发展策略[J]. 安徽农业科学,2012,30:14961-14963.
[3]丁兰平, 黄冰心, 谢艳齐. 中国大型海藻的研究现状及其存在的问题[J]. 生物多样性,2011(06):798-804.
[4]曾呈奎, 张德瑞, 张竣甫,等. 中国经济海藻志[M]. 北京:科学出社,1996:128-131.
[5]刘鲁宁, 张玉忠. 红藻光合作用捕光复合物和光合膜的超分子结构、功能及生态适应性[D], 济南:山东大学, 2008:1-3.
[6]方玉春, 王 毓, 罗 艳,等. 中国药用红藻资源调查及开发利用建议[J]. 中国海洋药物,2010(03):63-67.
[7]韩 玲, 张淑平, 刘晓慧. 海藻生物活性物质应用研究进展[J]. 化工进展,2012(08):1794-1800.
[8]初少华, 唐永政, 张树宝,等. 海藻组织培养研究进展[J]. 水产科学,2011,30(4):41-47.
[9]钟志海, 黄中坚, 陈伟洲. 不同环境因子对异枝江蓠的生长及生化组分的影响[J]. 渔业科学进展,2014(03):98-104.
[10]陈伟洲, 钟志海, 金玉林,等. 光照强度、温度和盐度对鹿角沙菜生长及生化组分的影响[J]. 南方水产科学,2014(02):48-53.
[11]陈素文, 陈利雄, 朱长波,等. 环境因子对海萝藻体生长及成活的影响[J]. 南方水产科学,2014(03):92-96.
[12]胡凡光, 郭萍萍, 王 娟,等. 水温、盐度、pH和光照度对龙须菜生长的影响[J]. 渔业现代化,2013(04):23-27.
[13]方玉春, 赵 峡, 王顺春. 蜈蚣藻药用研究进展[J]. 中国海洋药物, 2011,30(2):58-61.
[14]戚贵成. 辽宁沿海海膜科蜈蚣藻属的初步研究[D]. 辽宁:辽宁师范大学,2009:2-3.
[15]付晓婷, 秦子涵, 许加超,等. 带形蜈蚣藻营养品质的分析和评价[J]. 营养学报,2011(02):199-200,203.
[16]张婧婧, 刘秋凤, 吴成业. 蜈蚣藻多糖降血糖及降血脂活性的研究[J]. 福建水产,2014(01):21-28.
[17]张婧婧, 刘秋凤, 吴成业. 蜈蚣藻多糖纯化及抗氧化作用的研究[J]. 福建水产,2013(05):362-367.
[18]Olivier D, Brigitte G, Suzanne F, et al. Systematics ofGrateloupiafilicina(Halymeniaceae, Rhodophyta) based on rbcL sequence analyses and morphological evidence, including the reinstatement ofG.minimaand the description ofG.capensissp. nov [J]. Eur J Phycol, 2004, 36: 186-203.
[19]Kawaguchi S, Wang H W, Horguchii T, et al. A comparative study of the red algaGrateloupiafilicina(Halymeniaceae) from the Northwestern Pacific and Mediterranean with the description ofGrateloupiaasiatica, sp. Nov. [J]. Journal of Phycology, 2001, 37: 433-442.
[20]Lin S M, Liang H Y.Grateloupiahuangiae(Halymeniaceae, Rhodophyta), a new species from Taiwan previously confused withPolyopeslancifolius, with emphasis on the development of the auxiliary-cell ampullae [J]. Phycologia, 2011, 50 (3): 232-240.
[21]Baweja P, Sahoo D. Regeneration studies inGrateloupiafilicina(J.V. Lamouroux)C.agardhan important carrageenophyte and edible seaweed [J]. Algae, 2009, 24 (3): 163-168.
[22]李雅琪, 张朝晖, 潘俊芳,等. 蜈蚣藻抗肿瘤活性及其化学成分研究[J]. 中国海洋药物,2010(06):29-33.
[23]马袆博, 季莉莉, 王顺春,等. 蜈蚣藻多糖拮抗黄药子诱导肝毒性的实验研究[J]. 药学学报,2013(08):1253-1258.
[24]周 玲, 白志川, 丁 侃. 蜈蚣藻的活性成分及其药理活性研究进展[J]. 中药材,2011,34(1):147-150.
[25]魏小娇. 温度和光强对带形蜈蚣藻(Grateloupiaturuturu)丝状体发育的影响及白氏鹿角菜(Silvetiababingtonii)的早期发育[D], 青岛:中国海洋大学,2013:1-2.
[26]Raven J A, Geider R J. Temperature and algal growth[J]. NewPhycol, 1988, 110: 441- 461.
[27]汤文仲, 李信书, 黄海燕,等. 不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响[J]. 水产学报,2009,33(5):762-769.
[28]凌晶宇, 梁洲瑞, 孙修涛,等. 巨藻幼苗光合、呼吸作用的初步研究[J]. 水产学报,2014(06):820-828.
[29]陈艳拢, 杨建洪, 赵冬至,等. 海温季节性变化对藻类生长影响的定量研究[J]. 海洋环境科学,2013(01):104-110.
[30]房历生, 肖培华. 蜈蚣藻离体再生的初步观察[J]. 海洋科学,1985,9(1):52-54.
Effects of temperature, salinity and light on growth ofGrateloupiafilicinafilament
YANG Jin, LUO Qi-jun, QIU Cheng-gong, XU Shan-liang
( School of Marine Sciences, Ningbo University, Ninbo 315211, China )
To study the growth characteristics ofGrateloupiafilicinafilamentous under different salinity, temperature, light intensity and light cycle, the weight gain and changes ofG.filicinafilamentous in 5 kinds of salinity (18-46), 5 levels of temperature (10℃-30℃), 6 light intensitieies(500 lx-5500 lx) and 6 photoperiods(0L∶24D-24L∶0D) culture conditions were observed and compared. The results showed as follows. In the temperature experiments, the relative growth rate ofG.filicinafilamentous is the maximum of 124.8% at 20℃; in the salinity experiments, the relative growth rate ofG.filicinafilamentous is the maximum of 68.3% with 32 salinity; the light intensity experiments, 2500 lx is the best condition for the relative growth rate ofG.filicinafilamentous, which is the maximum of 88.2%; the light cycle experiments, 24L∶0D photoperiod is the most situable, the growth ofG.filicinafilamentous with the maximum growth rate of 197.3%. Thus, in the condition of 20℃, for the salinity of 32, light intensity of 2500 lx, and under 24 h light cycle,G.filicinafilamentous grows best.
Grateloupiafilicinafilament; light intensity; salinity; temperature; light cycle
2014-09-11;
2014-10-22
浙江省海洋环保项目(WZHX2012-10-116)
骆其君,硕士,副教授,主要研究方向为海藻生物技术,E-mail:luoqijun@nbu.edu.cn。
Q949.2
A
2095-1736(2015)02-0065-05
doi∶10.3969/j.issn.2095-1736.2015.02.065

