火焰原子吸收光谱法测定复杂再生锌原料中的铅量
杨德利,庞文林
(湖南有色金属研究院,湖南长沙 410100)
再生锌是由废旧铝和废锌合金材料或含锌的废料,经重新熔化提炼而得到的锌合金或锌金属,是金属锌的一个重要来源。再生锌原料来源复杂、成分多样,大部分再生锌原料(如锌合金、锌渣等)用稀酸或王水就能将其溶解完全;含碳、硅量较高的再生锌原料(如瓦斯灰、氧化锌原矿等),一般采用王水+氢氟酸+高氯酸将其分解完全;含钨、钼量较高的再生锌原料,若采用酸溶法,试样有可能分解不彻底,造成铅结果偏低;含钡、硫量较高的再生锌原料,溶样过程中可能会产生BaSO4-PbSO4混晶共沉淀现象,导致铅结果偏低甚至超差。为了避免上述问题出现,对于组成复杂的再生锌原料中铅量的测定,采用碱熔(过氧化钠+氢氧化钠)的分解方法,辅以盐酸中和及酸化。试验表明,试样分解完全,试液清亮,结果稳定可靠,铅量测定范围0.10% ~5.00%。
1 试验部分
1.1 仪器与试剂
1.TAS-990原子吸收分光光度计(北京普析通用产);附铅空心阴极灯。
2.火焰类型:空气-乙炔。
3.过氧化钠、氢氧化钠:分析纯。
4.盐酸:分析纯。
5.硝酸:分析纯。
6.铅标准贮存溶液:称取1.000 0 g高纯铅(≥99.99%)于300 mL的烧杯中,加入50 mL硝酸,微热溶解,取下冷却,移入1 000 mL容量瓶中,以水洗烧杯合并于容量瓶中,用水稀释至刻度,混匀。此溶液1 mL含1 mg铅。
7.铅标准溶液:移取10.00 mL铅标准贮存溶液置于100 mL容量瓶中,加入5 mL硝酸,用水稀释至刻度,混匀。此溶液1 mL含100μg铅。
除非另有说明,本部分所用试剂均为符合国家标准或行业标准的分析纯试剂,所用水均为蒸馏水。
1.2 试验方法
准确移取铅标准溶液5.00 mL于100 mL容量瓶中,加入10 mL盐酸(1+1),用水稀释至刻度,混匀,按仪器工作条件测定其吸光度。仪器工作条件见表1。
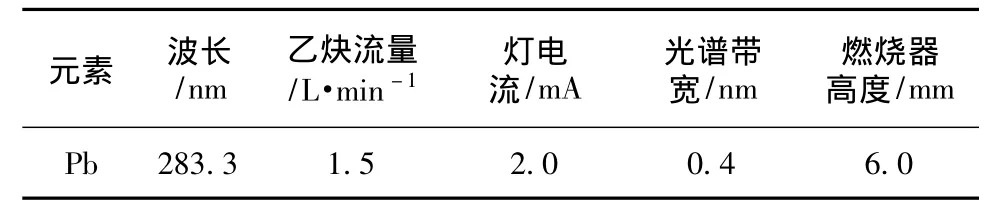
表1 仪器工作条件
2 结果与讨论
2.1 坩埚的选择
为了除去样品中的碳、硅、硫、有机物且使试样充分氧化,试验选择Na2O2为氧化剂、NaOH为助溶剂,分别用铁坩埚、镍坩埚和银坩埚进行样品的熔融分解。试验表明,碱熔法对三种坩埚的腐蚀都较大,但试样中铅的测定结果基本一致,考虑到银坩埚成本高,铁坩埚没有镍坩埚耐用,所以本试验选用镍坩埚进行熔样。
2.2 熔样温度
分别称取0.10 g试验样1#(精确0.000 1 g)于镍坩埚中,加入3 g过氧化钠和1.5 g氢氧化钠,放入马弗炉内,选择不同的温度进行试验,结果见表2。

表2 温度试验
表2表明,温度对结果影响不大,但是温度越高,对坩埚的腐蚀越严重,所以试验选用550℃。
2.3 熔样时间
分别称取0.10 g试验样1#(精确0.000 1 g)于镍坩埚中,加入3 g过氧化钠和1.5 g氢氧化钠,放入马弗炉内,从低温升温至550℃并保持,选择不同的时间进行试验,结果见表3。

表3 时间试验
由表3可以看出:熔样时间为10 min时试样已完全分解,且时间越长对坩埚的腐蚀越严重,该试验选用15 min为熔样时间。
2.4 酸介质的选择
试样经Na2O2、NaOH熔融分解后,一般选择具有还原性的盐酸来酸化,并且在盐酸介质中,铅有较好的吸光度且稳定,故试验采用盐酸介质。
2.5 酸度的影响
在一组100 mL容量瓶中加入铅标准溶液及不同体积的盐酸,配制成铅浓度为5.00μg/mL的溶液,按试验方法及选定的仪器工作条件测定其吸光度,试验结果见表4。

表4 酸度试验结果
表4表明:盐酸的酸度在1% ~10%之间,对铅的测定没有明显影响,但铅的吸光度随着盐酸浓度的增加略有下降,且酸度太大,对原子吸收仪器的雾化系统有腐蚀作用,因此试验选用5%的盐酸介质。
2.6 共存元素的干扰试验
复杂再生锌原料中主要元素为Zn、Fe、Pb外,还掺杂有 Cu、Cd、Si、Ca、K、Na、C、S、Mn、Al、Sb、Bi、Sn等杂质元素。
2.6.1 单个元素对铅测定的影响
将复杂再生锌原料中的主要元素Zn、Fe以及碱熔带进的Na元素、镍坩埚熔出的Ni元素,这4种元素以给定其含量最大值的1.5倍分别加入到一系列铅标准(5.00μg/mL)溶液中进行吸光度测定。试验表明,测定溶液中存在以上含量范围内的单个元素对铅的测量无明显影响。
2.6.2 混合共存元素对铅测定的影响
再生锌原料中的C、S元素在碱熔时已灼烧除去,现将 Cu、Na、Ni、Cd、Si、Ca、K、Na、Mn、Al、Sb、Bi、Sn这十三种元素以一定量同时加入到铅标准溶液(5.00μg/mL)中。按试验方法及选定的仪器工作条件进行吸光度测定,试验证明,测定溶液中同时存在以上共存元素不影响铅的测定。
3 样品分析
随同试样做空白试验。
3.1 分析方法
准确称取试样0.20 g(精确至0.000 1 g),置于预先加有2 g过氧化钠和1.5 g氢氧化钠的30 mL镍坩埚中,用圆头小玻棒搅匀,以一小片定量滤纸擦净玻棒,用尖嘴镊子夹住纸角,置于坩埚上端燃烧,使其残渣落入坩埚中,然后均匀地覆盖1 g过氧化钠[1]。将镍坩埚置于电热板上烘烤至过氧化钠呈焦黄色,稍冷,转移置马弗炉内,从低温升至550℃并保持15 min,取出,冷却。擦净坩埚底部,将镍坩埚放入250 mL烧杯中,盖上表面皿,缓慢加入50 mL热水,待反应平缓后,用热水洗净坩埚,加入20 mL盐酸,将烧杯置于电热板上,加热微沸1~2 min,取下冷却至室温,移入100 mL容量瓶中,用水定容。根据铅含量移取相应体积于100 mL容量瓶中,补加适量盐酸,用水稀释至刻度,混匀。使用空气-乙炔火焰于原子吸收光谱仪波长283.3 nm处,仪器最佳条件下测定试样的吸光度,从工作曲线上查出相应的铅浓度。
3.2 标准曲线的绘制
准确移取 0 mL、1.00 mL、2.50 mL、5.00 mL、7.50 mL、10.00 mL铅标准溶液(100μg/mL)于一组100 mL容量瓶中,加入10 mL盐酸(1+1),用水稀释至刻度,混匀。此系列标准溶液每毫升含0μg、1.00 μg、2.50 μg、5.00 μg、7.50 μg、10.00 μg 铅。使用空气-乙炔火焰,于原子吸收光谱仪波长283.3 nm处,以水调零,测量“零浓度”溶液及系列标准溶液的吸光度。以铅浓度为横坐标,吸光度(减去零浓度溶液的吸光度)为纵坐标绘制铅的工作曲线。其工作曲线如图1所示。
3.3 准确度试验
称取0.200 0 g锌浮渣(Pb含量为0.067%),分别加入不同量的铅标准溶液,按试验方法进行分解、测定,结果见表5。
由表5可知,该方法准确度高,能满足测定要求。
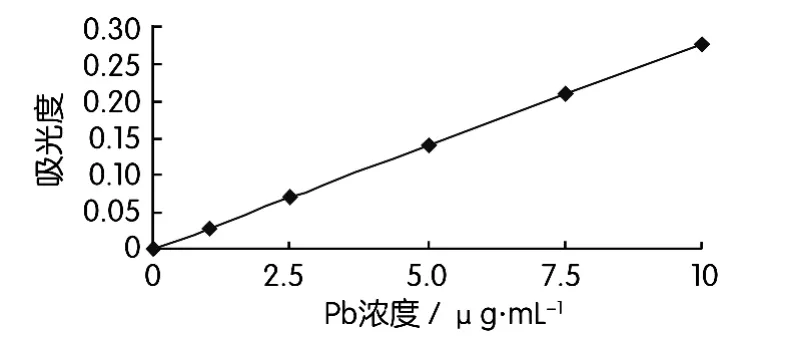
图1 铅标准溶液工作曲线
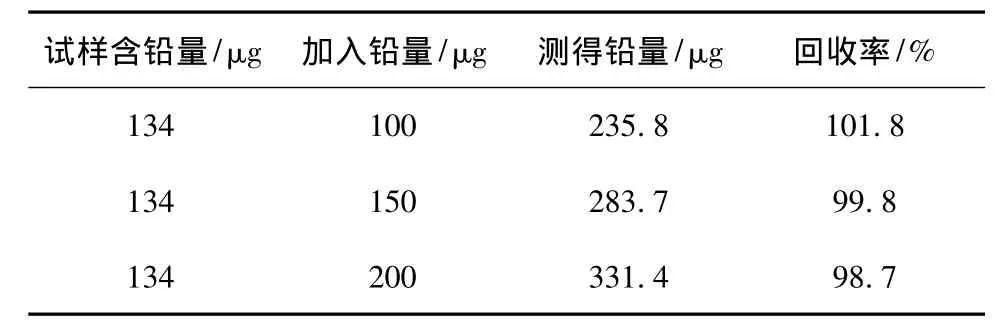
表5 准确度试验结果
3.4 精密度试验
按试验方法分别称取锌浮渣、瓦斯灰(随同试料做空白试验),按试验方法进行分解、测定,结果见表6。
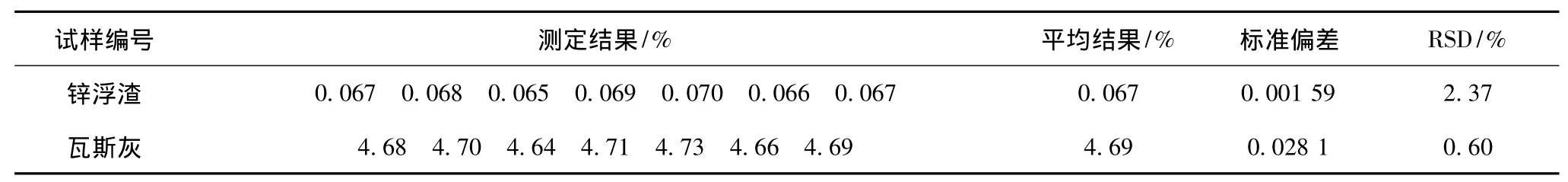
表6 精密度试验结果
由表6可见,相对标准偏差均小于2.40%,精密度好。
4 结论
试验结果表明,该方法操作简便、适用范围广、稳定性好、精密度高,加标回收率在 98.7% ~101.8%之间,完全满足复杂再生锌原料中铅量(0.10% ~5.00%)的测定要求。
[1] GB/T 6150.15-1985,中华人民共和国国家标准[S].

