盐酸他喷他多缓释片的研制及体外释放考察
刘阿敏,丁 斌,王 磊,李德刚,李晓祥
(1.安徽中医药大学,安徽合肥 230012;2.安徽省新星药物开发有限责任公司,安徽合肥 230088)
盐酸他喷他多(tapentadol hydrochloride)是一类同时具有μ-阿片受体激动作用和去甲肾上腺素再摄取抑制作用的双重作用机制的新型中枢止痛剂,对急性、慢性和神经性疼痛均具有较好的镇痛疗效[1]。与其他阿片类药物和非甾体类抗炎药(NSAIDs)相比,其副作用方面得到改善,提高了阿片类药物的安全性和耐受性[2]。慢性疼痛患者需长期服药,用普通制剂治疗时往往依从性较差,且血药浓度波动大,安全指数低[3]。将盐酸他喷他多开发为缓释制剂可减少病人服药次数,增加病人的顺应性,能最大限度的降低药物的毒副作用,提高药物的临床治疗效果,增加药物的安全性和稳定性。盐酸他喷他多缓释片于2011年8月获得美国FDA批准上市,国内目前还没有盐酸他喷他多缓释片相关研究报道和产品上市,将其制成12 h缓释片,将为临床提供一种更加长效、安全的镇痛缓释制剂。
盐酸他喷他多在水中极易溶解,主要在胃和小肠吸收,制备为12 h亲水凝胶骨架片的研究重点是控制其前期突释效应,且保证后期释放完全,本研究以HPMC与CMC-Na为凝胶混合骨架材料制备了盐酸他喷他多缓释片,并采用正交实验设计优化处方,且将最佳处方制备的缓释片的体外释放数据与参比制剂释放参数进行比较。
1 仪器与试药
1.1 仪器 ZRS-8GD型智能溶出试验仪(天津天大天发科技有限公司);AB135-S型电子天平(德国梅特勒公司);FA1104N电子天平(上海民桥精密科学仪器有限公司);DP30型单冲压片机(北京国药龙立科技有限公司);片剂硬度测定仪(上海黄海药检仪器厂);UV-2450型紫外可见分光光度计(日本岛津)。
1.2 试药 盐酸他喷他多原料(安徽省新星药物开发有限责任公司制备,批号:20140101,含量:99.91%,纯度:99.84%);盐酸他喷他多对照品(安徽省新星药物开发有限责任公司制备,批号:20140103,含量:99.90%,纯度:99.92%)。磷酸二氢钾(国药集团化学试剂有限公司);氢氧化钠(国药集团化学试剂有限公司);羟丙基甲基纤维素(规格K4M、K15M、K100M,上海昌为医药辅料技术有限公司);羧甲基纤维素钠、微晶纤维素、预胶化淀粉、乳糖、微粉硅胶、硬脂酸镁(安徽山河药用辅料股份有限公司),试剂均为分析纯。
2 方法与结果
2.1 盐酸他喷他多缓释片的制备 原料、骨架材料及填充剂分别过100目筛,按处方量称取、混匀,湿法制粒,以5%PVP(K30)85%的乙醇溶液制软材,过20目筛制粒,(60±5)℃干燥约2 h,干燥后颗粒过14目筛整粒,加入处方量的硬脂酸镁和微粉硅胶,混匀,采用直径9 mm浅凹冲模压片,压力控制在9~10 kg左右。
2.2 盐酸他喷他多缓释片释放度测定方法
2.2.1 测定波长的选择 精密量取盐酸他喷他多适量,以pH6.8磷酸盐缓冲液为溶剂,配制成质量浓度为56 mg·L-1的溶液,以pH6.8磷酸盐缓冲液为空白,按紫外分光光度法在200~400 nm波长范围内扫描。紫外扫描图谱如图1。
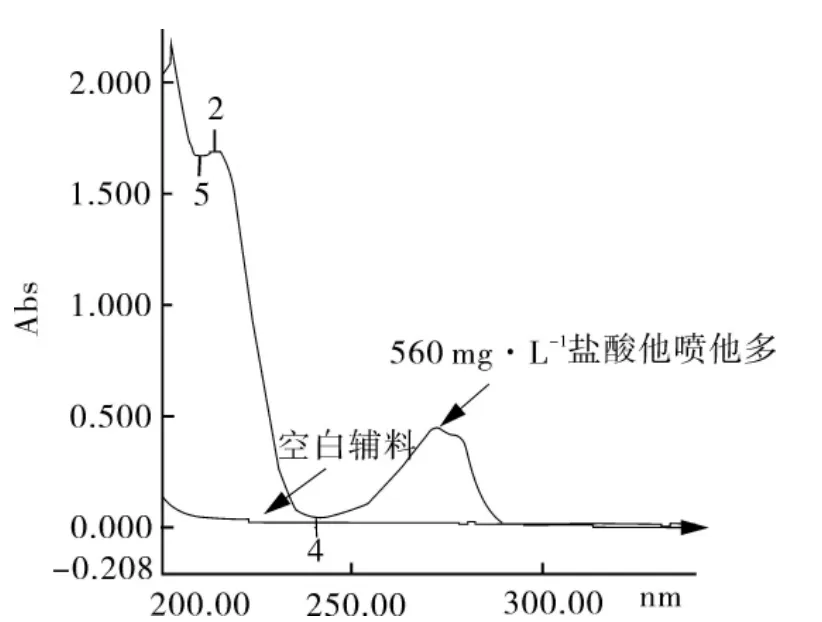
图1 pH6.8介质中对照品和空白辅料波长扫描图
由图1可知盐酸他喷他多在272与214、203 nm处有最大吸收,由于在214 nm与203 nm处为末端吸收,固选择272 nm作为检测波长。按处方比例称取辅料,同法操作,在此波长下辅料无吸收干扰。
2.2.2 标准曲线的建立 精密称取盐酸他喷他多对照品约64.7 mg,置于100 mL容量瓶内,加 pH 6.8磷酸盐缓冲液适量溶解,稀释至刻度,摇匀,从中精密量取1 mL定容至10 mL得浓度为55.56 mg·L-1的对照品溶液。精密量取 0.5、2.5、5、10、20 mL置5个100 mL量瓶中,加释放介质稀释至刻度,摇匀,作为线性溶液。照紫外—可见分光光度法(2010版中国药典二部附录Ⅳ A),取上述溶液在272 nm处测定吸光度,以质量浓度C与吸光度A进行线性回归,得回归方程:A=0.007 8C+0.014 2
(R2=0.999 2,r=0.999 5),表明盐酸他喷他多浓度在 2.78 ~111.12 mg·L-1范围内线性关系良好。
2.2.3 精密度实验 取上述对照品溶液(55.56 mg·L-1),于272 nm波长处重复测定6次,结果RSD=0.35%(n=6),表明仪器精密度良好。
2.2.4 稳定性实验 取上述对照品溶液(55.56 mg·L-1),室温放置,分别于 0、2、4、6、8、10、12、16、20、24 h取样,在272 nm处重复测定吸光度,结果RSD=0.55%,表明溶液稳定性良好。
2.2.5 准确度试验 精密量取盐酸他喷他多对照品11.65、29.12、46.59、58.24 mg(以他喷他多计,分别相当于他喷他多 10、25、40、50 mg)各3 份,分别置100 mL容量瓶中,再按处方比例加入空白辅料,加pH 6.8的磷酸盐缓冲溶液稀释至刻度,精密量取续滤液1 mL置10 mL的容量瓶,加释放介质稀释至刻度,平行配置3份,在272 nm处测定吸光度。结果平均回收率为100.43%,RSD为0.81%,表明回收率符合要求。
2.3 盐酸他喷他多缓释片体外释放度测定方法[4]
取本品,照释放度测定法(2010版中国药典二部附录ⅩD第一法),采用溶出度测定法第二法装置(加沉降装置),以磷酸盐缓冲液(取磷酸二氢钾6.805 g,加1 mol·L-1氢氧化钠溶液22.4 mL,加水使成1 000 mL,pH值为6.8)900 mL为释放介质,转速为 100 r·min-1,依法操作,于 0.5、3、6 和 10 h时,分别取溶液10 mL,滤过,并即时补充相同体积、相同温度的释放介质,取续滤液,照紫外-可见分光光度法(2010版中国药典二部附录Ⅳ A),在272 nm处分别测定吸光度;另取盐酸他喷他多对照品适量,精密称定,加释放介质溶解并稀释制成每1 mL中约含他喷他多55.56μg的溶液,同法测定。分别计算每片在不同时间的累积释放量。
2.4 盐酸他喷他多缓释片单因素考察 本研究采用相似因子法评价药物释放曲线间的差异,相似因子系数f2可反映释放度差异,f2在50~100之间说明两曲线相似,f2=100说明两条曲线释放完全相同[5],相似因子系数f2越小,释放曲线间差异越大,相似因子系数计算公式:

2.4.1 不同规格HPMC对释放度的影响 分别取相同粒度不同规格的 HPMC(K4M、K15M与K100M),用量均占总质量35%,乳糖为致孔剂占15%,微晶纤维素用于调节片重,分别制备缓释片,取6片测定释放度,采用相似因子法对释放曲线之间进行相似性判定,释放曲线如图2。

图2 不同规格HPMC释放曲线比较(n=6)
三组释放曲线计算得相似因子值为fAB=54.89,fAC=40.25,fBC=54.47,表明不同规格的HPMC对释放影响较大,低黏度HPMC前期释放较快,易造成前期突释,高黏度HPMC释放不完全,10 h 为78.2%。
2.4.2 HPMC用量对释放度的影响 取 HPMC K15M,使其用量分别占总质量的30%、40%和50%,乳糖为致孔剂占15%,微晶纤维素用于调节片重,分别制备缓释片,取6片测定释放度,采用相似因子法对释放曲线之间进行相似性判定,释放曲线如图3。

图3 不同用量HPMC K15M释放曲线比较(n=6)
三组释放曲线计算得相似因子值为fAB=70.57,fAC=55.08,fBC,=67.36,随着 HPMC K15M用量增加,片剂表面凝胶层增厚,药物释放逐渐减慢,但前期控释仍不理想,总体对释放度的影响并不显著。
2.4.3 CMC-Na用量对释放度的影响 联合应用羧甲基纤维素钠(CMC-Na)为骨架材料可以显著减慢药物体外前期的释放,综合考虑,为进一步控制药物前期释放,取CMC-Na,使其用量分别占总质量的5%,12%和20%,固定处方中HPMC K15M用量为40%,乳糖为致孔剂占15%,微晶纤维素用于调节片重,分别制备缓释片,取6片测定释放度,采用相似因子法对释放曲线之间进行相似性判定,释放曲线如图4。

图4 不同用量CMC-Na释放曲线比较(n=6)
三组释放曲线计算得相似因子值为fAB=58.13,fAC=47.40,fBC=66.34,表明 CMC-Na 用量对缓释片释放度影响显著,用量为5%整体释放较快,随着CMC-Na用量增大释放逐渐减慢。
2.4.4 乳糖用量对释放度的影响 固定处方HPMC K15M用量为40%,CMC-Na用量为12%,使乳糖用量分别占总质量的5%,12%和20%,微晶纤维素用于调节片重,分别制备缓释片,取6片测定释放度,释放曲线如图5。
结果表明,随着乳糖用量增加,缓释片释放度逐渐增加,三组释放曲线计算得相似因子值为fAB=67.82,fAC=58.03,fBC=76.66,f2值均在 50 以上,乳糖用量在5% ~20%内对释放度影响并不显著,其用量以12%效果最佳。
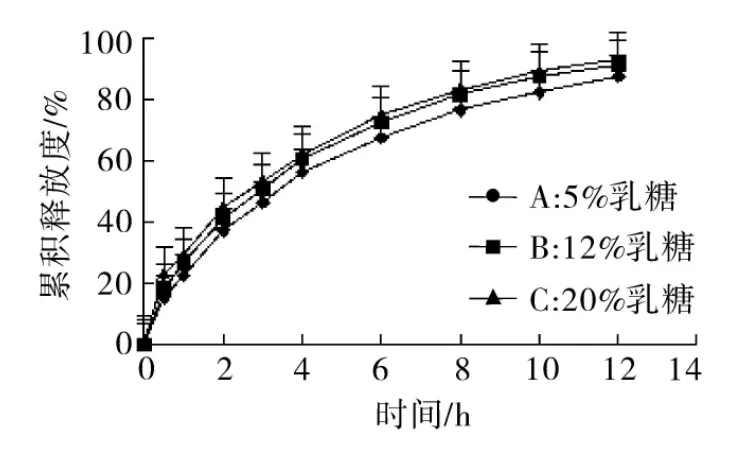
图5 不同用量乳糖释放曲线比较(n=6)
2.4.5 填充剂种类对释放度影响 固定处方其他因素用量,分别选用微晶纤维素(11%)、预胶化淀粉(11%)、微晶纤维素与预胶化淀粉混合物(质量各占总质量5.5%)为填充剂,分别制备缓释片,取6片测定释放度,释放曲线如图6。

图6 不同填充剂释放曲线比较(n=6)
三组释放曲线计算得相似因子值为fAB=86.74,fAC=87.61,fBC=85.62,三组释放曲线接近,而预胶化淀粉组辅料蓬松,可压性较差,制得的片剂压力小,前期释放稍快。故综合考虑,选用微晶纤维素作为填充剂。
2.4.6 压力对释放度的影响 选用HPMC与CMCNa为混合骨架材料,乳糖为致孔剂,微晶纤维素作为填充剂,考察压力对释放度影响,分别使压力为6 kg,8 kg和10 kg,测定释放度释放曲线如图7。
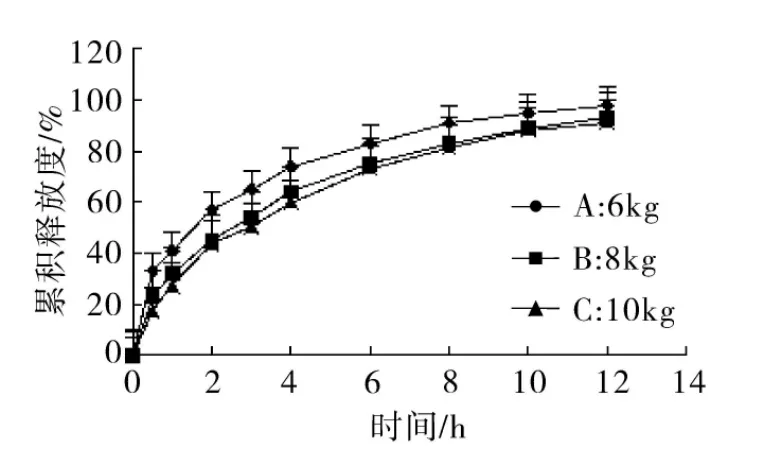
图7 不同压力释放曲线比较(n=6)
三组释放曲线计算得相似因子值为fAB=52.07,fAC=45.73,fBC,=72.85,说明压力对释放度影响显著,压力为6 kg时整体释放较快,前期0.5 h释放度为33%,随着压力增大对释放速率影响逐渐减小。
2.5 处方工艺优化 在前期单因素考察的基础上确定了进行正交试验的影响因素及水平,选择对药物释放影响较大的3个因素,即HPMC的规格、CMC-Na用量以及压力作为影响因素A、B、C,每个因素分别取3个水平,以12%乳糖为致孔剂,微晶纤维素为填充剂使片重保持恒定。根据L9(34)正交表确定处方组成,按照制备工艺制备缓释片。正交试验的因素水平见表1。
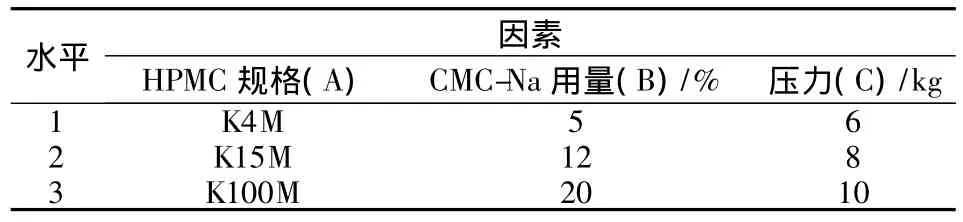
表1 因素水平表
参考中国药典2010版二部附录XIXD缓控释制剂指导原则的规定,采用综合评分法在0.5 h、3 h、6 h、10 h确定四个点释放标准:0.5 h累计释放百分率为15%;3 h累计释放百分率为50%;6 h累计释放百分率为70%;10 h累计释放百分率应该大于85%,故总分的计算公式为:Y=Q10h-[(Q0.5h-15)2+(Q3h-50)2+(Q6h-70)2]1/2,以综合评分Y值与释放度指标共同描述其体外释放情况,Y值越大,药物缓释越接近理想(表2)。

表2 正交设计试验结果

表3 方差分析
由表3极差和方差分析表中F值可得到三因素的影响程度为:A>C>B,即HPMC规格>压力>CMC-Na用量,HPMC不同规格对盐酸他喷他多缓释片释放度的影响有统计学意义。由综合评分Y值大小得知KA2>KA3>KA1,A因素优劣顺序为A2>A3>A1;KB2>KB3>KB1,B 因素优劣顺序为 B2>
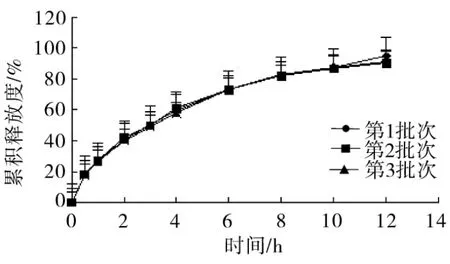
图8 优化处方制备的3批次盐酸他喷他多缓释片释放曲线(n=6)
结果表明,制备的3批次盐酸他喷他多缓释片具有明显的12 h缓释效果,以第1批次样品作为参比制剂、第2、3批样品为受试制剂而计算得到的 f2值分别为93.63和95.75,而第2批、第3批样品的释放曲线间f2值为89.18,说明样品批间差异小,重现性良好。
2.7 自制制剂与参比制剂释放参数比较 将自制的一批盐酸他喷他多缓释片与参比制剂FDA官方释放参数进行比较,自制制剂与参比制剂释放曲线基本一致(图9),自制制剂后期10 h释放度略低于参比制剂,两条释放曲线计算得到的f2值为83.47,
说明自制制剂释放曲线接近参比制剂。B3>B1;KC3>KC2>KC1,C因素优劣顺序为 C3>C2>C1,因此,各因素最佳组合为A2B2C3,盐酸他喷他多缓释片最佳处方工艺为以HPMCK15M与CMCNa为混合骨架材料,用量分别为40%和12%,以微晶纤维素为填充剂,乳糖为致孔剂,用量为12%,采用湿法制粒,控制压力在10 kg左右。
2.6 缓释片制备工艺重现性 按正交实验所得的最佳处方制备3批次盐酸他喷他多骨架缓释片,释放曲线见图8。
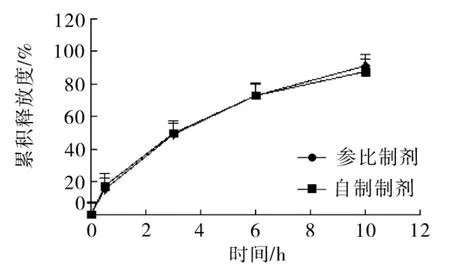
图9 自制制剂与参比制剂释放曲线比较(n=6)
2.8 盐酸他喷他多骨架缓释片释药模型拟合 采用零级释药方程、一级释药方程、Higuchi、Ritger-Peppas释药方程[6]对自制的盐酸他喷他多缓释片累积释放率进行数学拟合,根据拟合方程各时间点的累积释放率与实测值进行比较,计算相关系数r,相关系数r越接近1越佳,拟合结果见表4。

表4 盐酸他喷他多缓释片释药模型拟合结果
综合分析表4中几种模型拟合的r值,除了零级释放模型拟合度相对较差(r=0.945 1)外,其余几种模型均能较好地拟合盐酸他喷他多的体外释药行为,其中又以一级模型为最佳释药模型(r=0.999 1),表明药物的释放符合一级动力学过程。Ritger-Peppas模型拟合得到的释药指数n可以进一步显示药物的释放机制,当0.45<n<0.89时,药物释放机制为非Fick扩散(即药物扩散和骨架溶蚀协同作用),当 n<0.45时,为 Fick扩散;当 n>0.89时,为骨架溶蚀机制[7]。本实验得到的 n=0.5360,介于0.45与0.89之间,表明药物以扩散和溶蚀相结合的方式释放。
3 讨论
HPMC是制备亲水凝胶骨架型缓释片最为常用的骨架材料,对于水溶性药物,其释药机制为扩散和凝胶骨架溶蚀综合作用。研究表明[8],增加HPMC的黏度可有效减慢药物释放,但具有一定的限度,且存在前期突释现象,联合应用CMC-Na可产生较好的协同作用,减慢药物扩散,有效地抑制前期突释。乳糖为水溶性填充剂,具有致孔作用,可加大凝胶的孔隙率,从而减小药物的扩散阻力并增大扩散途径,可促进药物的后期释放[9]。本研究单独使用HPMC时药物前期突释明显,且后期释放不完全,故本研究采用HPMC K15M和CMC-Na作为混合骨架材料,有效地控制了药物释放初期的突释现象,乳糖作为致孔剂促进了药物后期释放,达到了理想释放行为。
HPMC骨架片的释药速率随着HPMC用量增加而逐渐减小,HPMC用量增加,片剂水化速率加快,快速于片剂表面形成凝胶层,且凝胶层增厚、凝胶强度增大对药物释放也具有一定影响[10]。但HPMC用量增至一定程度时,骨架片释药速率会出现一个突变,即药物的释放速率曲线会存在一个拐点,进一步增大 HPMC用量药物的释放速率趋缓[11]。本研究HPMC用量对药物释放影响并不显著,这是因为单因素考察中30%的HPMC用量即可使片剂表明形成连续的凝胶层,达到均一的水合作用,实现药物的缓释,本研究40%HPMC用量可达到理想释放。
压力对药物释放也具有一定的影响,随着压力增加,骨架的松密度增大,孔隙度减小,HPMC分子受束缚而无法伸展形成凝胶层,导致释放减慢[12]。压力增至一定程度,这种影响会变得有限,本研究压力为6 kg药物释放较快,增至10 kg左右可达到理想释放。本研究通过优化HPMC规格,CMC-Na用量,压力3个因素使盐酸他喷他多缓释片体外药物释放达到了缓释设计要求,自制的3批次盐酸他喷他多缓释片批间差异小,重现性良好,制备工艺可行。从体外释放曲线来看,自制缓释片的缓释效果与参比制剂接近。
[1] Etropolski M,Kuperwasser B,Flügel M,et al.Safety and Tolerability of Tapentadol Extended Release in Moderate to Severe Chronic Osteoarthritis or Low Back Pain Management:Pooled Analysis of Randomized Controlled Trials[J].Adv Ther,2014,31(6):604 -620.
[2] Singh DR,Nag K,Shetti AN,et al.Tapentadol hydrochloride:A novel analgesic[J].Saudi J Anaesth,2013,7(3):322 -326.
[3] 傅志俭.重视慢性疼痛的药物治疗[J].中国疼痛医学杂志,2012,18(2):65.
[4] 夏崇才,孔祥森.萘哌地尔亲水凝胶型缓释片的研制[J].安徽医药,2013,17(11):1859 -1860.
[5] 汪 洁,涂家生.硝苯地平—海藻酸钠骨架缓释片的制备及处方工艺优化[J].药学进展,2014,38(11):841 -847.
[6] 梁泽华,尹丽娜,张雅雯,等.积雪草总苷缓释片体外释药模型考察[J].成都中医药大学学报,2014,37(2):13 -14.
[7] 王笑琴,戴 艳,唐建华,等.盐酸多西环素缓释片的研制及释放度考察[J].中国药业,2013,22(18):67 -68.
[8] 刘晓娟,孙玉琦,张亚秋,等.盐酸曲美他嗪缓释片的研制及其体外释药特性考察素[J].中国新药杂志,2012,21(5):567-570.
[9] 徐 璐,刘洪卓,王齐放,等.盐酸阿比朵尔凝胶缓释片的制备及体外释放度考察[J].中国药剂学杂志,2008,6(3):85-89.
[10]潘长琦,张春雨,汪 磊.己酮可可碱缓释片的制备及体外释放度考察[J].沈阳药科大学学报,2014,31(5):331 -337.
[11]杨亚鹏,汪梦圆,常俊标,等.羟丙基甲基纤维素对单层及双层缓释骨架制剂体外释放的影响[J].北京大学学报(医学版),2013,45(2):291 -296.
[12]桂 彬,林巧平,许向阳,等.影响亲水凝胶骨架系统中药物释放的因素[J].药学进展,2012,36(5):216 -223.

