超强马立克病病毒株的致病性研究
龚振华,张 康,,王丽萍,郭光礼,李金平,于建敏,李 蕾,侯广宇,王建琳,单 虎
(1.中国动物卫生与流行病学中心,青岛 266032;2.青岛农业大学动物科技学院,青岛 266109;3.青岛易邦生物工程有限公司,青岛 266032;4.山东临朐县畜牧局,临朐 262600)
超强马立克病病毒株的致病性研究
龚振华1,张 康1,2,王丽萍3,郭光礼4,李金平1,于建敏1,李 蕾1,侯广宇1,王建琳2*,单 虎2
(1.中国动物卫生与流行病学中心,青岛 266032;2.青岛农业大学动物科技学院,青岛 266109;3.青岛易邦生物工程有限公司,青岛 266032;4.山东临朐县畜牧局,临朐 262600)
拟对一株超强马立克病病毒(MDV)SD2012-1株的致病性进行研究。将60只SPF鸡平均分成未免组、HVT免疫组和CVI988疫苗免疫组3组。于1日龄时对其进行马立克病(MD)疫苗免疫,于10日龄时进行SD2012-1攻毒;每天观察攻毒鸡临床症状,对病死鸡进行病理剖检和组织学观察;用PCR反应对感染鸡进行MDV跟踪监测。病理学研究结果显示:攻毒后第2周,试验鸡有轻微组织病变;攻毒后第6周,试验鸡有眼观病变,镜检有散在的肿瘤细胞团块;攻毒后第9周,试验鸡有明显的眼观肿瘤病变,镜检有大量肿瘤细胞聚集;SD2012-1可以突破CVI988疫苗免疫,引起高达30%的鸡发病。PCR跟踪监测结果显示:攻毒后第5天,未免组和HVT免疫组可检出MDV;攻毒后第10天,未免组和HVT免疫组阳性检出率均为100%,CVI988免疫组阳性检出率为30%;攻毒后第20天,3组试验鸡阳性检出率均为100%;用PCR检测病死鸡的肝、肾、肌胃、肠系膜、十二指肠、心和法氏囊样品的结果均为MDV阳性;攻毒300 d后,健康存活鸡的羽髓PCR检测结果均为MDV阳性。结果表明,HVT疫苗对于SD2012-1株几乎无保护作用,超强马立克病病毒SD2012-1株能够长期在免疫鸡体内存在,突破免疫保护,引起发病,这对国内防控鸡马立克病提出了严峻挑战。
超强马立克病病毒株;免疫;攻毒;肿瘤
马立克病(Marek’s disease,MD)由疱疹病毒科B亚群的马立克病病毒(Marek’s disease virus,MDV)引起,感染MDV的鸡呈现淋巴组织细胞恶性增生,其内脏器官、外周神经、肌肉、性腺、虹膜以及皮肤中出现淋巴样瘤细胞浸润,形成眼观肿瘤病变[1]。从20世纪70年代起,全球相继采用Ⅲ型、Ⅱ型和I型单价或多价MD疫苗控制这一疾病[2]。近年来,MD疫苗免疫效果明显降低,在一些已用CVI988 /Rispens株疫苗免疫的鸡群,出现免疫失败,给目前的养鸡业带来巨大的损失[3-5]。随着MDV毒株的不断变异,其毒力在进一步增强,超强MDV毒株(vvMDV和vv+MDV)因突破CVI988疫苗免疫,有可能导致该疫苗免疫保护效果完全丧失,这将严重影响养鸡业的可持续发展[6-8]。有关超强MDV毒株突破免疫保护,导致一些鸡场频发 CVI988 疫苗免疫失败的原因有待进一步研究[9]。作者对所分离保存的一株超强MDV毒株SD2012-1株[10]的致病性进行了研究。
1 材料与方法
1.1 SPF 鸡、MDV 毒株和疫苗
SPF鸡:从济南斯帕法斯家禽有限公司购买SPF鸡胚孵化,置负压隔离器内饲养。病毒株:MDV 超强病毒SD2012-1株[10],由本实验室分离保存。MD疫苗:HVT疫苗,乾元浩生物股份有限公司南京生物药厂,批号:兽药生字(2010)100082001;CVI988疫苗,批号:JC241。
1.2 主要试剂
DNA小量提取试剂盒、6×Loading Buffer、核酸染料等购自北京夏斯康泰生物技术有限公司(VWI);DNA Marker(DL2000)、2×ESTaqMaster Mix购自北京康为生物科技有限公司;病理组织切片HE染色和其他化学试剂均为国产分析纯试剂。
1.3 免疫与攻毒试验
60只SPF鸡被随机分成3组,分别置于隔离器中饲养,每组各20只鸡。3组鸡均于1日龄时进行MD疫苗免疫注射,于10日龄时进行MDV超强毒攻毒。第一组未注射疫苗,每只鸡皮下注射0.5 mL生理盐水作为未免疫对照;第二组每只鸡以2 000 PFU的剂量颈部皮下免疫 HVT 疫苗;第三组每只鸡以3 000 PFU的剂量颈部皮下免疫CVI988疫苗。攻毒所用MDV毒株为SD2012-1,每只鸡皮下注射SD2012-1的DEF培养物0.5 mL (稀释到4 000 PFU·mL-1)。攻毒后每天观察鸡的精神状态,记录发病和死亡情况。
1.4 剖检与组织病理学观察
剖检病死鸡,观察心、十二指肠、肝、肾、脾、法氏囊、腺胃、肌胃等组织有无肿瘤病变;采集病变心、肝、脾、肾等组织,用10%福尔马林(3.7%~4%中性甲醛)溶液固定,进行石蜡包埋、切片、HE染色,光镜下观察各组织器官的病理组织学变化。
1.5 感染鸡的MDV跟踪监测
用PCR试验扩增Meq基因以跟踪监测采集样品中的MDV。PCR引物序列[11],F:5′-GGCACGGTACAGGTGTAAAGAG-3′,R:5′-GCATAGAC-GATGTGCTGCTGAG-3′。50 μL的PCR反应体系:25 μL 2×EsTaqMasterMix,2.0 μL上游引物,2.0 μL下游引物,2.0 μL模板,19 μL ddH2O。反应条件:94 ℃预变性4 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1.5 min,共35个循环;72 ℃延伸10 min。反应产物于4 ℃保存。本PCR试验设置CVI988细胞毒和SD2012-1细胞毒作为阳性对照,其中CVI988扩增大小为1 081 bp,SD2012-1扩增大小为1 255 bp[12 ]。
1.5.1 带毒活鸡的MDV检测 采集攻毒后5、10、20 d以及后期健康存活鸡只的羽髓,用基因组 DNA 提取试剂盒提取病料的DNA,进行PCR反应,检测MDV。
1.5.2 病死鸡的MDV检测 采集病死鸡的肝、脾、肾等内脏器官样品,用基因组 DNA 提取试剂盒提取病料的DNA,进行PCR反应,检测MDV。
2 结 果
2.1 感染鸡的临床表现
SD2012-1攻毒后第6周,3组试验鸡中均有发病,病鸡厌食、消瘦、羽毛蓬乱,未免组和HVT免疫组试验鸡见个别死亡。3组试验鸡死亡的高峰期集中出现在攻毒后的第9周。未免疫组发病率为85%,死亡率为55%;HVT免疫组发病率为85%,病死率为50%;CVI988组发病率为30%,病死率为10%(表1)。
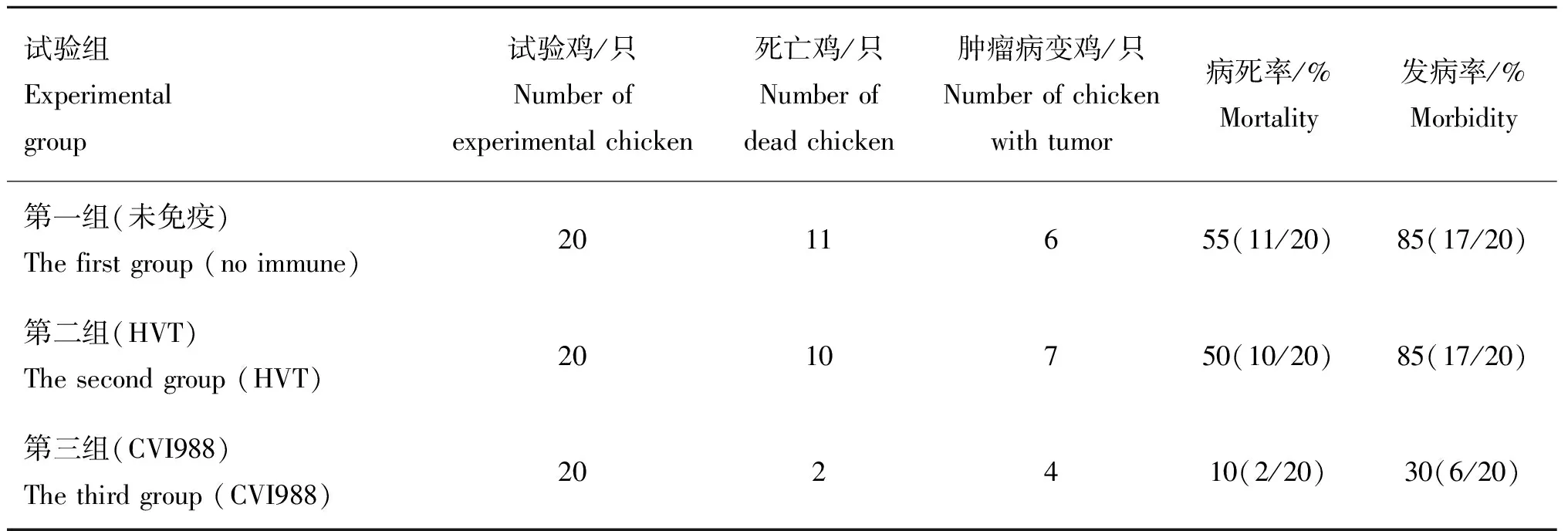
表1 SD2012-1病毒株感染SPF鸡的发病率和死亡率
2.2 病理变化
2.2.1 病死鸡的剖检变化 攻毒后第6周,死亡鸡剖检无明显的眼观肿瘤病变,仅见肝、肾、脾和法氏囊肿胀,肝脂肪变性,腺胃黏液分泌增多、黏膜出血(图1)。攻毒后第9周,死亡鸡剖检有明显的眼观肿瘤病变,肝、肾、脾肿大,肝、肾、脾和肠系膜有明显肿瘤结节,肌胃角质膜增厚、溃烂、易剥离(图2)。

a.肝边缘黄色弥漫性变性;b.肝表面凹凸不平;c.法氏囊肿大;d.肌胃肿大;e.腺胃肿大;f.脾肿大并有大量白色散在结节;g.肾肿大苍白a.Yellow degeneration diffusely in liver edge;b.Rough and uneven in liver surface;c.Bursa of Fabricius swelling;d.Muscular stomach swelling;e.Glandular stomach swelling;f.Lots of white diffused nodule in the swelled spleen;g.Kidney swelling and pale in color图1 攻毒后第6周死亡鸡的病理变化Fig.1 Lesions on dead chickens 6 weeks post infection with SD2012-1

a.肠系膜变厚且有散在结节;b.十二指肠黏膜溃疡;c.肝散在白色结节;d.肌胃肿大且角质层变厚,易剥离;e.心白色结节a.Diffused nodule in the thicken mesentery;b.Ulcer in duodenal mucosa;c.White nodule in the live;d.Muscular stomach swelling with thicken corneum layer,and easy to be peeled;e.White nodule in the heart图2 攻毒后第9周死亡鸡的病理变化Fig.2 Lesions on dead chickens 9 weeks post infection with SD2012-1
2.2.2 病理组织学观察 显微镜下观察,攻毒后第2周,攻毒鸡心轻度淤血,肝细胞轻度肿胀,脾轻度出血,肾小管上皮细胞肿胀(图3)。
攻毒后第6周,攻毒鸡主要表现为心轻度出血,肝有散在肿瘤细胞,脾淤血,肾轻度出血,有散在的肿瘤细胞灶(图4)。
攻毒后第9周,攻毒鸡主要表现为心有肿瘤细胞聚集,肝中央静脉和小叶间静脉淤血,周围有肿瘤细胞浸润增生,脾有肿瘤细胞,实质细胞坏死,肾有大量肿瘤细胞聚集(图5)。

A.攻毒SPF鸡心出血(100×);B.攻毒SPF鸡肝细胞轻度肿胀(400×);C.攻毒SPF鸡脾轻度出血(100×);D.攻毒SPF鸡肾小管上皮细胞肿胀 (400×)A.Haemorrhage in the heart of the SPF chicken infected with virus (100×);B.Swelling of the liver cells of the SPF chicken infected with virus (400×);C.Mild haemorrhage in the spleen of the SPF chicken infected with virus (100×);D.Renal tubular epithelial cell swelling of the SPF chicken infected with virus (400×)图3 攻毒后第2周死亡鸡组织病理变化(HE染色)Fig.3 Histopathologic lesions on dead chickens 2 weeks post infection with SD2012-1 (HE)

A.攻毒SPF鸡心淤血、出血(100×);B.攻毒SPF鸡肝有局灶性的肿瘤细胞(400×);C.攻毒SPF鸡脾明显出血(100×);D.攻毒SPF鸡肾可见散在的肿瘤灶(40×)A.Congestion and haemorrhage in the heart of the SPF chicken infected with virus (100×);B.Tumor cells focally distributed the liver of the SPF chicken infected with virus (400×);C.Haemorrhage in the spleen of the SPF chicken infected with virus (100×);D.Scattered tumor cells in the kidney of the SPF chicken infected with virus (40×)图4 攻毒后第6周死亡鸡组织病理变化(HE染色)Fig.4 Histopathologic lesions on dead chickens 6 weeks post infection with SD2012-1(HE)

A.攻毒SPF鸡心肿瘤细胞灶(100×);B.攻毒SPF鸡肝淤血、血管周围有大量肿瘤细胞堆积(100×);C.攻毒SPF鸡脾有散在的肿瘤细胞,实质细胞坏死(400×);D.攻毒SPF鸡肾大量肿瘤细胞聚集(100×)A.tumor cells accumulated in the heart of the SPF chicken infected with virus (100×);B.lots of tumor cells around the vessel and congestion in the liver of the SPF chicken infected with virus (100×);C.some cells necrose and some tumor cells scattered in the spleen of the SPF chicken infected with virus (400×);D.lots of tumor cells accumulated in the kidney of the SPF chicken infected with virus (100×)图5 攻毒后第9周死亡鸡组织病理变化(HE染色)Fig.5 Histopathologic lesions on dead chickens 9 weeks post infection with SD2012-1(HE)
2.3 病毒的PCR跟踪监测
2.3.1 病毒的PCR检出率 试验鸡用MDV超强毒株SD2012-1攻毒后,用PCR方法检测羽髓MDV,样品MDV阳性检出率的统计结果见表2,PCR电泳结果见图6和图7。SD2012-1攻毒后第5天,未免组MDV阳性检出率为25%,HVT免疫组MDV阳性检出率为20%,CVI988免疫组MDV全部阴性;SD2012-1攻毒后第10天,未免组和HVT免疫组MDV阳性检出率为100%和95%,CVI988免疫组MDV阳性检出率为30%;SD2012-1攻毒后第20天,未免疫组、HVT免疫组和CVI988免疫组阳性检出率均为100%;3组试验鸡的MDV阳性检出率的递增结果见图8。

表2 感染SD2012-1的病毒PCR检测结果

M.DL2000 DNA相对分子质量标准;1.CVI988病毒阳性对照;2.SD2012-1病毒阳性对照;3.阴性对照;4~13.SD2012-1攻毒后第5天鸡羽髓样品M.DL2000 DNA marker;1.CVI988 positive control;2.SD2012-1 positive control;3.Negative control;4-13.Feather pulp samples from chickens of day 5 post infection with SD2012-1图6 SD2012-1攻毒后第5天部分鸡羽髓样品MDV的PCR检测结果Fig.6 PCR amplification for chicken feather samples of day 5 post infection with SD2012-1

M.DL2000 DNA相对分子质量标准;1.CVI988病毒阳性对照;2.SD2012-1病毒阳性对照;3.阴性对照;4~13.SD2012-1攻毒后第20天鸡羽髓样品M.DL2000 DNA marker;1.CVI988 positive control;2.SD2012-1 positive control;3.Negative control;4-13.Feather pulp samples from chickens of day 20 post infection with SD2012-1图7 SD2012-1攻毒后第20天部分鸡羽髓样品MDV的PCR检测结果Fig.7 PCR amplification for chicken feather samples of day 20 post infection with SD2012-1

图8 攻毒SD2012-1试验鸡的PCR阳性检出率递增示意Fig.8 Curve of positive rate of MDV by PCR
2.3.2 存活鸡的带毒试验结果 从CVI988免疫组选取5只健康活鸡,从攻毒后30 d起,每隔30 d定期拔取羽髓。用PCR方法定期对存活鸡羽髓进行PCR检测(图9),统计MD病原检出率。如表3所示,310日龄试验鸡(感染SD2012-1病毒300 d)羽髓的PCR检测结果均为100% MDV阳性。

表3 存活鸡的带毒试验结果

M.DL2000 DNA相对分子质量标准;1.CVI988病毒阳性对照;2.SD2012-1病毒阳性对照;3.阴性对照;4~13.部分存活鸡羽髓样品M.DL2000 DNA marker;1.CVI988 positive control;2.SD2012-1 positive control;3.Negative control;4-13.Feather pulp samples from living chickens图9 部分存活带毒鸡的羽髓PCR检测结果Fig.9 PCR amplification for feathers from living chickens infected with SD2012-1
2.3.3 病毒在感染鸡体内的分布 用PCR方法检测病死鸡的肝、肾、肌胃、肠系膜、十二指肠、心和法氏囊样品,这些被检测样品均在1 081 bp的位置扩增出了特异性的目的条带(图10),表明这些被检测的脏器中均存在SD2012-1株马立克病病毒感染。

M.DL2000 DNA相对分子质量标准;1.CVI988病毒阳性对照;2.SD2012-1病毒阳性对照;3.肝;4.肾;5.肌胃;6.肠系膜;7.十二指肠;8.心;9.法氏囊M.DL2000 DNA marker;1.CVI988 positive control;2.SD2012-1 positive control;3.Liver;4.Kidney;5.Muscular stomach;6.Mesentery;7.Duodenum;8.Heart;9.Bursa of Fabricius图10 发病鸡各脏器的病毒PCR检测结果Fig.10 PCR amplification for organs from chickens infected with SD2012-1
3 讨 论
20世纪90年代初,欧美地区发现超强马立克病病毒株,这些地区在使用Ⅱ+Ⅲ型双价疫苗和CVI988/Rispens1型疫苗后,并不能对超强毒株感染有很好的保护。这被视为MDV毒力趋于更强的一个信号[13-14]。本研究中,用MDV超强病毒株SD2012-1株分别感染未注射疫苗、HVT 疫苗免疫和CVI988疫苗免疫的3组试验鸡,其中HVT免疫鸡与未免疫鸡的发病率均高达85%,这说明HVT疫苗对于MD病毒SD2012-1株几乎无保护作用;此外,SD2012-1可以突破CVI988疫苗免疫,引起高达30%的鸡发生马立克病。免疫攻毒试验结果表明,超强马立克病病毒株对国内防控鸡马立克病提出了严峻的挑战。
超强马立克病病毒株引起的临床症状多为内脏型,病程较急,主要由于病毒对于机体的感染性较强决定。本研究中,病死鸡的心、肝、脾、肺和肾均出现肿瘤病变,并通过PCR方法可以检测到这些组织器官的病原。这说明超强马立克病病毒株SD2012-1对于鸡具有较强的感染性。超强MDV毒株一般最快在病毒感染后第10天左右可引起MD的临床症状[13],但有意思的是,本研究中,由SD2012-1引起的症状发病较慢,早期MD症状并不典型,最早于攻毒后第6周出现MD临床症状,攻毒后第8—9周,才观察到鸡大量发病,出现肿瘤病变。
MDV进入机体后,主要是被吞噬细胞吞噬或共价吸附进入敏感的淋巴细胞,合成病毒粒子。这些新合成的病毒粒子通过细胞间桥接触感染其他细胞,再以上述方式进入新感染的细胞内进行增殖,导致少数T细胞也发生细胞溶解,并发生渐进性坏死,激发炎性反应,还伴有巨噬细胞、粒性白细胞、T细胞、B细胞等多种细胞浸润[14]。在这一感染过程中,病毒的复制能力和致瘤性,是其是否致病的关键因素。超强马立克病病毒株可以引起严重的免疫器官衰竭和明显的免疫抑制,通过反复发生溶细胞性感染,淋巴器官受损,并产生转化感染,诱发肿瘤形成[15-16]。本研究中,攻毒SD2012-1的免疫鸡的心、肝、脾、肺和肾中均检测出马立克病病毒超强毒株,说明病毒在这些内脏器官中可以复制。内脏的病理组织学观察发现,在病毒感染中后期,心、肝、脾、肾等组织器官出现了明显的肿瘤细胞灶状增生。中期(攻毒后第6—8周)在低倍镜下观察见淋巴样瘤细胞浸润,后期(攻毒后第8周起)脾出现大量淋巴细胞坏死现象。这一试验结果说明MD肿瘤的形成与病毒在淋巴细胞中的复制所引起的病变具有一定的相关性。
CVI988病毒的meq基因较超强MDV毒株的meq基因多177 bp[17-18]。本研究中所采用的PCR试验基于扩增产物的DNA长度不同,可以区分CVI988疫苗病毒和超强MDV毒株[12]。本研究中,CVI988免疫组鸡于1日龄接种CVI988疫苗,于10日龄攻毒SD2012-1,之后采集存活鸡的羽髓和病死鸡的内脏器官,利用PCR试验检测样品中的MDV。从该组鸡PCR试验的检测结果来看,感染SD2012-1第10天,30%鸡羽髓样品为超强毒阳性,病死鸡内脏及感染SD2012-1第20天后羽髓SD2012-1的PCR阳性率是100%;PCR试验并没有从该组鸡检测出CVI988病毒。这说明试验鸡体内尽管之前注射过CVI988疫苗,但之后该疫苗病毒已经在鸡体内不复存在,或者是病毒含量低至该PCR灵敏度以下。参考以往关于鸡马立克病的流行病学调查研究,也可以发现,在免疫过CVI988的鸡群中,并不能用PCR检测出CVI988病毒[19-20]。为什么注射CVI988活疫苗的鸡群中检测不到疫苗毒株,而攻毒超强病毒SD2012-1的鸡群可以检测出该MDV超强病毒,且持续300 d后MDV超强病毒检测仍然阳性?可能是因为与CVI988相比,超强马立克病病毒株具有突破鸡体免疫的能力,能够长期在淋巴细胞中复制,并长期存活下来,而常规的MDV毒株(主要是疫苗株)不具备在鸡体内进一步大量复制的能力。
[1] 蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001:313. CAI B X.Livestock infectious diseases[M].Beijing:China Agriculture Press,2001:313.(in Chinese)
[2] 周 蛟,周 煜,林 健,等.我国鸡马立克氏病的流行现状及防制对策[C]//中国畜牧兽医学会.中国畜牧兽医学会2003年学术年会论文集.中国畜牧兽医学会,2003:4. ZHOU J,ZHOU Y,LIN J,et al.Marek’s disease epidemic situation in China and countermeasures of prevention and control[C]//China institute of animal husbandry and veterinary medicine.China institute of animal husbandry and veterinary medicine symposium in 2003.China Institute of Animal Husbandry and Veterinary Medicine,2003:4.(in Chinese)
[3] 许大明,汉丽梅,刘 丹,等.马立克氏病疫苗研究进展[J].上海畜牧兽医通讯,2007(3):13-14. XU D M,HAN L M,LIU D,et al.Research progress of Marek’s disease vaccine[J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,2007(3):13-14.(in Chinese)
[4] 韦 平.马立克氏病研究的最新动态—第八届国际马立克氏病研讨会概况[J].中国家禽,2008,30(17):6-14. WEI P.The latest developments in the study of Marek’s disease-The eighth session of the international symposium of Marek’s disease[J].ChinaPoultry, 2008,30(17):6-14.(in Chinese)
[5] 李汉秋,周 煜,林 健,等.鸡马立克氏病CV1988/Rispens冷冻活疫苗和HVT冻干苗效力比较试验[J].中国预防兽医学报,2002,24(1):41-43. LI H Q,ZHOU Y,LIN J,et al.Efficiency comparative experiment of chicken Marek′s disase between Cryophilic Vaccine(CV1988/Rispens)and Lyophilized Vaccine(HVT)[J].ChineseJournalofPreventiveVeterinaryMedicine,2002,24(1):41-43.(in Chinese)
[6] 崔 宁,苏 帅,陈孜孟,等.中国3种不同地方品系鸡对马立克病毒超强毒株rMd5易感性比较[J].畜牧兽医学报,2014,45(1):101-106. CUI N,SU S,CHEN Z M,et al.Comparison of the susceptibility of three different local chicken lines in China to very virulent strain rMd5[J].ActaVeterinariaetZootechnicaSinica,2014,45(1):101-106.(in Chinese)
[7] VENUGOPAL K.Marek’s disease:an update on oncogenic mechanisms and control[J].ResVetSci,2000,69(1):17-23.
[8] JAROSINSKI K W,TISCHER B K,TRAPP S,et al.Marek’s disease virus:lytic replication,oncogenesis and control[J].ExpertRevVaccines,2006,5(6):761-772.
[9] 滕丽琼,韦 平,宋中宝,等.一株整合有禽反转录病毒长末端重复序列的马立克氏病病毒野毒株的致病性研究[J].病毒学报,2009,25(5):376-381. TENG L Q,WEI P,SONG Z B,et al.Evaluation of the pathogenicity of a field isolate of Marek’s disease virus integrated with retroviral long terminal repeat sequence[J].ChineseJournalofVirology,2009,25(5):376-381.(in Chinese)
[10] GONG Z,ZHANG L,WANG J,et al.Isolation and analysis of a very virulent Marek’s disease virus strain in China[J].VirolJ,2013,10:155.
[11] 张丽娟,龚振华,管远红,等.一种用于马立克氏病病原检测的PCR技术研究[J].江西农业大学学报,2014,36(1):216-220. ZHANG L J,GONG Z H,GUAN Y H,et al.Studies of PCR detection technology on Marek’s disease pathogen[J].ActaAgriculturaeUniversitatisJiangxiensis,2014,36(1):216-220.(in Chinese)
[12] 张 康,龚振华,林祥超,等.对一株超强马立克氏病毒株的检测和研究[J].中国动物检疫,2015,32(4):14-17,31. ZHANG K,GONG Z H,LIN X C,et al.Detection and analysis of a very virulent Marek’s disease virus strain[J].ChinaAnimalHealthInspection,2015,32(4):14-17,31.(in Chinese)
[13] WITTER R L,LEE L F,FADLY A M.Characteristics of CVI988/Rispens and R2/23,two prototype vaccine strains of serotype 1 Marek’s disease virus[J].AvianDis,1995,39(2):269-284.
[14] DAVISON F,NAIR V.Use of Marek’s disease vaccines:could they be driving the virus to increasing virulence?[J].ExpertRevVaccines,2005,4(1):77-88.
[15] 贺君君.马立克氏病病毒在不同抗性鸡体内的复制动力学研究[D].南宁:广西大学,2011. HE J J.Marek’s disease virus replication kinetics in different resistant chickens[D].Nanning:Guangxi University,2011.(in Chinese)
[16] 贺君君,滕丽琼,韦 平,等.马立克氏病病毒体内复制动力学研究进展[J].中国家禽,2011,33(5):47-51. HE J J,TENG L Q,WEI P,et al.Research progress of Marek’s disease virus replication kinetics[J].ChinaPoultry,2011,33(5):47-51.(in Chinese)
[17] CHANG K S,OHASHI K,ONUMA M.Diversity (polymorphism) of themeqgene in the attenuated Marek’s disease virus (MDV) serotype 1 and MDV-transformed cell lines[J].JVetMedSci,2002,64(12):1097-1101.
[18] LEE L F,WU P,SUI D,et al.The complete unique long sequence and the overall genomic organization of the GA strain of Marek’s disease virus[J].ProcNatlAcadSciUSA,2000,97(11):6091-6096.
[19] 郑永胜,张艳萍,李志杰,等.鸡马立克氏病病毒疫苗株对强毒株的复制抑制作用[J].中国预防兽医学报,2014,36(1):7-10. ZHENG Y S,ZHANG Y P,LI Z J,et al.Inhibition of Marek’s disease vaccine virus on replication of the virulent virus strain[J].ChineseJournalofPreventiveVeterinaryMedicine,2014,36(1):7-10.(in Chinese)
[20] 陈瑞爱.常用马立克氏病疫苗的评价及免疫失败原因分析[D].广州:华南农业大学,2004. CHEN R A.Analysis of the failure of Marek’s disease vaccine evaluation and immune cause[D].Guangzhou:South China Agricultural University,2004.(in Chinese)
(编辑 白永平)
Studies on Pathogenicity of a Very Virulent Marek’s Disease Virus Strain
GONG Zhen-hua1,ZHANG Kang1,2,WANG Li-ping3,GUO Guang-li4,LI Jin-ping1,YU Jian-min1,LI Lei1,HOU Guang-yu1,WANG Jian-lin2*,SHAN Hu2
(1.ChinaAnimalHealthandEpidemiologyCenter,Qingdao266032,China;2.Collegeofanimalscienceandtechnology,QingdaoAgriculturalUniversity,Qingdao266109,China;3.QingdaoYebioBioengineeringCo.,Ltd,Qingdao266032,China;4.LinquAnimalHusbandryandVeterinaryAdministration,Linqu262600,China)
In this study,the pathogenicity of a very virulent Marek’s disease virus (MDV) SD2012-1 strain was analyzed.sixty SPF chickens were randomly divided into 3 groups:non-immunized group,HVT immunized group and CVI988 immunized group.Chickens were vaccinated with different types of MD vaccine at 1-day-old,and were challenged with SD2012-1 strain at 10-day-old.The challenged chickens were housed in separate isolators,and were sampled for clinic,histopathology and PCR detection of MDV.Clinical and histopathologic lesions in the infected chickens showed:slight histopathologic lesions were developed at 2 weeks post challenge,characteristic histopathologic lesions with scattered clumps of tumor cells were developed at the 6th weeks post challenge,and grossly obvious tumor lesions with large number of tumor cell aggregates were developed at the 9th weeks post challenge;SD2012-1 could break through the protection of CVI988 vaccine,causing MD with up to 30% rate in immunized chickens.PCR tracking of MDV in the infected chickens showed:MDV could be detected in non-immunized group and HVT group at 5 days post challenge;the positive rates of MDV were 100% in non-immunized and HVT group,30% in CVI988 group,at 10 days post challenge;the positive rates in the three groups were all 100% at 20 days post challenge;samples,including liver,kidney,muscular stomach,mesentery,duodenum,heart and bursa of Fabricius collected from clinical chickens,were all MDV positive by PCR,feather pulp samples collected from the infected living chickens were all MDV positive by PCR.When infected with MDV SD2012-1,chickens immunized with HVT hardly had protective effect on this virus,and the long-term existence of SD2012-1 in chickens immunized with CVI988 vaccine could break through its immune protection,which proposed a severe challenge for Marek’s disease prevention and control.
very virulent Marek’s disease virus;immune;challenge;tumor
10.11843/j.issn.0366-6964.2015.07.016
2015-04-03
山东省自然科学基金(ZR2013CL022);青岛市科技计划基础研究项目(11-2-4-5-<11>-jch)
龚振华(1968-),男,湖南岳阳人,副研究员,主要从事动物疫病诊断技术研究,E-mail:gzh1832@126.com,Tel:0532-85652282
*通信作者:王建琳(1976-),女,山西沁源人,副教授,博士,主要从事禽病发生机制的研究,E-mail:bjsxxw@126.com
S852.659.1
A
0366-6964(2015)07-1191-10

