葡萄糖异构酶基因的筛选、表达及酶学性质研究
廖承军,郑微,黄建峰,刘成龙,柳志强,程新平,毛宝军,陈德水
(1.浙江华康药业有限公司,浙江 衢州 324302;2.浙江工业大学生物工程研究所,浙江 杭州 310014)
葡萄糖异构酶基因的筛选、表达及酶学性质研究
廖承军1,郑微2,黄建峰2,刘成龙2,柳志强2,程新平1,毛宝军1,陈德水1
(1.浙江华康药业有限公司,浙江 衢州 324302;2.浙江工业大学生物工程研究所,浙江 杭州 310014)
通过基因挖掘的方法从NCBI数据库中筛选得到一株嗜热的葡萄糖异构酶(GI)产生菌株Thermotoga petrophila RKU-1,化学合成该酶的基因并在大肠杆菌E.coli BL21(DE3)中进行可溶性表达。重组葡萄糖异构酶经过Ni-NTA柱亲和层析分离纯化后,对纯酶进行SDSPAGE检测,结果显示为单一条带,其分子量大小为50.8 kDa。测定了该重组酶对底物D-葡萄糖的活力为19.8 U/mg,并对其酶学性质进行了表征。该酶最适温度和pH分别为85℃和7.0,Co2+对催化活力起着非常重要的作用,对底物D-葡萄糖的Km值和Vmax值分别为373 mmol/L和13.4 U/mg。在最适条件下,反应在4 h内达到平衡,果糖得率最高达到53.8%。
基因挖掘;葡萄糖异构酶;表达;酶学性质
引言
葡萄糖异构酶(glucose isomerase,EC 5.3.1.5)又称木糖异构酶(xylose isomerase),在体内催化D-木糖生成D-木酮糖,在体外催化D-葡萄糖生成D-果糖[1]。因此,该酶被广泛用于高果糖浆(HFCS)的工业生产中[2-3]。
目前,工业化生产的HFCS均为42%HFCS,而55%HFCS因其口感和甜度等性能拥有最大的市场需求[4-5]。要得到55%HFCS,需要经历下游色谱纯化和浓缩等步骤[6]。研究报道显示,葡萄糖和果糖之间的异构化反应存在着热动力学平衡,随着反应温度的升高,转化率也逐渐升高,当温度大于等于85℃时,理论转化率可以达到55%以上[7-8]。因此,筛选构建一株高活力且耐高温的葡萄糖异构酶,已成为实现一步法生产55%HFCS的迫切需求。
目前,基因挖掘作为一种快速、高效、便捷的筛选生物酶催化剂的新型手段,已经越来越广泛地被使用并代替传统的土样筛选[9]。
本课题组通过基因挖掘的方法从NCBI数据库中筛选得到一株嗜热的葡萄糖异构酶(GI)产生菌株Thermotoga petrophila RKU-1,化学合成该酶的基因并实现其在大肠杆菌E.coli BL21(DE3)中的可溶性表达。利用亲和层析实现了重组葡萄糖异构酶TPGI的分离纯化,并从最适反应温度、最适pH、最适金属离子及酶促反应动力学等方面研究了该酶的酶学性质。
1 材料与方法
1.1 材料
1.1.1 菌株和载体
宿主大肠杆菌(E.coli BL21(DE3))为本实验室保存菌株,表达载体pET-28b(+)购自Takara公司。
1.1.2 试剂
限制性内切酶Nde I和Eco RI、T4 DNA连接酶购自Fermentas公司;Pfu DNA聚合酶、Taq DNA聚合酶、dNTP购自上海申能博彩公司;质粒DNA小量提取试剂盒、琼脂糖凝胶回收试剂盒购自Axygen公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自Promega公司;酵母粉、蛋白胨购自OXOID公司;D-葡萄糖购自阿拉丁试剂有限公司;D-果糖购自Solarbio公司。除特别注明的试剂外,其他各种实验试剂均为国产分析纯。
1.1.3 引物
根据TPGI基因序列,设计引物(含限制性酶切位点)上游引物:5'-CATGCCATGGTAAT GGAATTTTTCCCTG-3',(Nco I),下游引物:5'-CCGCTCGAGACGAAGTTCAGCGATTG-3',(Xho I),以上引物均由上海生工生物工程公司合成。
1.1.4 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH 7.0,接种之前加入50μg/mL卡那霉素;固体LB培养基添加1.5%~2.0%琼脂,用于大肠杆菌培养。卡那霉素抗生素贮存液的配制:用无菌水配制50mg/mL的抗生素母液,过滤除菌后,-20℃保存备用,使用时终浓度为50μg/mL。
1.2 方法
1.2.1 基因挖掘方法筛选葡萄糖异构酶
以最嗜热的Thermotogamaritime来源和催化活力较高的商业化的Streptomycesmurinus来源的葡萄糖异构酶(TMGI、SMGI)氨基酸序列为模板,从NCBI数据库中(http://blast.ncbi.nlm.nih. gov/Blast.cgi),通过Blast X和Blast P比对搜索,最终选择了一株与上述TMGI、SMGI同源性分别为98%、31%,且无研究报道的嗜热Thermotoga petrophila RKU-1来源的葡萄糖异构酶。
1.2.2 葡萄糖异构酶基因的密码子优化及其合成
选取的葡萄糖异构酶基因通过软件Codon Adaptation Tool,以E.coli BL21(DE3)的密码子偏好性为基准,进行密码子优化,优化后的基因由上海旭冠生物科技发展有限公司合成。
1.2.3 重组葡萄糖异构酶的构建
以合成的含有目的基因的质粒为模板,PCR扩增葡萄糖异构酶基因,扩增条件为:95℃预热变性5min,30个循环(94℃变性30 s,50℃退火30 s,72℃延伸2min),72℃延伸10min。扩增后的产物经0.9%琼脂糖凝胶电泳检测分析并回收,回收后的PCR产物纯化后与表达载体pET-28b (+)连接,连接产物转化E.coli BL21(DE3)感受态细胞,经菌落PCR验证为阳性克隆子的菌,送至上海桑尼生物技术有限公司测序验证,通过DNAMAN软件分析测序序列是否为目的序列。
1.2.4 重组葡萄糖异构酶的诱导表达及SDS
PAGE分析
制备种子液:用接种环从斜面上挑取鉴定正确的菌种,接种至50mL LB种子液培养基摇瓶(含50μg/mL Kan),37℃、150 r/min摇床培养,一般培养时间10~12 h。制备发酵液:将培养好的种子液转接至发酵培养基中,接种量为2%(V/ V),37℃、150 r/min摇床培养菌体浓度至OD600为0.6~0.8时,添加浓度为0.1 mmol/L IPTG进行诱导表达,28℃、150 r/min诱导12 h后离心收集菌体。粗酶液的制备:将离心收集到的菌体用纯水溶解后进行细胞破碎,破碎液于4℃下12 000 r/ min离心20min,取上清获得粗酶液。纯酶液的制备:将粗酶液过Ni-NTA柱分离纯化获得纯酶液。最终得到的纯酶液通过SDS-PAGE分析纯化结果并测定蛋白浓度。
1.2.5 重组葡萄糖异构酶的酶学性质研究
以D-葡萄糖为底物,利用高效液相色谱测定葡萄糖异构酶的活性。反应体系如下:在50 mmol/ L Tris-HCl缓冲液(pH 7.0)与一定量酶液的10 mL反应体系中,加入底物100 mg/mLD-葡萄糖,激活剂1mmol/LCo2+,10mmol/LMg2+。85℃、150 r/min反应10 min,冰浴3 min终止反应。
通过测定不同温度(55~100℃)下TPGI的酶活确定最适温度;通过测定不同pH缓冲液中TPGI的酶活确定最适pH,缓冲液体系分别为:HAc/NaAc(pH 4.0~6.0),PBS(pH 5.5~7.0),Tris/ HCl(pH 7.0~9.0),Gly/NaOH(8.5~10.0);通过测定80、85、90℃下保温一定时间后的残余酶活确定酶的热稳定性;分别考察添加5mmol/L不同二价金属离子(Mg2+,Mn2+,Co2+,Zn2+,Cu2+,Ba2+,Ni2+,Fe2+,Ca2+)对酶活的影响;在底物D-葡萄糖浓度为37.5~300mmol/L范围内测定酶促动力学反应常数。
测定催化进程曲线,葡萄糖浓度10%(W/V),在最适温度、pH以及最佳金属离子浓度下反应不同时间(0.5~10 h),取样测定果糖得率。
HPLC检测产物D-果糖条件如下:色谱柱为Hi-Plex Ca柱(300 mm×7.7 mm),柱温为80℃,流动相为超纯水,流动相流速为0.5 mL/min,检测器为示差检测器。在该条件下,D-葡萄糖的保留时间为15.7min,D-果糖的保留时间为20.2min。
葡萄糖异构酶酶活单位(U)定义为:在85℃、pH 7.0条件下,每分钟生成1μmol D-果糖所需的酶量定义为1 U。比酶活定义为:每毫克蛋白中所含的酶活单位,用U/mg表示。果糖得率定义为:异构化转化生成的D-果糖和初始底物D-葡萄糖的百分比。
2 结果与讨论
2.1 重组葡萄糖异构酶的表达及纯化
合成的葡萄糖异构酶基因经PCR扩增后,连接于表达载体pET-28b(+),重组质粒pET-28b(+) -TPGI转入宿主菌E.coli BL21(DE3),挑取单菌落培养并经IPTG诱导,重组葡萄糖异构酶TPGI以可溶蛋白的形式表达,将其通过Ni-NTA柱分离纯化后,SDS-PAGE检测到单一条带,达到电泳纯水平,如图1所示。该重组葡萄糖异构酶TPGI的分子量约为50.8 kDa,与预期相符。经过蛋白浓度和酶活力测定,计算得到TPGI的比酶活为19.8 U/mg。

图1 重组葡萄糖异构酶TPG I的SDS-PAGE分析M—标准蛋白Marker;1—TPGI未经过IPTG诱导;2—TPGI经过IPTG诱导;3—TPGI经过Ni-NTA柱分离纯化
2.2 葡萄糖异构酶突变体催化生产HFCS的条件优化
2.2.1 最适温度和最适pH
不同温度下的酶活力测得结果如图2所示,从图中可以看出,TPGI最适催化温度为85℃,在低于55℃时,TPGI几乎无催化活力;70℃以下,其酶活力也相对较低;温度达到100℃时,TPGI的酶活力仍较高,显示出较好的嗜热性能。不同pH下酶活力结果分析如图3所示,TPGI的最适催化pH为7.0(Tris-HCl缓冲液),其在酸性条件下,酶活损失较大。

图2 温度对重组葡萄糖异构酶活力的影响

图3 pH对重组葡萄糖异构酶活力的影响
2.2.2 热稳定性
以0小时即未保温时的酶活力定义为100%,其他保温不同时间的酶活力与其对比求取相对酶活力,不同温度下保温不同时间,求得的酶活力结果如图4所示。从图中可以看出,随着温度的升高,TPGI的热稳定性有所下降,在80℃时,其半衰期为9 h,在最适温度85℃时,1 h后其酶活力是初始的80%。

图4 重组葡萄糖异构酶的热稳定性
2.2.3 不同二价金属离子对酶活的影响
葡萄糖异构酶是金属酶,在催化异构化的过程中,需要金属离子的辅助催化,而且不同金属离子对葡萄糖异构酶的活力和稳定性起着非常重要的作用。目前所报道的大多数葡萄糖异构酶主要以Mg2+、Mn2+、Co2+或者以其中两种金属离子作为助催化剂[10]。以最高的酶活力设为100%,其他金属离子对酶活力影响与最高酶活力对比,其结果如图5所示。图中N对应的是未加任何金属离子,几乎无任何催化活力,表明TPGI在高温催化下,需要金属离子才能维持其催化活力;Co2+对TPGI的催化活力起着非常重要作用,Zn2+、Cu2+、Ni2+对酶的催化不起作用,其活力几乎为零;Mg2+、Mn2+在TPGI的催化当中起到辅助作用,Ba2+、Ni2+、Fe2+、Ca2+单独存在对酶催化起着微弱作用。
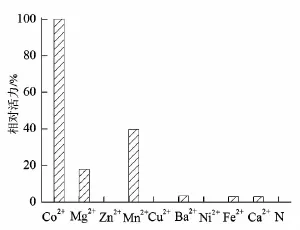
图5 金属离子对重组葡萄糖异构酶活力的影响
2.2.4 酶促动力学参数测定
测定不同底物浓度下的反应速度,根据测定结果进行双倒数曲线拟合作图(图6)。曲线拟合度R2=0.99395,拟合方程为y=27.95786x+ 74.91392。根据拟合曲线计算得到Km和Vmax分别为373mmol/L和13.4 U/mg。

图6 重组葡萄糖异构酶的动力学曲线
2.2.5重组葡萄糖异构酶催化葡萄糖反应进程
重组葡萄糖异构酶TPGI催化葡萄糖生成高果糖浆的反应进程研究表明(图7),果糖得率随着时间的增加快速上升,反应1 h,果糖得率就能达到42%,2 h得率能够达到50%,且在4 h达到最大值53.8%,之后反应达到平衡,得率趋于稳定。

图7 重组葡萄糖异构酶的催化葡萄糖的反应进程
3 结论
本文通过基因挖掘的方法从NCBI数据库中筛选得到一株嗜热的葡萄糖异构酶(GI)产生菌株Thermotoga petrophila RKU-1,化学合成该酶的基因并在宿主大肠杆菌E.coli BL21(DE3)中进行可溶性表达。重组葡萄糖异构酶TPGI经过Ni-NTA柱亲和层析分离纯化后,对纯酶进行SDSPAGE检测,结果显示为单一条带,其分子量大小为50.8 kDa。测定了该重组酶对底物D-葡萄糖的活力为19.8 U/mg,并对其酶学性质进行了表征。确定了该酶的最适温度和pH分别为85℃和7.0,与之前一些文献报道的葡萄糖异构酶相比,拥有较高的催化最适温度和不依赖碱性条件催化[11-12]。金属离子中Co2+对该酶的催化活力起着非常重要的作用,对底物D-葡萄糖的Km值和Vmax值分别为373mmol/L和13.4 U/mg。在最适条件下,反应在4 h内达到平衡,果糖得率最高达到53.8%。后续可通过计算机软件模拟和分子改造技术进一步改变该蛋白的特性,提高与底物的亲和力和催化效率,并寻找一种合适的固定化方法稳定酶的使用率,将使工业化大规模一步酶法生产55%HFCS成为可能。
[1]XU Heng,SHEN Dong,WU Xueqiang,et al.Characterization of a mutant glucose isomerase from Thermoanaerobacterium saccharolyticum[J].Journal of Industrial Microbiology&Biotechnology,2014,41(10):1581-1589.
[2]DICOSIMO R,MCAULIFFE J,POULOSE A J,et al.Industrial use of immobilized enzymes[J].Chemical Society Reviews,2013,42(15):6437-6474.
[3]JENSEN V J AND RUGH S.Industrial-scale production and app lication of immobilized glucose isomerase[J].Methods in Enzymology,1987,136:356-370.
[4]PARKER K,SALASM,NWOSU V C.High fructose corn syrup:production,uses and public health concerns[J].Biotechnology and Molecular Biology Reviews,2010,5(5):71-78.
[5]BARCLAY T,MARKOVIC M G,COOPER P,et al.The chemistry and sources of fructose and their effect on its utility andhealth implications[J].JournalofExcipientsand Food Chemicals,2012,3(2):67-82.
[6]BHOSALE SH,RAOM B,DESHPANDE V V.Molecular and industrialaspectsofglucose isomerase[J].MicrobiologicalReviews,1996,60(2):280-300.
[7]TEWARIY B,GOLDBERG R N.Thermodynamics of the conversion of aqueous glucose to fructose[J].Applied Biochemistry and Biotechnology,1985,11(1):17-24.
[8]HARTLEY B S,HANLON N,JACKSON R J,et al.Glucose isomerase:insights into protein engineering for increased thermostability[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,2000,1543(2):294-335.
[9]SUKUMAR M,JEYASEELAN A,SIVASANKARAN T,et al. Production and partial characterization of extracellular glucose isomerase using Thermophilic Bacillus sp.isolated from agricultural land[J].Biocatalysis and Agricultural Biotechnology,2013,2(1):45-49.
[10]ZHANG Fan,DUAN Xuguo,CHEN Sheng,et al.The addition of Co2+enhances the catalytic efficiency and thermostability of recombinant glucose isomerase from Thermobifida fusca[J]. Process Biochemistry,2013,48(10):1502-1508.
[11]DENG Hui,CHEN Sheng,WU Dan,et al.Heterologous expression and biochemical characterization of glucose isomerase from Thermobifida fusca[J].Bioprocessand Biosystems Engineering,2014,37(6):1211-1219.
[12]MU Wanmeng,WANG Xiaole,XUE Qinghai,et al. Characterization of a thermostable glucose isomerase with an acidic pH optimum from Acidothermus cellulolyticus[J].Food Research International,2012,47(2):364-367.
(责任编辑:朱小惠)
Genomem ining,expression and characterization of a hyperthermophilic glucose isom erase from Thermotoga petrophila RKU-1
LIAO Chengjun1,ZHENGWei2,HUANG Jianfeng2,LIU Chenglong2,LIU Zhiqiang2,CHENG Xinping1,MAO Baojun1,CHEN Deshui1
(1.Zhejiang Huakang Pharmaceutical Co.,Ltd.,Quzhou 324302,China;2.Institute of Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
A hyperthermophilic glucose isomerase from Thermotoga petrophila RKU-1(TPGI)was screened by genomemining from NCBIdatabase.The gene of TPGIwas synthesized and expressed as a soluble protein in E.coli BL21(DE3).The recombinant enzyme was purified by Ni-NTA affinity chromatography.The SDS-PAGE analysis of the purified TPGI revealed a single band with a molecular weight of around 50.8 kDa.The specific activity of the recombinant TPGI to D-glucose was 19.8 U/mg.The enzyme exhibited itsmaximum activity at 85℃,pH 7.0 and showed significant dependence on Co2+.The Kmand Vmaxto substrate D-glucosewere 373 mmol/L and 13.4 U/ mg,respectively.The yield of D-fructose reached 53.8%and the isomerization graduallymaintained equilibrium after 4 h under the optimum conditions.
genomemining;glucose isomerase;expression;enzymatic properties
Q814
A
1674-2214(2015)04-0019-05
2015-05-28
国家自然科学基金(31401527);浙江省重大科技攻关项目(2013C02027)
廖承军(1976—),男,浙江开化人,工程师,主要从事功能性糖和糖醇生产工艺技术开发和应用,E-mail:liaochengjun@huakangpharma.com.

