无溶剂体系脂肪酶Lipozyme TL IM催化拆分DL-薄荷醇
李琴,鄢洪德,郑建永,汪钊
(浙江工业大学生物与环境工程学院,浙江 杭州 3 1 0 0 1 4)
无溶剂体系脂肪酶Lipozyme TL IM催化拆分DL-薄荷醇
李琴,鄢洪德,郑建永,汪钊
(浙江工业大学生物与环境工程学院,浙江 杭州 3 1 0 0 1 4)
为提高非水相脂肪酶法拆分DL-薄荷醇反应的底物浓度,建立了以乙酸乙烯酯为酰基供体的无溶剂体系。实验考察了底物浓度、酶量、温度和反应时间等因素对脂肪酶Lipozyme TL IM动力学拆分DL-薄荷醇的影响,得到最佳反应条件为DL-薄荷醇浓度2.8mol/L,酶用量0.5 g,反应温度30℃,反应时间6 h。此条件下,反应转化率为22.7%,e.e.p为99.1%。脂肪酶Lipozyme TL IM重复利用20次,酶立体选择性基本不变,相对酶活为38.7%。
Lipozyme TL IM;DL-薄荷醇;拆分;无溶剂体系
薄荷醇有8个立体异构体,只有L-薄荷醇具有杀菌止痒、兴奋镇痛、助消化、促渗透等功效,被广泛应用于食品、药品、化妆品、茶类和烟草产品等众多领域[1]。全球范围内所消耗的L-薄荷醇70%来源于天然薄荷精油,但由于日照、天气的影响,从天然薄荷叶中提取得到的L-薄荷醇无法满足人们日益增长的需求。现今,因生物催化法具有反应条件温和、反应消耗能量少、成本低、效率高、拆分效果好等优点,慢慢取代一些化学合成法成为现今的研究热点和发展方向[2-3]。
目前,关于有机相中酶催化拆分DL-薄荷醇的研究报道有很多,但大多数生物催化剂的活力较低、选择性不高、制备成本较高。其中,效果较好的是Othman等[4]报道的以固定在活性环氧材料上的褶皱假丝酵母脂肪酶为催化剂,以丁酸酐为酰基供体来拆分DL-薄荷醇。结果表明该固定化酶的活性、立体选择性和稳定性都很好,但实验成本较高且底物浓度较低,不利于工业化生产。
与有溶剂体系相比较,无溶剂酶催化体系在催化效率、产物提取以及过程绿色化等方面具有显著的优势[5]。但是,目前基于无溶剂体系的酶动力学拆分DL-薄荷醇的研究相对较少。Shimada等[6]在无溶剂体系中利用褶皱假丝酵母脂肪酶催化DL-薄荷醇与长链脂肪酸发生酯化反应,虽然提高了底物浓度,但拆分效果不够理想。为了在高底物浓度下高效率、高选择性地催化拆分DL-薄荷醇,本实验在无溶剂体系中进行,以成本相对较低的脂肪酶Lipozyme TL IM作为催化剂,通过对反应过程中各种条件的优化,得到光学纯的L-乙酸薄荷酯。
1 材料和方法
1.1 主要材料
脂肪酶Lipozyme TL IM(Thermomyces lanuginosus lipase固定在二氧化硅上),丹麦诺维信公司;DL-薄荷醇,阿法埃莎(中国)化学有限公司;其他材料均购于阿拉丁试剂(上海)有限公司。所有试剂在使用前用4A分子筛除水24 h以上,密封保存。
1.2 气相色谱检测方法
采用GC-2010 plus气相色谱仪(日本岛津公司)检测反应液中各物质的光学纯度。手性柱为CP-Chirasil-Dex CB石英毛细管柱(25m×0.25mm× 0.25μm),FID检测器;检测条件:柱温为120℃,恒温保持13min,进样口温度250℃,检测器温度250℃,载气为高纯氮气,柱头压101.7 kPa,线速度35 cm/sec,尾吹3.0 mL/min,分流比100∶1。由气相色谱仪测定出的各物质的峰面积计算。产物的对映体过量值(e.e.p)、底物的对映体过量值(e.e.s)和转化率(C),计算公式如下:式中:P-和P+分别表示气相检测结果中产物L-乙酸薄荷酯和D-乙酸薄荷酯的峰面积;S-和S+分别表示气相检测结果中底物L-薄荷醇和D-薄荷醇的峰面积。


1.3 DL-薄荷醇转酯化反应体系
如无特别说明,均采用以下反应体系:在50 mL三角瓶中分别加入0.78 g(0.005 mol)DL-薄荷醇,1.8 g分子筛,一定量的酰基供体和脂肪酶Lipozyme TL IM,30℃,200 r/min水浴摇床上反应一段时间后,取一定量的反应液(必要时进行稀释),离心除去酶和杂质,转速10 000 r/min,时间7min,进行气相检测。
1.4 脂肪酶LipozymeTLIN的稳定性
当反应一段时间后,终止反应。通过过滤除去反应液,得到的酶用3 mL甲基叔丁基醚洗涤3次以除去酶表面残存的物质。然后置于室温下,使其表面的溶剂挥发,作为下一批反应用酶。更换分子筛,在相同的条件下反应同样时间,并对结果进行检测。以相同的方法重复数次上述操作。
2 结果与讨论
2.1 酰基供体的影响
在醇类物质确定的前提下,无溶剂反应体系相比有溶剂反应体系,酰基供体的种类对脂肪酶催化拆分效果的影响更为显著,所以,首先对其进行考察。为避免水的产生对反应平衡和酶活的影响,通常选择酯或酸酐作为酰基供体。结果如表1,讨论了实验中加入不同酰基供体对酶活和立体选择性的影响。

表1 不同酰基供体对反应的影响
由表1可知,乙酸乙烯酯作为酰基供体时,反应速率最大,酶的选择性最好。乙酸酐作为酰基供体时,反应速率仅次于乙酸乙烯酯,但e.e.p为0,酶对底物的两种构型没有表现出选择性,并且,在反应过程中乙酸酐水解产生大量乙酸导致酶微环境pH值下降,从而影响酶的活性和选择性。因此,接下来的实验选择乙酸乙烯酯作为酰基供体。
2.2 DL-薄荷醇浓度的影响
无溶剂反应体系中,底物同时起到反应溶剂的作用,因此,底物浓度对反应影响很大。实验中通过改变乙酸乙烯酯的量来改变DL-薄荷醇的浓度。考察了底物浓度为1.09、1.37、1.84、2.8、3.75、4.5 mol/L对反应的影响,结果如图1。
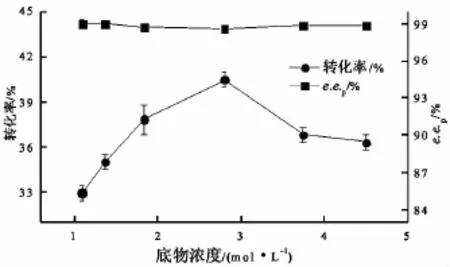
图1 不同底物浓度对反应的影响
上述结果表明,建立的无溶剂体系可以作为拆分DL-薄荷醇的反应体系。脂肪酶Lipozyme TL IM对DL-薄荷醇具有明显的对映体选择性,它优先利用L-薄荷醇与乙酸乙烯酯进行转酯化反应,即优先生成L-乙酸薄荷酯。由图1可知,在一定范围内反应转化率随着底物浓度的增加而增加,当底物浓度为2.8 mol/L时,转化率最大;超过2.8mol/L时转化率明显下降。底物浓度对产物e.e.p影响不大,不同底物浓度下的e.e.p都大于98%。因此,最适底物浓度为2.8mol/L,此时摩尔比(乙酸乙烯酯∶DL-薄荷醇)为2.0,转化率为40.5%,e.e.p为98.6%,这说明脂肪酶Lipozyme TL IM在高底物浓度下仍能保持较高的活性和立体选择性。
2.3 酶量的影响
对于一个酶催化的反应来说,酶用量有一个最大值,此时酶已达到最大反应速率,再增加酶用量,一方面底物不足,另一方面酶量过多会使酶分子之间的空间位阻增大,不利于活性中心的有效位点和底物的结合,同时也造成酶的浪费。如图2,实验中讨论酶量为0.2~2.0 g对反应的影响。

图2 不同酶量对反应的影响
由图2可知,当体系中加入0.5 g酶时,反应转化率达到最大43.39%,继续增加酶量,反应趋于平衡,这可能是由于过多的酶制剂容易增加反应底物的传质阻力,不利于反应的正常进行。另外,随着酶量的增加,由于两种构型底物的催化反应速度都得到一定程度的提高,底物的e.e.p减小。因此,选择0.5 g作为最适酶量。
2.4 温度的影响
酶的活性受温度影响较大,低温可能使酶活性较低不能进行催化反应或反应速度较慢,过高的温度可能导致酶的变性而失去活性。本实验设计了5个温度梯度来考察温度对无溶剂体系中转酯化反应的影响,其结果如图3所示。

图3 不同温度对反应的影响
由图3可知,反应速率随着温度的升高而增大,在60℃的高温条件下,脂肪酶Lipozyme TL IM依然保持了较高的活性,这是由于一方面高温下反应产生的乙醛大量挥发,减小了其对酶活的影响;另一方面较高的反应温度会减小无溶剂体系的传质黏度,加快底物分子热运动的速度。当温度从25℃升高到30℃时,转化率从29.4%增加到34.2%,增加明显。e.e.p随着温度的升高而降低,温度从30℃升高到60℃,e.e.p从98.8%降低到96%,降低明显。从绿色经济的角度考虑,该反应的最适温度定为30℃。
2.5 反应时间曲线
从图4可知,随着反应时间的延长,转化率增加缓慢,产物e.e.p逐渐降低,当反应时间超过6 h,e.e.p低于99%。并且,反应时间越长,反应产生的乙醛量越多,对酶的负影响越大,这是由于乙醛会与酶蛋白分子中的Lys残基的氨基形成schiff碱,可能使酶失活。为了高效率、高选择性的拆分DL-薄荷醇,选择最适的反应时间为6 h,此时,反应转化率为22.7%,e.e.p为99.1%。
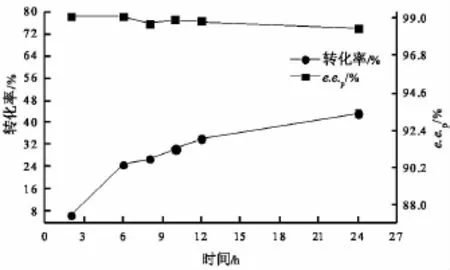
图4 反应时间曲线
2.6 脂肪酶LipozymeTLIN的稳定性
当每一批反应结束后,脂肪酶Lipozyme TL IM经甲基叔丁基醚洗涤3次以除去酶表面的残存物,置于室温下风干后加入到新的反应液中重复利用以考察脂肪酶的稳定性,结果见图5。

图5 脂肪酶Lipozym e TL IN的稳定性
酶重复利用20次得到如图5的结果。酶重复利用3次,转化率有略微增加,这可能是酶更好适应环境的结果;重复利用5次,转化率由34.2%降低到27.1%;当酶重复利用20次后,酶仍未完全失活,相对酶活为38.7%,且酶的选择性基本保持不变。这表明脂肪酶Lipozyme TL IM在该反应体系中具有良好的稳定性。良好的酶重复利用情况可以大大降低酶催化反应的成本,对工业化生产十分有利。
3 结论
在无溶剂体系中乙酸乙烯酯既作为酰基供体也作溶剂,脂肪酶Lipozyme TL IM作为生物催化剂表现出较高的底物耐受性和稳定性。通过对底物浓度、酶量、反应温度和反应时间的优化得到最适反应条件:DL-薄荷醇浓度2.8 mol/L,酶0.5 g,30℃反应6 h,转化率为22.7%,e.e.p为99.1%。该酶在无溶剂体系中的稳定性较好,重复利用20次,酶的选择性基本保持不变,相对酶活为38.7%。从整个无溶剂体系中脂肪酶Lipozyme TL IM催化乙酸乙烯酯和DL-薄荷醇的转酯化反应结果可以看出,反应过程简便易行、反应速度快、拆分效果好,且反应中不加溶剂,既降低了生产成本,也不用考虑溶剂对酶活的影响。
[1]ETZOLD B,JESS A,NOBIS M.Epimerisation of menthol stereoisomers:Kinetic studies of the heterogeneously cat alysed menthol production[J].Catalysis Today,2009,140(1/2):30-36.
[2]李云霞,李琼.薄荷醇手性拆分的研究进展[J].香料香精化妆品,2009(1):40-44.
[3]SHU Bai,ZHENG Guo,WEILiu,et,al.Resolution of(+/-)-menthol by immobilized Candida rugosa lipase on superparamagnetic nanoparticles[J].Food Chemistry,2006,96(1):1-7.
[4]OTHMAN SS,BASRIM,HUSSEIN M Z,et al.Production of highly enantioselective(-)-menthyl butyrate using Candida rugosa lipase immobilized on epoxy-activated supports[J].Food Chemistry,2008,106(2):437-443.
[5]马林,徐迪,古练权.无溶剂体系中固定化脂肪酶催化的酯交换反应研究[J].中山大学学报(自然科学版),2003(5):39-43.
[6]SHIMADA Y,HIROTA Y,BABA T,et,al.Enzymatic synthesis of L-menthyl esters in organic solvent-free system[J].Journal of the American Oil Chemists Society,1999,76(10):1139-1142.
(责任编辑:朱小惠)
Lipozyme TL IM catalyzed resolution of DL-menthol in solvent-free system
LIQin,YAN Hongde,ZHENG Jianyong,WANG Zhao
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
In order to enhance the substrate concentration of lipase catalyzed resolution of DL-menthol in non-aqueous phase,a solvent-free system was established using vinyl acetate as acyl donor.The effects of substrate concentration,enzyme dosage,temperature and reaction time on kinetic resolution of DL-menthol were investigated.The optimum conditions were determined as follows:substrate concentration 2.8 mol/L,enzyme dosage 0.5 g,reaction temperature 30℃,reaction time 6 h.Under above conditions,the conversion reached 22.7%with e.e.pvalue of 99.1%. In addition,the lipase reserved 38.7%of its activity with stable enantioselectivity after 20 recycles
Lipozyme TL IM;DL-menthol;resolution;solvent-free system
O621
A
1674-2214(2015)04-0015-04
2015-05-11
李琴(1989—),女,湖北荆州人,硕士,主要从事DL-薄荷醇催化拆分方面的研究,E-mail:435984107@qq.com.
汪钊教授,E-mail:hzwangzhao@163.com.

