生物素类活性探针在酶分离中的应用研究进展
朱,俞家俊,应向贤
(浙江工业大学生物与环境工程学院,浙江 杭州 310014)
生物素类活性探针在酶分离中的应用研究进展
(浙江工业大学生物与环境工程学院,浙江 杭州 310014)
酶是一类具有重要意义的生命活性物质,而如何高效快速地从生物体内提取目的酶已成为生物学领域的一个关键性问题。近年来,越来越多的研究将蛋白质组学的热门技术——活性探针技术运用于酶的分离纯化中。对近年来研究得最多的链霉素亲和层析相关的活性探针技术应用于酶分离的研究进行了综述,并例举了丝氨酸蛋白酶、半胱氨酸蛋白酶、N-乙酰氨基葡萄糖苷酶、脯氨酰基寡肽酶、组蛋白脱乙酰酶的分离技术及其机理。
活性探针;酶分离;链霉素亲和层析
酶是生物体内重要的活性物质,几乎所有的生命活动都需要酶的参与[1],酶的研究对生命科学有重要的意义。同时在发酵工程领域,从微生物中分离提取酶对产业的发展也具有重大的促进作用。传统的方法过程比较繁琐,尤其是酶与杂蛋白的分离过程,要分别鉴定分离后的酶是否为目标酶,而且还存在有的酶在细胞或者菌株中含量比较低,其他的杂质比较多,酶本身易失活等缺点。因此作为一种更加有效的纯化方法——活性探针技术被越来越多地应用于快速筛选和分离提取酶[2]。
1 活性探针的定义
活性探针,又名为机制探针,是指能直接检测酶的活性位点的化学探针[3],被广泛应用于酶检测与分离中。活性探针主要由三部分组成[4](如图1):活性基团、报告基团、连接基团。

图1 活性探针的组成
活性基团通过共价修饰靶标蛋白的氨基酸残基或与之有强烈亲和力的残基,使得探针分子和靶标蛋白紧密结合,以形成蛋白-探针复合物,从而为后续对报告基团探测、富集和纯化靶标蛋白的实验提供前提[5]。
报告基团的作用是用来快速简便地富集、纯化和探测与小分子探针相互作用的靶标蛋白。在蛋白的分离中运用最多的是生物素标签。生物素(biotin)又称维生素H,它能与链霉亲和素-琼脂糖珠子特异性紧密结合而达到富集和纯化靶标蛋白的目的[6]。
连接基团(linker)是活性基团和报告基团之间的连接链,其最主要的作用就是将上述两部分隔开。另外,连接基团本身也会对活性探针与靶标蛋白的结合产生重要的影响[7]。长链烷基、聚乙二醇以及多肽片段等都是常见的连接基团。
2 活性探针在酶分离中的研究进展
蛋白酶与人类的疾病密切相关。人体内不同蛋白酶的含量甚至可以直接作为某些疾病的诊断依据。因此对蛋白酶的研究显得尤为重要。利用活性探针对蛋白酶的分离成为近年来的研究热点,并且已经取得了很多的成就。
1999年,Liu等[8]从重组的HEK-293细胞中分离得到丝氨酸蛋白酶。图2所示,丝氨酸蛋白酶上面有活性基团羟基,它能与探针上面的活性基团氟发生取代反应,从而将生物素共价结合到酶上。后续利用链霉素亲和层析分离得到目的酶。
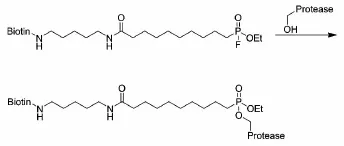
图2 丝氨酸蛋白酶探针反应机理
2000年,Doron等[9]从鼠肾脏细胞中分离得到了半胱氨酸蛋白酶。图3所示,这类蛋白酶结构上的活性基团巯基能与探针上面的环氧乙醚发生加成反应将生物素共价地标记到蛋白上。

图3 半胱氨酸蛋白酶探针反应机理

图4 脯氨酰基寡肽酶探针结构
为了观察探针-蛋白质的结合情况,还可以在活性探针上面修饰荧光基团。同时考虑到直接标记对探针活性和选择性的干扰,可以采用点击化学反应(Click反应)来实现对酶的标记[10-13]。2009年,Eduard等[14]用荧光标记法从鼠大脑细胞中分离得到脯氨酰基寡肽酶(POP;EC3.4.21.26)。这类活性探针的结构如图4所示。结构2中既有能进行链霉素亲和层析的活性物质生物素,又有一个荧光基团罗丹明,同时在末端结构还有一个Click反应的活性基团炔基。这类探针可以利用荧光基团的成像作用使得目的蛋白直接可视化,同时还能使用生物素-链霉亲和素系统来富集和纯化靶标蛋白,这种探针被称为“三功能”型探针[15]。探针的作用机理与前述类似,探针1首先与脯氨酰基寡肽酶结合,再通过与2进行的亚铜催化Click反应将生物素与罗丹明标记到酶上。
除了蛋白酶以外,在动植物细胞以及微生物细胞中,还有很多其他重要的水解酶。对这些酶的分离,活性探针技术也有很广泛的运用。
2001年,Mie Ichikawa等[16]利用亲和标记技术从鼠脾脏细胞分离得到能催化裂解N-乙酰葡萄糖胺与丝氨酸或者苏氨酸之间化学键的N-乙酰氨基葡萄糖苷酶(O-GlcNAc,ase)。探针的机理如图5所示,当探针进入酶的活性中心以后,糖苷键随即被断开,并释放出氟化氢。随后酶上面的亲核基团与探针残基共价结合形成稳定的酶-生物素产物。

图5 N-乙酰氨基葡萄糖苷酶探针机理
为了增强探针与酶的结合能力,以减少在层析分离过程中的损失。因此在设计活性探针中经常会引入光交联基团。光交联基团在特定波长紫外光的照射下形成的活性中间体(如氮宾、羰基自由基、碳烯)会和酶上的基团形成稳定的共价结合,使探针能牢固地结合到酶上[17]。常见的光交联基团包括重氮环、二苯乙烯等[18-19]。2007年,Cleo等[20]设计了一类有二苯丙酮光交联基团的活性探针,并成功运用于从人类黑素瘤细胞MUM2B和MUM2C中分离得到组蛋白脱乙酰酶HDAC1、HDAC2以及这两种酶的关联蛋白MBDB3。探针的结构如图6所示,包含三部分:酶抑制剂活性基团、光交联基团和反应基团。

图6 组蛋白脱乙酰酶探针结构
探针的作用机理如图7,HDAC的抑制剂活性基团先进入到酶的活性位点中,然后通过紫外照射,二苯丙酮会与旁边蛋白上面的基团发生共价结合。再通过亚铜催化的点击化学反应将生物素连接到被标记的酶上。最后利用链霉素的亲和层析技术,分离得到HDAC以及MBD3。

图7 组蛋白脱乙酰酶探针机理
3 展望
生物素类活性探针技术发展至今已较为成熟,它具有选择性好、灵敏度高等优点,并且已被成功地应用于生物体内许多酶的提取上,特别是在蛋白质组学上的应用非常广泛。对药物靶蛋白、致病机理等等领域的研究有很重要的贡献。然而活性探针技术在生物化工领域应用目前并不是很多。通常微生物来源的酶的分离方法主要有离子交换层析、羟基磷灰石层析、凝胶过滤层析以及疏水层析等。随着纯化设备的发展,一些新颖的分离纯化方法也被开发出来,如膜分离、免疫亲和纯化、以聚乙二醇为固相的层析技术、双水相界面层析等。虽然这些分离纯化方法已经有大量的报道,但是这个过程相当复杂,而且往往需要几种方法结合使用才能分离得到预期纯度的酶,因此分离效率并不高。而活性探针技术的发展为生物化工领域酶的分离提供了一种更加有效的方法。例如,对于在生物化工中应用十分广泛的具有手性拆分功能的酶类,我们可以根据其底物特异性来针对性地设计一类探针,该探针可特异性地共价结合到目标酶上,然后运用链霉素亲和层析技术分离得到目的酶。这种方法较传统上的层析技术无论在效率上还是成本上都具有很大的优势。因此,我们相信在不久的将来,活性探针技术必将在生物化工领域发挥更加重要的作用。
[1]YOUNG D D,NICHOLSJ,KELLY R M,et al.Microwave activa tion of enzymatic catalysis[J].Journal of the American Chemical Society,2008,130(31):10048-10049.
[2]HEAL W P,WICKRAMASINGHE S R,TATE E W.Activity based chemical proteomics:profiling proteases as drug targets[J]. Current Drug Discovery Technologies,2008,5(3):200-212.
[3]W ILLIAM P H,TAM T H,EDWARD W T.Activity-based probes:discovering new biology and new drug targets[J].Chemical Society Reviews,2011,40(12):246-257.
[4]SEVNUR S,HAEDKE U,STEVEN H L,et al.Activity-based probes for the study of proteases:recent advances and developments[J].ChemMedChem,2012,7(2):1146-1159.
[6]LESLIE B J,HERGENROTHER P J.Identification of the cellular targets of bioactive small organic molecules using affinity reagents[J].Chemical Reviews,2008,37(7):1347-1360.
[7]SHIYAMA T,FURUYA M,YAMAZAKI A,et al.Design and synthesis of novel hydrophilic spacers for the reduction of nonspecific bindingproteinson affinity resins[J].Bioorganic&Medicinal Chemistry,2004,12(11):2831-2841.
[8]LIU Yongsheng,PATRICELLIM P,CRAVATT B F.Activitybased protein profiling:The serine hydrolases[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(26):14694-14699.
[9]GREENBAUM D,MEDZIHRADSZKY K F,BURLINGAME A,et al.Epoxide electrophiles as activity-dependent cysteine protease profiling and discovery tools[J].Chemistry&Biology,2000,7(8):569-581.
[10]ANNA E S,CRAVATT B F.Profiling enzyme activities in vivo using click chemistry methods[J].Acs Chemical Biology,2004,11(4):535-546.
[11]HARTMUTH C K,FINNM G,SHARPLESSK B.Click chemistry:diverse chemical function from a few good reactions[J].Angewandte Chemie-International Edition,2001,40(11):2004-2021.
[12]MELDAL M,TORNOE CW.Cu-catalyzed azide-alkyne cycloaddition[J].Chemical Reviews,2008,108(8):2952-3015.
[13]KURUNAKARAN A K,SHI Haibin,GE Jingyan,et al.The use of click chemistry in the emerging field of catalomics[J]. Organic&Biomolecular Chemistry,2010,8(8):1749-1762.
[14]SABID E,TARRA T,NIESSEN S,et al.Activity-based probes for monitoring postprolineprotease activity[J].ChemBioChem,2009,10(14):2361-2366.
[15]ADAM GC,SORENSEN E J,CRAVATTB F.Chemical strategies for functional proteomics[J].Molecular&Cellular Proteomics,2002,1(10):781-790.
[16]ICHIKAWA M,ICHIKAWA Y.Amechanism-basedanity-labelingagent forpossibleuse in isolatingN-acetylglucosaminidase[J].Bioorganic&Medicinal Chemistry Letters,2001,11:1769-1773.
[17]CHAN E W,CHATTOPADHAYA S,PANICKER R C,et al. Developing photoactive affinity probes for proteomic profiling:hydroxamate-based probes for metalloproteases[J].Journal of the American Chemical Society,2004,126(44):14435-14446.
[18]SHI Haibin,CHENG Xiamin,SZE S K,et al.Proteome profiling reveals potential cellular targetsof staurosporine using a clickable cell-permeable probe[J].Chemical Communications,2011,47(40):11306-11308.
[19]SHI Haibin,ZHANG Chongjing,CHEN G Y J,et al.Cellbased proteome profiling of potential dasatinib targets by use of affinity-based probes[J].Journal of the American Chemical Society,2012,134(6):3001-3014.
[20]SALISBURY C M,CRAVATT B F.Activity-based probes for proteomic profiling of histone deacetylase complexes[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(4):1171-1176.
(责任编辑:朱小惠)
Research progress of the app lication of biotinylated activity-based probe in the separation of the enzymes
ZHUQin,YU Jiajun,YING Xiangxian
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
Enzyme is a kind of biologically active compounds with important significance.It has become a critical problem to extract the target enzyme in vivo quickly and efficiently.In recent years,more and more researchers applied the popular technology of activity-based probes in proteomics to separate and purify enzymes.This paper summarized the application of activitybased probes in the separation and purification of enzymes based on the streptavidin affinity chromatography.And we also listed the separation technologies and their functionalmechanism for serine and cysteine protease,N-Acetylglucosaminidase,prolyloligopeptidase and histone deacetylase with probes.
activity-based probe;separation of enzymes;streptavidin affinity chromatography
Q814
A
1674-2214(2015)04-0051-04
2015-08-26
国家基金新型近红外水解酶FRET探针设计、制备及可视化研究(21272212)
朱(1970—),男,浙江义乌人,教授,博士,研究方向为化学生物学,E-mail:zhuq@zjut.edu.cn.

