马铃薯丝核菌病生防菌株筛选及其拮抗作用研究
刘宇帅,曹 旭,陈静宇,孟利强,张淑梅,胡基华,姜 威,李 晶*
(1.黑龙江省科学院高技术研究院,黑龙江哈尔滨150001;2.黑龙江省科学院微生物研究所,黑龙江哈尔滨150010)
近年来马铃薯产业发展迅速,种植面积不断扩大,但同时马铃薯病害日趋严重,马铃薯丝核菌病就是其中之一,该病不仅发病普遍,危害程度也越来越重,严重者可达5%左右,降低20%的产量,并影响品质,该病害已成为马铃薯产业发展的一大障碍[1]。马铃薯丝核菌病又称黑痣病、丝核菌溃疡病,病原菌是一种真菌,其无性阶段是立枯丝核菌。该病原菌寄主范围广泛,在全世界的耕作及非耕作土壤中均有分布,许多丝核菌很容易从染病植株及土壤中分离得到。该病原菌易引起植物烂种、苗期猝倒,在土壤中的腐生竞争力强,存活时间长,其菌核在块茎上或土壤中越冬,次年根据环境条件又可发生侵染。因此,马铃薯丝核菌病是一种种薯带病和土壤传播相结合的病害,从而给防治带来很大困难[2-5]。
马铃薯丝核菌病的传统防治方法主要有农业防治和化学防治。近年来,由于传统的农业防治方法不能从根本上控制病害的发生,防治效果往往不稳定;而化学农药的长期使用会使病原菌产生抗药性,过量使用农药还会破坏土壤的微生态环境,加重农药对环境的污染,造成有毒有害物质在农作物体内过多残留。因此,生物防治方法的研究越来越受到人们的重视,如利用微生物之间的拮抗作用,选择对农作物不造成危害的微生物来抑制病原菌的生长[6]。为此,笔者筛选了对马铃薯丝核病菌具有拮抗作用的生防菌,并对其拮抗作用机制进行了初步研究,旨在为马铃薯丝核菌病的有效防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌。马铃薯丝核病菌由黑龙江省农业科学院植物脱毒苗木研究所赠送,供试验筛选所用细菌均为实验室保藏的生防菌株。
1.1.2 培养基。NYD 培养基:牛肉浸膏8.0 g,酵母膏5.0 g,葡萄糖10.0 g,蒸馏水1 000 ml,若固体培养基需加琼脂15.0 g,pH7.2 ~ 7.5;PD 培养基:马铃薯 200.0 g,葡萄糖20.0 g,蒸馏水 1 000 ml,若固体培养基需加琼脂 15.0 g,pH7.2 ~7.5;黑麦液体培养基:黑麦 100.0 g,蔗糖 15.0 g,碳酸钙 1.4 g,蒸馏水 1 000 ml,若固体培养基需加琼脂 15.0 g。
1.2 方法
1.2.1 生防菌株的筛选。
1.2.1.1 初筛。对实验室现有保藏的生防细菌菌株(CZS、LKS、WHS、PB12、B10、CZL、ZH2、B29、JK)挑取单菌落,分别接于5 ml NYD试管中,于35℃、170 r/min振荡器中培养18 h待用。将保存在斜面上的马铃薯丝核病菌接PDA平板,置于28℃培养箱中进行培养至菌丝长满培养皿。在PDA培养基平板上划十字线分出4个区域,每个区域中心分别接入直径为8 mm的靶标病原菌菌饼,同时在平板十字线上划入待测生防菌液,设无生防菌液为对照,4次重复,于25℃下培养,当对照真菌长至十字线位置时观察处理组抑菌效果。
1.2.1.2 复筛。经过初筛获得7株具有拮抗作用的细菌,采用“1.2.1.1”方法继续进行复筛,当对照真菌长至十字线位置时观察处理组抑菌效果。测量抑菌带宽,计算抑菌率。将抑菌效果大于50%的生防菌进行纯化保藏。
抑菌率=(对照菌丝直径-处理菌丝直径)/对照菌丝直径×100%
1.2.2 生防菌株的拮抗作用测定。对具有较强拮抗效果的2株生防细菌挑取单菌落,分别接于5 ml NYD试管中,于30℃、150 r/min振荡器中培养24 h。再以2%的接种量分别接种于50 ml NYD三角瓶中,于30℃、150 r/min振荡器中培养45 h待用。将保存的马铃薯丝核病菌接于PDA平板,置于28℃培养箱中进行培养,待菌丝长满培养皿。
1.2.2.1 液体培养条件下的拮抗作用测定。将PB12与CZS菌液分别进行10倍、100倍梯度稀释,然后在50 ml PD液体培养瓶中以2%的接种量分别加入细菌原液及各稀释度菌液1 ml。再于每瓶中分别接入直径为8 mm的靶标病原菌菌饼,设未接种生防菌液为对照,3次重复,置于28℃恒温摇床上培养。每天对真菌生长情况进行观察,到第4天停止培养,此时对照组真菌生长量明显多于试验组。将菌丝过滤,置于阴凉干燥处晾干后称其干重,并计算抑菌率。
抑菌率=(对照菌丝重量-处理菌丝重量)/对照菌丝重量×100%
1.2.2.2 固体培养条件下的拮抗作用测定。将PB12与CZS菌液分别进行10倍、100倍梯度稀释,然后在PDA培养基平板上均匀涂满细菌原液及各稀释度菌液100μl。晾干后每平板分别接入直径为8 mm的靶标病原菌菌饼,设未涂生防菌液为对照,3次重复,于28℃培养箱中培养。每天对真菌生长情况进行观察,测量菌丝直径,并计算抑菌率。
抑菌率=(对照菌丝直径-处理菌丝直径)/对照菌丝直径×100%
1.2.2.3 生防菌对马铃薯丝核病菌菌核形成的影响。将PB12与CZS菌液分别进行10倍、100倍梯度稀释,然后在PDA培养基平板上均匀涂满各浓度的菌液100μl(包括细菌原液及各稀释度菌液)。晾干后每平板分别接入直径为8 mm的靶标病原菌菌饼,设未涂生防菌液为对照,3次重复,于28℃光照培养箱中培养,定期对菌核形成情况进行观察。
2 结果与分析
2.1 马铃薯丝核菌病生防菌的筛选 通过平板抑菌对峙试验对实验室现有生防菌株的抑菌能力进行测定,筛选出7株抑菌能力不同的细菌。其中,菌株PB12和CZS的抑菌效果较明显,通过对抑菌带宽度的测量可知,菌株PB12的抑菌率为59.82%,菌株 CZS 为56.37%(表1)。
2.2 菌株PB12、CZS对丝核菌的拮抗作用
2.2.1 液体培养条件下的拮抗作用。通过共培养的方法对菌株PB12、CZS的拮抗作用进行测定,结果表明在液体培养条件下,对照组中丝核菌菌丝迅速生长成团块,而加有生防菌株的培养瓶内菌丝生长缓慢。第4天时停止培养,将各组菌丝进行过滤、晾干、称重。由图1可知,对照组菌丝团块明显大于各试验组菌丝团块,同时随着稀释度的增加,试验组团块的大小无明显变化。通过计算各组菌丝团块的重量表明,菌株PB12和CZS均能够抑制马铃薯丝核病菌菌丝的生长,抑菌率达到98.00%。不同浓度的生防菌液(原液、稀释10倍和100倍)对抑菌效果影响较小(表2)。

表1 供试菌株对丝核菌的防治效果
2.2.2 固体培养条件下的拮抗作用。通过平板抑菌试验对菌株PB12、CZS的拮抗作用进行测定,结果表明在固体培养条件下,对照组中丝核菌菌丝逐渐生长且菌丝致密、健壮,而涂有生防菌株的培养皿内菌丝生长缓慢,当培养至第3天时对照组菌丝长满整个平板,试验组各菌丝稀疏,长势明显弱于对照组,在培养中后期几乎不再生长(图2)。通过对菌丝直径计算表明,菌株PB12和CZS对马铃薯丝核菌的抑菌率虽然没有液体条件下的抑菌率高,但几乎可达到60%以上,且随着培养时间的延长抑菌能力逐渐升高,其中菌株PB12的抑菌率可达到79.82%。不同浓度的生防菌液(原液、稀释10倍和100倍)对抑菌效果存在影响,随着稀释度的增加抑菌能力下降(表3)。

表2 液体培养条件下丝核菌生防菌株PB12与CZS的拮抗效果
2.2.3 生防菌对马铃薯丝核病菌菌核形成的影响。菌核是由菌丝紧密连接交织而成的休眠体,能够抵御外界不良环境。当环境适宜时,菌核能萌发产生新的营养菌丝或从上面形成新的繁殖体。试验结果表明,培养到第14天时,对照组开始形成黑色菌核,随着培养时间的延长菌核逐渐变大、增多、大小不一、具有光泽且都聚集在菌落中心。而整个培养期间涂有不同浓度生防菌液(原液、稀释10倍和100倍)的各试验组均未发现菌核的形成(图3)。因此,生防菌PB12和CZS在抑制马铃薯丝核菌菌丝正常生长的同时也抑制了其菌核的形成,削弱了丝核菌抵御不良环境的能力。
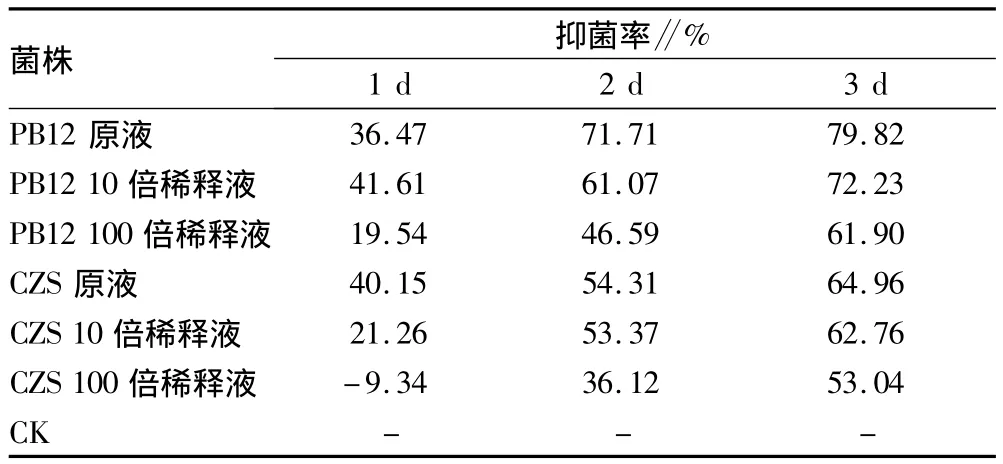
表3 固体培养条件下丝核菌生防菌株PB12与CZS的拮抗效果
3 结论与讨论
该研究筛选出2株对马铃薯丝核病菌抑菌率达98%的生防菌株PB12和CZS,通过抑菌试验表明,无论是在液体培养条件下还是固体培养条件下,菌株PB12和CZS对马铃薯丝核病菌的拮抗作用都十分稳定,在液体培养时生防菌液稀释度的变化对抑菌效果无明显影响,在固体培养时随着生防菌液稀释度的增加抑菌能力稍有下降,同时该2株生防菌均可抑制丝核病菌菌核的形成,削弱丝核菌抵御外界不良环境的能力。
利用微生物之间的拮抗作用防治植物病害的研究较多[7],但目前国内对马铃薯丝核菌病害的报道多集中于病原菌的生物学特性、传播以及化学防治方面,对该病原菌生物防治的报道很少。植物病害的防治受植物、病原物、拮抗菌、环境条件等多方面因素的影响[8]。有研究表明,病原菌立枯丝核菌是一种全世界大量农作物和野生寄主的病原物,当该病菌侵染到马铃薯上,随着土壤湿度的增大,新薯块上的菌核形成会加重。新块茎上形成的菌核或在土壤中越冬的菌核次年根据环境条件又可发生侵染,给防治带来很大困难[3]。
该研究筛选出的生防菌株PB12和CZS对马铃薯丝核病菌具有较强的拮抗作用,对病原菌菌丝有抑制作用,更重要的是能够显著抑制马铃薯丝核菌菌核的形成,表现出防治菌核病的潜力,可提高马铃薯产量及品质,具有进一步研究的价值。针对该2株生防菌的抗菌机理、在马铃薯活体上是否具有相同的拮抗作用以及田间防效等试验将在后续研究中进行。
[1]谭宗九,郝淑芝.马铃薯丝核菌溃疡病及其防治[J].中国马铃薯,2007,21(2):108-109.
[2]曹春梅,李文刚,张建平,等.马铃薯黑痣病的研究现状[J].中国马铃薯,2009,23(3):171 -173.
[3]王春媛.马铃薯丝核菌溃疡病及其防治措施[J].农业开发与装备,2013(6):106.
[4]SUWANNARACH N,KUMLA J,BUSSABANB,et al.Biocontrol of rhizoctonia solani AG-2,the causal agent of damping-off by Muscodor cinnamomi CMU-Cib 461[J].World journal of microbiology & biotechnology,2012,28(11):3171-3177.
[5]刘力,葛起新.华东地区立枯丝核菌融合群鉴定[J].浙江农业大学学报,1987,13(3):3 -9.
[6]张天晓,张志光.立枯丝核菌Rhizoctonia solani Kühn的研究[J].湖南师范大学自然科学学报,1986,9(1):76-82.
[7]WHIPPSJM.Microbial interactions and biocontol in the rhizosphere[J].Journal of experimental botany,2003,56:487 -451.
[8]HANY X,HUBJ,WANGGN.Control efficacy and antifungal mechanism of Bacilluscereus strain JK14 against wheat takeall disease[J].Agricultural science & technology,2008,9(1):70-74.

