miR-155下调心肌细胞ATR1α表达改善心肌细胞肥大*
杨 勇,周 勇,曹 政,吴瑞霞,佟新竹,谢华强
(湖北医药学院附属十堰市太和医院:1.心血管内科;2.肿瘤内科 442000)
心肌肥大是老年患者充血性心力衰竭的重要病理生理过程之一,心肌肥大的过程包括心肌细胞体积的增大和蛋白合成的增加。血管紧张素Ⅱ(AngⅡ)主要与AngⅡ1型受体(AT1R)结合后激活心肌肥大的过程,AT1R过表达也与心肌肥大关系密切[1]。微小RNA(microRNA,miR)是一类19~25个碱基内源性、具有高度保守性的非编码RNA序列[2]。研究证实,多个 miR(miR-let-7a、miR-21、miR-22、miR-208、miR-206等)均参与了心肌肥大的发生、发展过程的不同环节[3]。miR-155是一个多功能 miR,在肺、心脏及肾脏表达较丰富[4]。Blanco等[5]观察到miR-155低表达与心肌肥大及心力衰竭的风险显著升高相关;Zheng等[6]则发现miR-155能够和细胞内源性AT1RmRNA结合,抑制蛋白的翻译,明显降低AT1R的表达水平。心肌细胞有丰富的AT1R的表达,且在啮齿类动物的心脏组织主要分布和表达的为AT1R的α亚型(ATR1α)[7]。因此本研究推测 miR-155可能通过对心肌细胞ATR1α表达的调控进而调节心肌肥大的发生。本研究拟观察miR-155表达对大鼠心肌细胞肥大的影响以及对ATR1α表达的影响,以探讨miR-155作为心肌细胞肥大的调控靶点的可能性。
1 材料与方法
1.1 材料 大鼠心肌细胞株H9C2(2-1)由武汉大学中国典型培养物保藏中心提供。LipofectamineTM2000(Invitrogen公司,美国)、mirVana PARISTM Kit(Ambion公司,美国)由王汉琴博士惠赠;Trizol试剂(Invitrogen公司,美国);Platinum SYBRGreen qPCR SuperMix-UDG(Invitrogen Biotechnology中国公司)。AngⅡ(Sigma,美国)、兔抗 ATR1α多克隆抗体(ABCAM公司,英国);兔抗CaN-β多克隆抗体、兔抗 NFATc-4抗体、兔抗β-actin多克隆抗体、HRP标记的羊抗兔IgG抗体(Bioworld Technology公司,美国);miR-155RNA 模拟物(mimics)及抑制物(inhibitors)由上海市吉玛生物科技有限公司根据sanger miRNA数 据 库 的 miR-155序 列 5′-UUA AUG CUA AUU GUG AUA GGG GU-3′(编号:MIMAT 0030409)设计并合成miR-155mimics,上游序列为:5′-UUA AUG CUA AUU GUG AUA GGG GU-3′,下 游 序 列 为:5′-CCC UAU CAC AAU UAG CAU UAA UU-3′。miR-155inhibitors序列为5′-ACC CCU AUCA CAA UUA GCA UUA A-3′。

表1 miR-155和U6内参的RT及PCR引物序列

表2 RT-PCR各产物的引物序列
1.2 方法
1.2.1 心肌细胞培养及实验分组 转染 miR-155mimics及inhibitors的心肌细胞在转染后24h加入1×10-7mol/L AngⅡ,继续作用48h后用于后续检测。实验分对照组,不加任何药物;AngⅡ组,加入 AngⅡ,终浓度为1×10-7mol/L,不进行转染;模拟物组,转染入 miR-155mimics 80nmol/L,miR-155抑制物组,转染入 miR-155inhibitor 80nmol/L;AngⅡ加模拟物组,转染入 miR-155mimics 80nmol/L并加入 AngⅡ,终浓度为1×10-7mol/L;AngⅡ加抑制物组,转染入 miR-155inhibitor 80nmol/L并加入 AngⅡ,终浓度为1×10-7mol/L。
1.2.2 心肌细胞转染、荧光检测 心肌细胞用含10%胎牛血清DMEM培养生长至融合后进行传代,用含10% 胎牛血清的DMEM调节细胞密度至1×108/L种细胞于6孔板中。培养心肌细胞生长48h至细胞融合达30%~50%后,换无血清培养液并使用脂质体2000转染miR-155mimics及inhibitors进入心肌细胞。激光共聚焦显微镜下使用蓝色激光激发FAM荧光(激发波长480nm,发射波长520nm),拍摄荧光图片和同一视野中明场细胞照片。
1.2.3 实时荧光定量PCR法检测心肌细胞 miR-155的表达 收集对照组、模拟物组、miR-155抑制物组细胞,按照mir-Vana PARISTM试剂盒说明书提取并分离小于100nt的小分子RNA。使用逆转录试剂盒逆转录合成cDNA,应用ABI 7300Real Time PCR System在48孔PCR反应模块中进行定量PCR检测miR-155表达水平,反应体系于50℃2min,95℃2min,95℃15s,然后60℃30s,共40次循环,最后20℃2min。以U6基因为内标基因,使用2-ΔΔCT法计算 miR-155表达量。逆转录及荧光定量PCR引物序列见表1。
1.2.4 细胞表面积检测 转染24h后,心肌细胞加AngⅡ继续作用48h,取有心肌细胞生长的盖玻片,用预冷的Hank′s液漂洗血清及杂质,再用4%多聚甲醛固定15min后晾干。在相差显微镜下拍照,采用Leica图像分析系统对心肌细胞进行计数并测量单个细胞直径,每孔取10个视野,每个视野约20个细胞。测量细胞表面积,取平均值。每组重复3次。
1.2.5 RT-PCR 法检测心肌肥大标记物 ANP、β-MHC 及ATR1αmRNA表达 细胞处理后,依据产品说明书用Trizol裂解;氯仿抽提;4℃,15 000r/min离心15min,上层无色液相用异丙醇沉淀,加入DEPC水溶解沉淀,紫外分光光度计测定A衡量纯度(适当比值在1.6~2.0)。逆转录反应(RT)合成模板cDNA。聚合酶链反应后取PCR产物5μL在1.2%琼脂糖凝胶上电泳,用凝胶成像仪进行分析,结果以吸光度比值表示。各产物的PCR引物序列、片段长度、退火温度见表2。PCR 反应条件为 94 ℃、3min,94 ℃、30s,72℃、1min,循环35次,最后72℃ 延伸10min。
1.2.6 Westen bolt法检测心肌细胞的ATR1α表达 提取心肌细胞总蛋白,4,4-二羧基酸-2,2-二喹啉(BCA)法测定蛋白浓度,完毕后将其加入5%十二烷基环酸钠(SDS)加样缓冲液中煮沸5min,以使蛋白质样品变性,置于-80℃冻存备用。按每孔上样量50μg进行SDS-PAGE电泳,稳压冰浴电转至醋酸纤维素膜上,5%脱脂牛奶封闭1h,一抗孵育4℃过夜(ATR1α1∶500),TBST 洗涤后加入荧光的山羊抗兔IgG(1∶15 000)室温孵育1h,采用化学发光法于暗匣中曝光。最后用显影、定影试剂进行显影和定影。将胶片进行扫描存档,Bio-Bad公司Quantity-One软件处理系统分析目标带的光密度值。蛋白表达量用目的蛋白/GAPDH的吸光度比值表示。
1.3 统计学处理 每组进行独立重复3次试验,用SPSS13.0统计软件对数据进行分析。数据采用±s表示,两组之间比较使用t检验;多组间比较采用单因素方差分析,后以Tukey′s post-test进行检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 心肌细胞miR-155模拟物转染与miR-155表达水平 转染24h后,在激光共聚焦显微镜的蓝光激发状态下,可见绿色荧光在视野下成簇分布(图1B)。与同一视野下明场细胞照片(图1A)进行融合后发现绿色荧光主要分布在细胞质中(图1C)。证实miR-155模拟物通过脂质体转染方法成功转染入细胞内。实时荧光定量PCR显示,与AngⅡ组对比,AngⅡ加模拟物组心肌细胞miR-155水平明显升高达3~4倍[(3.58±0.06)vs.(1.00±0.02),P<0.05];AngⅡ加抑制物组心肌细胞 miR-155水平下降[(0.46±0.01)vs.(1.00±0.02),P<0.05]。
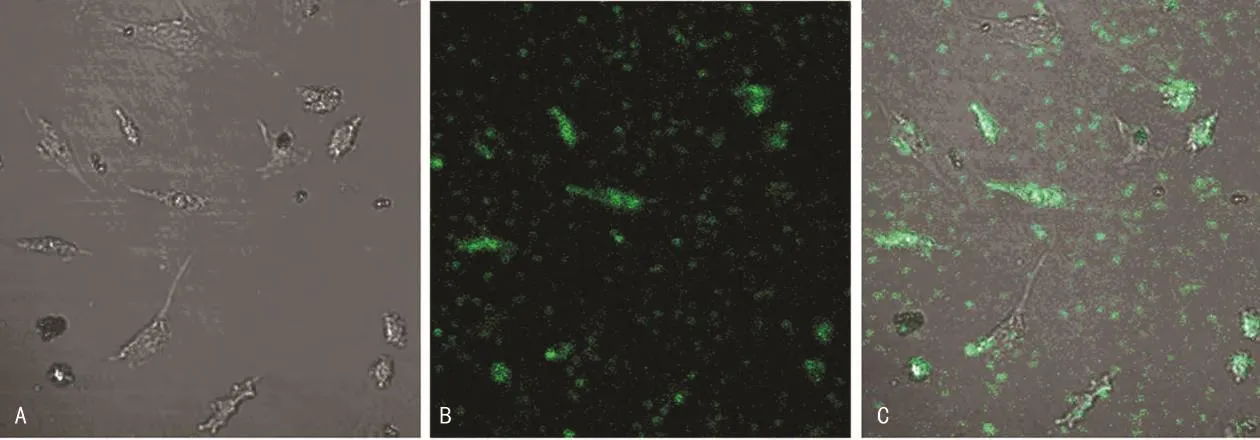
图1 转染后心肌细胞荧光分布(荧光显微镜×400)
图2 各组心肌细胞图片(×200)
2.2 心肌细胞表面积改变与对照组相比,在AngⅡ作用下,AngⅡ组心肌细胞表面积出现扩大(P<0.05);而模拟物组与抑制物组,心肌细胞表面积仅有增加趋势,但无明显统计学意义(P>0.05);与AngⅡ组比较,转染 miR-155模拟物及 miR-155抑制物入心肌细胞后再给予刺激,AngⅡ加模拟物组心肌细胞表面积明显缩小(P<0.05),见图2和图3。
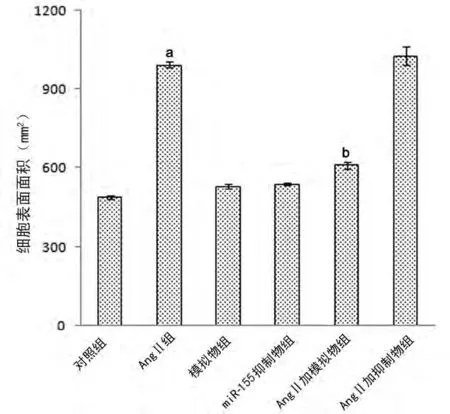
图3 各组心肌细胞表面积比较
2.3 ATR1αmRNA和蛋白表达与对照组相比,模拟物组和miR-155抑制物组的ATR1αmRNA和蛋白表达水平差异无统计学意义(P>0.05)。与AngⅡ组对比,AngⅡ加模拟物组心肌细胞ATR1αmRNA和蛋白表达水平均下降(P<0.05),见图4。
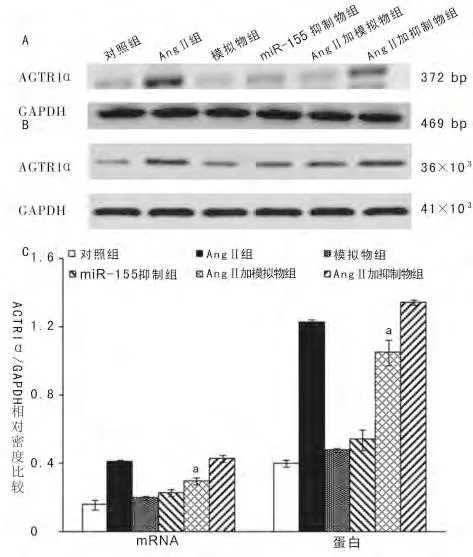
图4 各组细胞ATR1αmRNA和蛋白表达比较
2.4 心肌肥大标记物β-MHC及ANP mRNA表达与对照组相比,模拟物组和miR-155抑制物组的β-MHC mRNA表达水平无明显增加(P>0.05);与AngⅡ组相比,AngⅡ加模拟物组的β-MHC表达明显减少(P<0.05)见图5、6。与对照组相比,模拟物组和miR-155抑制物组的ANP mRNA表达水平无明显增加(P>0.05);与AngⅡ组相比,AngⅡ加模拟物组的 ANP mRNA表达明显减少(P<0.05)见图7、8。
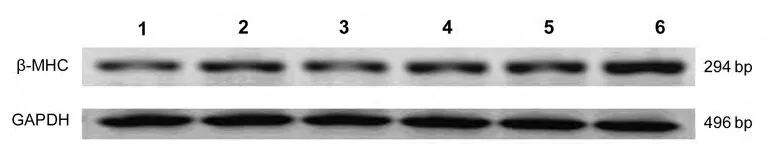
图5 各组细胞β-MHC与GAPDH PCR条带密度比较
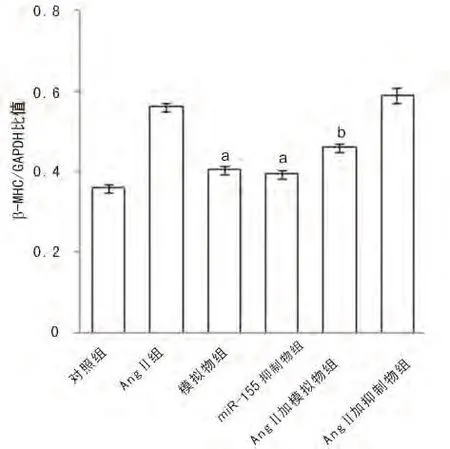
图6 各组细胞β-MHC相对表达量分析图
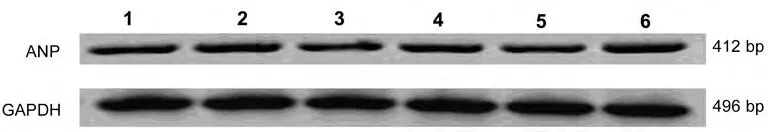
图7 各组细胞ANP与GAPDH PCR条带密度比较
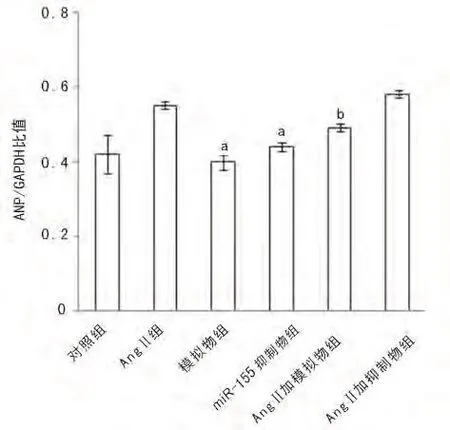
图8 各组细胞ANP相对表达量分析图
3 讨 论
miR是一类内源性非蛋白编码的单链小分子RNA,能在转录后水平抑制靶基因的表达或翻译,可在不同生理和病理状态下调节心肌细胞的增殖、分化及凋亡,对机械重塑、心电重塑均有重要影响[8]。本研究使用实时荧光定量PCR方法成功检测出体外培养心肌细胞株的 miR-155表达;而在 miR-155 mimics转入心肌细胞后可明显观察到miR-155表达增加到基础水平的3~4倍,而miR-155inhibitors可有效抑制miR-155表达;提示使用miR-155合成物可成功调节细胞内miR-155的表达水平,为进一步研究miR-155对细胞的影响提供了条件。
miR-155过表达能够有效抑制AngⅡ诱导的肥大心肌细胞表面的ATR1α基因和蛋白的表达,心肌肥厚的相关基因ANP、β-MHC的表达明显减少,心肌细胞表面积也明显减少,提示miR-155过表达可能通过下调ATR1α表达进而达到改善心肌肥大的作用。Cheng等[9]通过miR-155过表达干预严重子痫患者的体外培养脐静脉内皮细胞,观察到miR-155过表达可明显下调AT1R基因和蛋白水平的表达;这与本研究观察结果是相似的。研究还发现,对于未给以AngⅡ刺激诱导的肥厚心肌细胞,miR-155过表达或者抑制表达均未表现出对ATR1α显著的调节作用,也未表现出显著的改变心肌细胞肥大标记物β-MHC、ANP表达及改变心肌细胞表面积的作用,提示miR-155对正常心肌细胞和肥大心肌细胞ATR1α、β-MHC、ANP基因的调控具有时间分布的差异。Lunde等[10]使用miR基因芯片方法检测主动脉缩窄心肌肥厚大鼠模型心肌中miR表达时发现在主动脉缩窄造模后的1~14d均不能检测出miR-155表达,在14d后心肌肥厚程度较明显时才能检测到miR-155表达,与本研究的推测一致;提示miR-155主要在心肌肥大的晚期调控中发挥作用。
Heymans等[11]、Seok等[12]发现 miR-155过表达可通过多种途径促进心肌肥大和心力衰竭发生,沉默miR-155则改善心肌肥大,与本研究的结果不一致。分析可能与miR对细胞功能的调节过程往往涉及多个信号通路,且多个miR参与其中,miR之间也存在调节网络,其调节受到多因素的调控[13];而动物模型的差异导致不同信号通路的激活不同,得到不一致的结果,本研究组拟进一步在不同心肌肥厚的动物模型中验证miR-155对心肌肥厚的具体作用及探讨其涉及的调节通路。因此,通过本研究可证实miR-155能够有效抑制ATR1α基因和蛋白水平的表达,抑制由AngⅡ介导的心肌肥大。因此miR-155可作为高血压心肌肥大的调控靶点进一步进行深入的研究。
[1]Savoia C,Burger D,Nishigaki N,et al.AngiotensinⅡand the vascular phenotype in hypertension[J].Expert Rev Mol Med,2011,13:e11.
[2]Small EM,Olson EN.Pervasive roles of microRNAs in cardiovascular biology[J].Nature,2011,469(7330):336-342.
[3]Da Costa Martins PA,De Windt LJ.MicroRNAs in control of cardiac hypertrophy[J].Cardiovasc Res,2012,93(4):563-572.
[4]Faraoni I,Antonetti FR,Cardone J,et al.miR-155gene:a typical multifunctional microRNA[J].Biochim Biophys Acta,2009,1792(6):497-505.
[5]Blanco RR,Austin H,Vest RN,et al.Angiotensin receptor type 1single nucleotide polymorphism 1166A/C is associated with malignant arrhythmias and altered circulating miR-155levels in patients with chronic heart failure[J].J Card Fail,2012,18(9):717-723.
[6]Zheng L,Xu CC,Chen WD,et al.MicroRNA-155regulates angiotensin Ⅱ type 1receptor expression and phenotypic differentiation in vascular adventitial fibroblasts[J].Biochem Biophys Res Commun,2010,400(4):483-488.
[7]Xu Y,Hu X,Wang L,et al.Preconditioning via angiotensin Ttype 2receptor activation improves therapeutic efficacy of bone marrow mononuclear cells for cardiac repair[J].PLoS One,2013,8(12):e82997.
[8]Ono K,Kuwabara Y,Han J.MicroRNAs and cardiovascular diseases[J].FEBS J,2011,278(10):1619-1633.
[9]Cheng W,Liu T,Jiang F,et al.microRNA-155regulates angiotensinⅡtype 1receptor expression in umbilical vein endothelial cells from severely pre-eclamptic pregnant women[J].Int J Mol Med,2011,27(3):393-399.
[10]Lunde IG,Kvaloy H,Austbo B,et al.Angiotensin Ⅱ and norepinephrine activate specific calcineurin-dependent NFAT transcription factor isoforms in cardiomyocytes[J].J Appl Physiol,2011,111(5):1278-1289.
[11]Heymans S,Corsten MF,Verhesen W,et al.Macrophage microRNA-155promotes cardiac hypertrophy and failure[J].Circulation,2013,128(13):1420-1432.
[12]Seok HY,Chen J,Kataoka M,et al.Loss of microRNA-155protects the heart from pathological cardiac hypertrophy[J].Circ Res,2014,114(10):1585-1595.
[13]Wu G,Huang ZP,Wang DZ.MicroRNAs in cardiac regeneration and cardiovascular disease[J].Sci China Life Sci,2013,56(10):907-913.

